早期母爱剥夺促发抑郁并增加癫痫易感性
2013-11-23潘楠楠王敏冯海燕郑乃智
潘楠楠 王敏 冯海燕 郑乃智
研究发现大约有35%的癫痫患者可伴随抑郁症[1],同时抑郁样精神行为改变也可能是癫痫发作的危险因素之一[2]。关于癫痫与抑郁之间的相互关系并不明确,,但是抑郁造成癫痫易发的具体机制尚不清楚,而且也没有关于幼年及成年抑郁和癫痫的比较。
出生后早期是神经系统发育的高峰期,在这个时期经历应激,会对幼儿期及成年以后的行为及心理发育造成影响[3]。大量实验证明,出生后早期应激可以造成大鼠行为及神经分泌异常[4-5]。本研究采用母爱剥夺建立大鼠抑郁模型,评估抑郁状态后癫痫模型,观察癫痫发作潜伏期,探索癫痫发作第1周及第4周后与抑郁应激结束1周及4周后颗粒层细胞数变化,考察抑郁及急性癫痫发作后海马区颗粒层神经细胞的变化,进一步揭示抑郁状态对癫痫易感性的影响。
1 材料与方法
1.1 实验动物与分组出生当天的SPF级SD大鼠与母鼠一并购于广东省动物中心,饲养于中山大学实验动物中心。母鼠喂养饲料,饮用消毒水,日夜周期为12/12 h,室温在20℃~25℃左右。大鼠在P21断乳分笼饲养。
6窝新生雄性大鼠随机分为母爱剥夺组(M,n=20)和对照组(C,n=20)。M组雄性大鼠出生后接受母爱剥夺应激,C组不给予任何处理;在大鼠P34,以上两组大鼠各随机分为两组,其中一组接受匹鲁卡品腹腔注射,建立癫痫模型,分别为母爱剥夺+匹鲁卡品组(M+P)和对照+匹鲁卡品组(C+P),另外一组接受同等剂量的生理盐水腹腔注射,分别为母爱剥夺+生理盐水组(M+S)和对照组+生理盐水组(C+S)。
1.2 方法
1.2.1 母爱剥夺应激采用改良母爱剥夺应激方法[6]建立母爱剥夺大鼠模型,对照组老鼠不予以任何处理。
1.2.2 体重大鼠断乳后分笼饲养,自由摄食及饮水,每天8:00 am测大鼠体重,连续监测5 d,记录大鼠每日体重。
1.2.3 糖水偏好实验糖水偏好实验参照Vazquez V等和Willner P[7-8]等实验方法,计算大鼠饮用的蔗糖水量占总饮水量的比例及其与体重的比例。
1.2.4 建立癫痫模型参考John J等[9]方法建立癫痫模型。癫痫发作按照Racine’s法分为5级。记录大鼠首次出现癫痫发作的时间、首次出现Ⅳ及Ⅴ级发作的时间。
1.2.5 取材在癫痫模型建立后1周及4周,每组随机取5只大鼠,将大鼠以10%水合氯醛(35 mL/kg)麻醉,经升主动脉插管,4℃的生理盐水约150 mL冲洗后灌注4%多聚甲醛400 mL,取脑后浸入4%多聚甲醛,后固定(4~6)h。随后依次置于20%、30%蔗糖溶液至沉底,冰冻切片机(Leica德国)冠状位连续切片,片厚10 μm。自前囟后3.3~3.8 mm,每隔5张取1张脑片。置于-40℃冰箱备用。
1.2.6 NeuN免疫荧光染色冰冻切片自-40℃冰箱取出后,室温下复温10 min,0.3%TritonX-100,室温孵育10 min,0.01 MPBS(pH7.4)洗3次;滴加5%BSA封闭液,室温孵育lh;滴加单克隆小鼠抗大鼠NeuN 抗 体(Chemicon International Inc,Temecula,CA,美国)在4℃孵育16 h;0.01 MPBS洗3次;滴加FITC-偶联的抗小鼠二抗,室温避光孵育1h;0.01MPBS洗3次;共聚焦显微镜观察、拍照。
1.3 统计学方法采用SPSS11.5进行统计分析。实验计量资料数据用表示,ANOVA方差分析数据,检验水准α=0.05。
2 结果
2.1 体重与每日体重增长量母爱剥夺组大鼠体重(55.33±5.17 g)与对照组大鼠体重(78.64±1.51 g)相比显著减轻(P<0.05);连续监测5 d内每日体重增长,结果显示母爱剥夺组大鼠每日体重增长量(2.78±0.36 g)显著低于对照组大鼠(5.84±1.03 g,P < 0.05)(见图1)。
2.2 抑郁发生情况在蔗糖偏爱实验中,母爱剥夺组大鼠蔗糖偏爱比例(59.29%±5.59%)比对照组(77.06%±3.34%)显著降低(P<0.05),母爱剥夺组大鼠蔗糖消耗比例(66.17±4.58 mL/Kg)与对照组相比显著降低(85.90±7.54 mL/Kg,P< 0.05,见图2)。
2.3 癫痫发作情况给予同等剂量的匹鲁卡品后,母爱剥夺组大鼠首次出现癫痫发作的时间(3.62±0.37 min)较对照组显著缩短(6.37±0.59 min,P<0.05)。母爱剥夺组大鼠首次达到Racine’s法Ⅳ级发作的时间(8.87±0.87 min)较对照组显著缩短(13.50±1.16 min,P<0.05,见图3)。
2.4 海马齿状回颗粒层神经元变化NeuN免疫荧光染色(见图4):癫痫模型建立后1周,母爱剥夺+生理盐水组大鼠海马颗粒层NeuN阳性细胞数较对照+生理盐水组减少,而对照+匹鲁卡品组大鼠海马颗粒层NeuN阳性细胞数较对照+生理盐水组增多;癫痫模型建立后4周,母爱剥夺+生理盐水组大鼠海马颗粒层NeuN阳性细胞数较癫痫模型建立后1周显著增加,但仍少于对照+生理盐水组对照组,而对照+匹鲁卡品组大鼠海马颗粒层NeuN阳性细胞数增加不明显,但仍较对照+生理盐水组增多(见表1)。
3 讨论
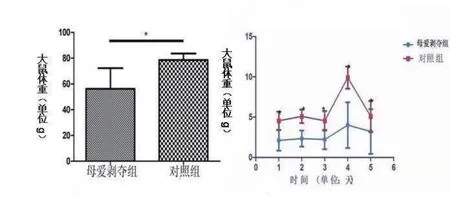
图1 大鼠体重与每日体重增长量*与对照组相比,P<0.05
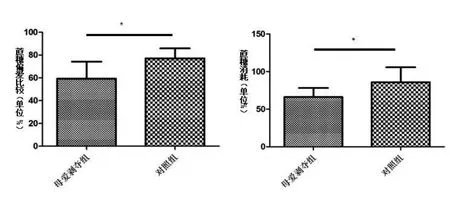
图2 大鼠蔗糖偏爱与蔗糖消耗*与对照组相比,P<0.05
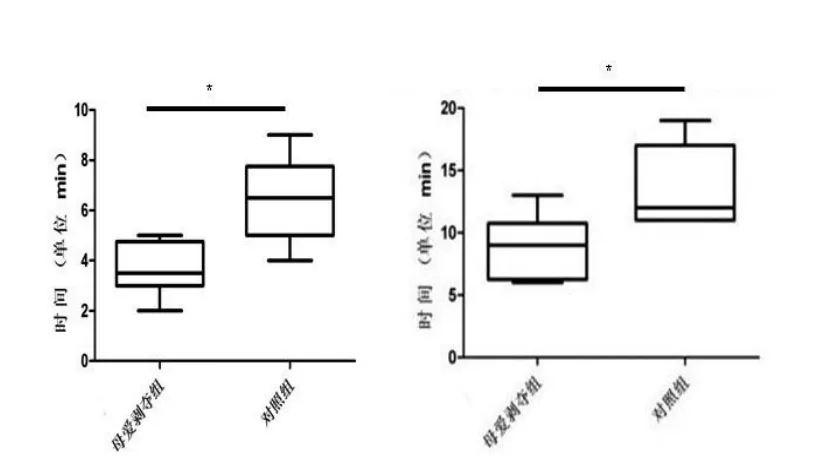
图3 大鼠癫痫发作情况 *与对照组相比,P<0.05

图4 大鼠海马颗粒层NeuN免疫荧光细胞数 A为对照+生理盐水组;B为母爱剥夺+生理盐水组;C为对照+匹鲁卡品组。标尺为10 μm
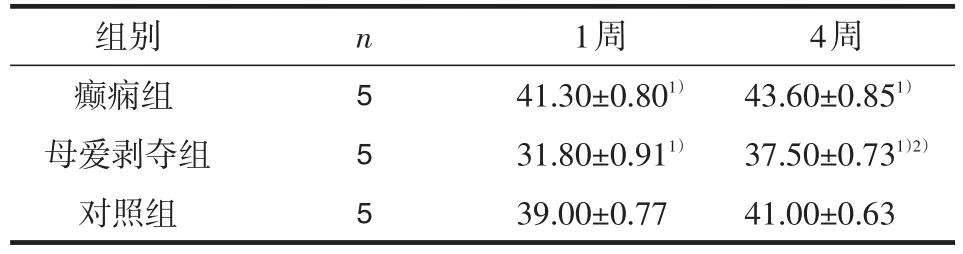
表1 大鼠海马颗粒层NeuN染色阳性细胞数(个/视野)
抑郁症为常见的神经心理疾病,其核心症状为情绪低落、思维迟缓、意志活动减退,还可能出现睡眠障碍、反复自杀念头等[10]。Phillips等[11]对我国四个省市进行流行病学调查发现,在我国抑郁症患病率约为2.06%。大量的实验证据支持,出生后早期应激可以导致成年后出现抑郁样精神行为改变[12-13]。出生后早期应激(如睡眠剥夺、社会隔离等)均能引起海马区神经元损伤,主要表现为神经元数目减少,而海马与记忆及学习密切相关,目前研究认为,海马区对应激敏感,而应激对海马造成的损害可能是导致抑郁样精神行为改变的病理学基础[14]。目前关于抑郁大鼠模型有很多种,其中母爱剥夺应激大鼠模型是最成熟的抑郁大鼠模型,模拟人类出生早期幼儿与母亲的相互关系,研究证实慢性、低程度的应激即可造成海马区CA1、CA3和颗粒层的长时程增强(long-term potentiation,LTP)突触传递效能,造成记忆能力减退[15-17]。
癫痫是与早年应激密切相关的一类疾病,大多数癫痫患者都是幼儿或儿童期起病,其发病的具体机制尚不明确,一项对颞叶癫痫手术治疗患者的调查显示,大部分患者都有幼儿期发热惊厥史[18]。Li H等[19]研究发现,应激对癫痫发作后海马区分子信号、细胞形态及大鼠行为改变具有协同作用。有研究者指出应激可能通过以下4个方面来影响癫痫易发性:①内分泌改变;②皮层或者皮层下结构改变;③神经递质异常;④免疫系统紊乱。其中皮层及皮层下结构改变已经得到广泛的认可,在动物抑郁模型中发现,成年动物海马CA3区细胞数目减少[20],这与在慢性癫痫动物模型中的发现一致[21]。
本研究结果发现,用母爱剥夺应激成功建立大鼠抑郁模型后,大鼠对匹鲁卡品敏感性显著增加,癫痫发作潜伏期显著较对照组缩短,说明母爱剥夺应激对癫痫发作具有易化作用。我们采用NeuN免疫荧光技术观察癫痫发作后1周及4周大鼠海马区颗粒层神经元数目改变,发现母爱剥夺应激对大鼠颗粒层神经发生的影响从幼年时期持续到大鼠成年以后,支持早年应激可以造成成人出现抑郁样精神行为改变。母爱剥夺应激造成大鼠海马颗粒层细胞数显著减少,使大鼠脑内正常神经网络结构造成破坏,这可能造成癫痫发作阈值降低,表现为给予匹鲁卡品后潜伏期明显缩短,癫痫易感性增加。
无论是抑郁还是癫痫,其发病机制都是复杂的,不是单一机制可以解释的,有关应激-抑郁-癫痫的分子生物学联系尚不清楚。我们进行本项研究的主要目的就是为了识别并预防因早年应激而导致的癫痫,但是出生后早期出现抑郁给予抗抑郁治疗是否会使癫痫易发性增强还不清楚,我们需还要进一步的实验研究,来证实早年应激与癫痫之间是怎样的具体联系,从而达到预防癫痫的目的。
[1]Tellez-Zenteno JF,Patten SB,Jetté N,et al.Psychiatric comor⁃bidity in epilepsy:a population-based analysis[J].Epilepsia,2007,48(12):2336-2344.
[2]Hesdorffer DC,Hauser WA,Ludvigsson P,et al.Depression and attempted suicide as risk factors for incident unprovoked seizures and epilepsy[J].Ann Neurol,2006,59(1):35-41.
[3]Heim C,Nemeroff CB.The role of childhood trauma in the neu⁃robiology of mood and anxiety disorders:preclinical and clinical studies[J].Biol Psychiatry,2001,49(12):1023-1039.
[4]Francis DD,Diorio J,Plotsky PM,et al.Environmental en-rich⁃ment reverses the effects of maternal separation on stress reac⁃tivity[J].Neurosci,2003,22(18):7840-7843.
[5]Tandberg E,Larsen JP,Aarsland D,et al.The occurrence of de⁃pression in Parkinson’s disease.A community-based study[J].Arch Neurol,2012,53(2):175-179.
[6]Vazquez V,Penit-Soria J,Durand C,et al.MD increases vulner⁃ability to morphine dependence and disturbs the enkephaliner⁃gic system in adulthood[J].Neurosci,2005,25(18):4453-4462.
[7]Vazquez V,Farley S,Giros B,et al.MD increases behavioural reactivity to stressful situations in adulthood:suppression by the CCK2 antagonist L365,260[J].Psychopharmacology,2005,181(4):706-713.
[8]Willner P,Towell A,Sampson D,et al.Reduction of sucrose preference by chronic unpredictable mild stress,and its restora⁃tion by a tri-cyclic antidepressant[J]. Psychopharmacology,1987,93(3):358-364
[9]John JM,Stefanie LB,Michael SH,et al.Altered Patterning of Dentate Granule Cell Mossy Fiber Inputs Onto CA3 Pyramidal Cells in Limbic Epilepsy[J].Hippo Campus,2011,21(1):93-107.
[10]郭雨欣,邢国刚.抑郁症的生物学机制研究进展[J].中国神经精神疾病杂志,2012,38(1):57-60.
[11]Phillips MR,Zhang J,Shi Q,et al.Prevalence,treatment,and as⁃sociated disability of mental disorders in four provinces in Chi⁃na during 2001-05:an epidemiological survey[J].Lancet,2009,373(9680):2041-2053.
[12]Talge NM,Neal C,Glover V,et al.Antenatal maternal stress and long-term effects on child neurodevelopment:how and why?[J].Child Psychol Psychiatry,2007,48(3-4):245-261.
[13]Morgan C,Fisher H.Environment and schizophrenia:environ⁃mental factors in schizophrenia:childhood traumae a critical re⁃view[J].Schizophr Bull,2007,33(1):3-10.
[14]Rao U,Chen LA,Bidesi AS,et al.Hippocampal changes associ⁃ated with early-life adversit and vulnerability to depression[J].Biol Psychiatry,2010,67(4):357-364.
[15]Bagot RC,van Hasselt FN,Champagne DL,et al.Maternal care determines rapid effects of stress mediators on synaptic plastici⁃ty in adult rat hippocampal dentate gyrus[J].Neurobiol Learn Mem,2009,92(3):292-300.
[16]潘苗,张三强,裴丽粉,等.慢性应激抑郁大鼠海马CA1神经元突触可塑性研究[J].中国神经精神疾病杂志,2012,38(11):72-76.
[17]Gruss M,Braun K,Frey JU,et al.Maternal separation during a specific postnatal time window prevents reinforcement of hippo⁃campal long-term poten tiation i n adolescent rats[J].Neurosci⁃ence,2008,152(1):1-7.
[18]Mathern GW,Babb TL,Vickrey BG,et al.The clinical-patho⁃logic mechanisms of hippocampal neuron loss and surgical out⁃comes in temporal lobe epilepsy[J].Brain,1995,118(Pt1):105-118.
[19]Li H,Gregory L,Ming L,et al.Maternal Deprivation stress exac⁃erbates cognitive deficits inimmature rats with recurrent seizures[J].Epilepsia,2002,43(10):1141-1148.
[20]Kumar G,Jones NC,Morris MJ,et al.Early life stress enhance⁃ment of limbic epileptogenesis in adult rats:mechanistic insights[J].PLoS One,2011,6(9):e24033.
[21]Hattiangady B,Shetty AK.Implications of decreased hippocam⁃pal neurogenesis in chronic temporal lobe epilepsy[J].Epilepsia,2008,49(S5):26-41.
