内囊预警综合征的临床分析(附6例报道)
2013-11-23高萍张志翔陈治国恽文伟
高萍 张志翔 陈治国 恽文伟
内囊预警综合征(capsular warning syndrome,CWS)由 Donnan等[1]首先提出,是属于一组特殊类型的短暂性脑缺血发作(TIA),也称为逐渐增强型TIA。临床表现为数天内刻板的、密集的TIA发作(至少3次以上),伴有发作性感觉和/或运动症状,无皮层受累表现。由于较一般TIA发作刻板,频率较高,发展成脑梗死的概率很高,最终经影像学检查发现梗死灶一般位于内囊,故称CWS。该研究通过分析这类特殊TIA的临床特点、影像特征、治疗效果等,旨在早诊断和早治疗,并探讨其发病机制,提高临床对其进展为脑梗死风险的防范意识。
1 对象和方法
收集2008-07-2012-5作者医院神经内科收治的CWS患者6例,诊断符合CWS标准。回顾性分析患者的临床资料,包括年龄、性别、既往TIA或卒中史、血管危险因素、入院时ABCD2评分、TIA发作症状、发作持续时间和频度、治疗情况、头颅DWI表现以及通过DSA或 MRA、CTA等对血管评价情况。
2 结果
2.1 患者一般资料 患者均为男性,年龄61~82岁,平均(68.5±7.6)岁。6例患者均存在危险因素。既往均无脑卒中史。入院时ABCD2评分为4~5分。具体结果见表1。
2.2 临床及影像学表现 每次发作持续时间为30s~90min,平均17min。每天发作次数为1~8次,总发作次数为4~14次。发作表现为单纯运动症状5例,运动、感觉同时受累1例。1例患者无临床症状,DWI检查未发现梗死灶,且为发作次数最少者;2例患者无神经功能缺损,但DWI检查发现内囊梗死灶(图1A);另3例患者遗留神经功能缺损,且DWI示内囊梗死2例,丘脑梗死1例(图1B)。1例患者DSA检查示病灶侧大脑中动脉局部欠光整(图2A),另1例CTA检查示病灶侧大脑后动脉局限性狭窄(<50%,图2B),其他4例DSA检查未见异常。
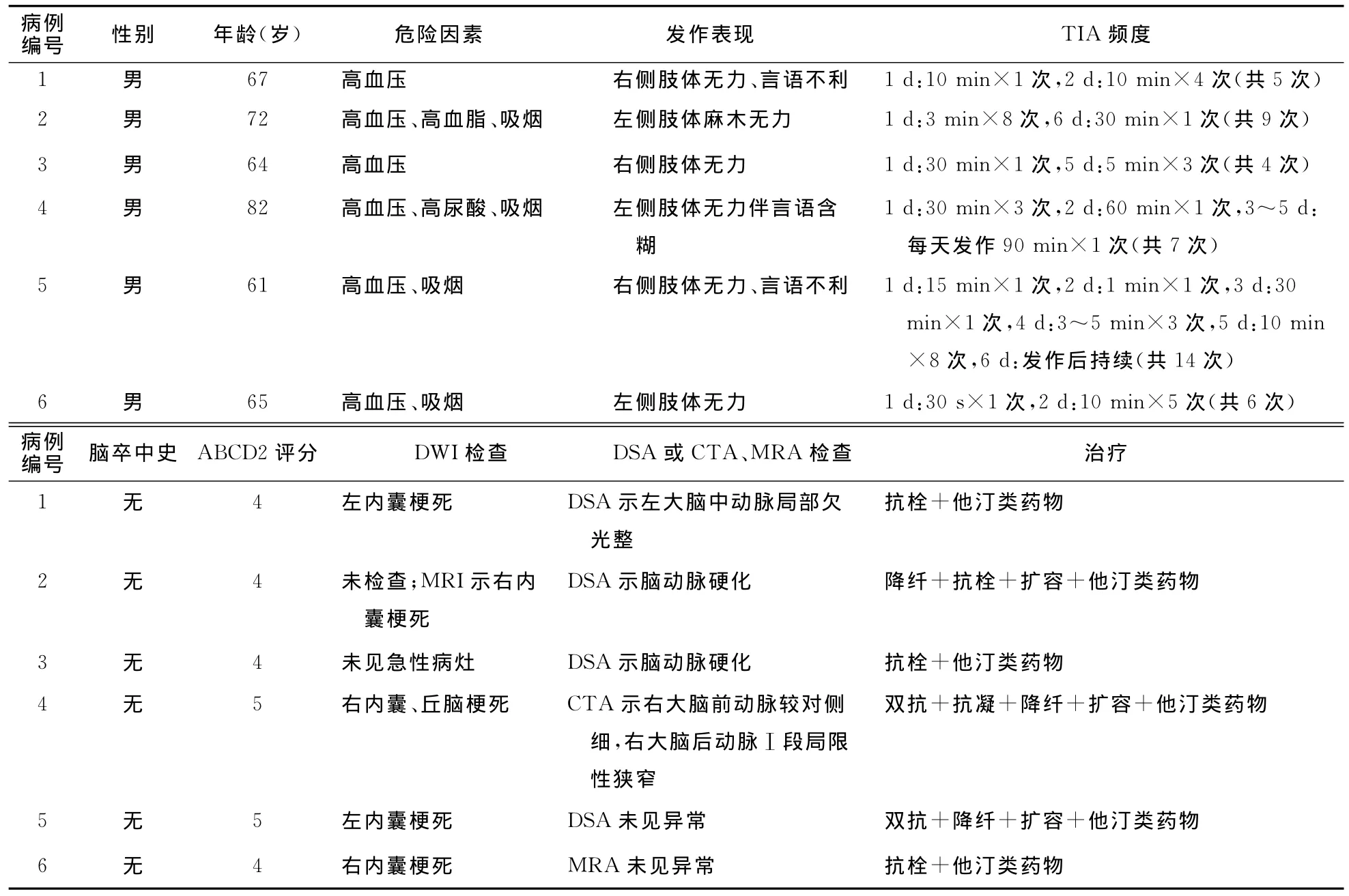
表1 6例患者的临床资料
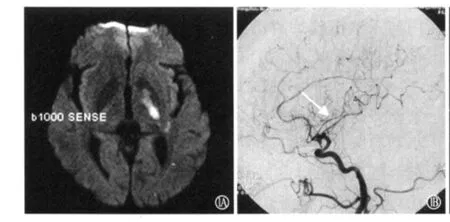
图1 例1患者DWI检查示左内囊后肢急性梗死(A),DSA检查示左侧大脑中动脉局部欠光整(箭头所示,B)
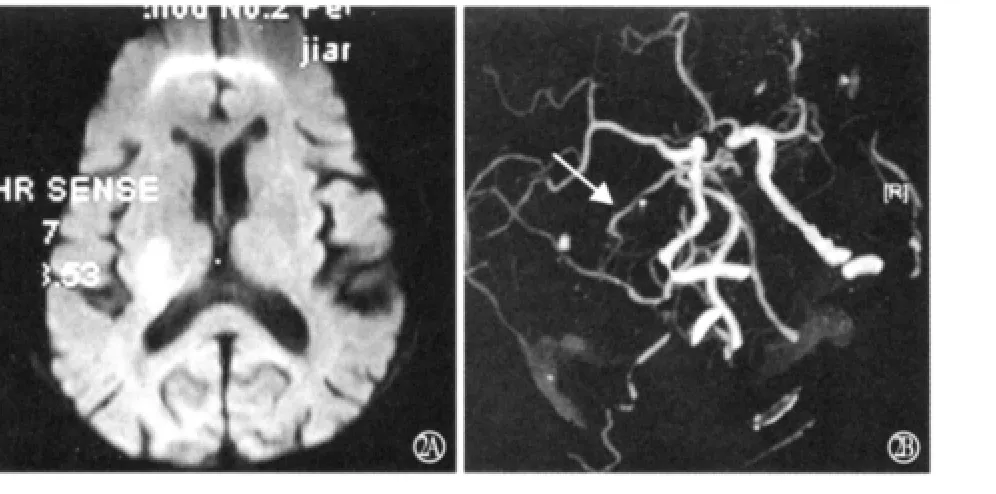
图2 例4患者DWI检查示右丘脑急性梗死(A),CTA检查示病灶对侧大脑后动脉局限性狭窄(箭头所示,B)
2.3 治疗 所有患者入院前均未服用抗栓药。入院后3例予抗栓+东菱迪芙降纤治疗,其中2例予阿司匹林0.3g+波立维150mg双抗治疗,1例同时应用低分子肝素抗凝7d;3例予阿司匹林0.3g抗栓。均同时使用他汀类药物及扩容治疗。
3 讨论
CWS属于TIA中一类特殊亚型,并非一种独立的新疾病,临床对其有特殊的定义:(1)系皮层下内囊部位缺血所致;(2)不伴有皮层症状如视觉忽略、失语或失用等;(3)临床特征表现为一侧面部、上肢和(或)下肢发作性的麻木、偏瘫等;(4)临床症状在短期内频繁发生,且在短期内缓解;(5)反复发作后,多数患者于内囊部位可发现与临床症状相一致的梗死灶。(6)血管造影往往无明显大血管狭窄。本文6例患者均符合上述定义。CWS与经典TIA有诸多不同。
3.1 发作频率及强度 短时间内频繁发作,这是CWS最重要的特征之一。Donnan等[1]对CWS进行了描述:24h内有3次或3次以上发作,可于短期内缓解,频繁发作的间歇期有逐渐缩短的倾向,呈典型的反复-刻板的特点。在Donnan等[1]报道的50例患者中,1例3h内共发作5次,1例4 d内发作13次,发作持续时间为2min~4h,平均6.1min。该组6例患者中,最频繁的1例24h内发作8次,每次仅3~5min;最少的病例在6d病程中发作了4次;持续时间最短为30s,最长为90 min,平均17min。发作最短的这位患者脑电图未见异常,发作症状为神经系统缺损表现,排除了痫性发作。既往曾有文献报道[2]CWS发作最短仅数秒至半分钟,类癫痫样发作。本组部分患者发作间期症状仅部分缓解,提示已发生脑梗死,此后仍反复发作,直至最后一次发作后症状持续不反复,发作结束。因此有学者称为“类TIA发作”、“短暂征象的脑梗死”[2]。
3.2 易转化为脑梗死 极易转化为脑梗死是CWS的另一重要特征。Donnan等[1]报道的病例中有42%发作后经CT证实存在相应的脑梗死灶。DWI检查可早期明确是否有新发梗死。ABCD2量表评分也可预测近期脑梗死发生的概率[3]。本组6例患者ABCD2评分均在4分以上,属中等以上危险。5例均经DWI证实为急性内囊或丘脑梗死,尽管其中2例未遗留症状及体征。1例干预后未遗留症状、体征及DWI损害,也有可能在病程初期DWI曾有一过性病灶,灌注改善后影像异常消失。因为早期脑梗死若干预得当,可出现DWI高信号可逆性变化的情况[4]。还有1例82岁患者入院1周内症状频繁发生,2次动态DWI观察发现第2次梗死范围较第1次有所增大。因此若能对此类患者进行DWI动态观察,则可能观察到脑缺血的演变过程。
3.3 脑梗死好发部位 梗死好发于内囊、丘脑、脑桥等部位,可影响中央运动通路。甚至有文献报道病灶可延伸至内侧苍白球、壳核,甚至放射冠,故扩大外延后也称“桥脑预警”、“丘脑预警”[2,5]。本组患者经影像证实病灶均在内囊或丘脑,病例3虽未发现病灶,但发作时的定位也在脑桥以上至基底节的锥体束通路上,无脑干及皮层征象,考虑脑深部白质的可能性大,符合CWS的好发部位。DWI的应用为明确损害部位提供了有力证据。这些好发部位在一定程度上表明病灶的发生有其特殊的病理生理机制。
3.4 影像学检查 DSA或 MRA、CTA检查未发现颅内外大血管病变,刻板发作也与大动脉狭窄导致的动脉-动脉栓塞或低灌注关系不大,可能为小血管自身变化,如小动脉粥样硬化。本组5例患者DSA或CTA、MRA均未发现颅内外大动脉明显狭窄,仅病例1DSA检查示病灶侧大脑中动脉局部欠光整,但无狭窄,表明临床未发现大血管病变的证据。
3.5 治疗 CWS对多种治疗(包括联合治疗)的疗效不佳,如抗血小板聚集、降纤、抗凝、扩容、稳定斑块、控制血管危险因素等处理均很难控制其发作。有作者认为r-tPA溶栓可能有效,但证据不足。本组病例除给予上述处理外,在血压的控制方面也很慎重,2例患者发作期进行了血压监护,均未有低血压发生,相反在发作时血压均偏高。文献也有类似报道[6-7],但其机制不明,间接提示目前采用的干预措施针对的其发病机制可能并不完全相符。
关于CWS的发病机制目前尚未完全阐明。文献普遍认为与原位穿支动脉粥样硬化有关,推测小动脉粥样硬化、微血栓、血流动力学改变可能参与其发病机制[1,4,7],终末血管供血区阵发性低灌注,而侧支循环建立不充分导致了发作性神经功能缺损,最终发生的梗死提示低灌注基础上小动脉血栓形成[6]。特别是一些终末动脉较易发生,如内侧豆纹动脉群、脉络膜前动脉、丘脑膝状体动脉的终末支或脑桥动脉旁正中支,因此会出现常见的内囊、丘脑、壳核、脑桥损害,影响中央运动通路。此外梗死灶周脑组织的“发作性去极化”影响了运动通路的连接也可能与发病有关[1]。穿支动脉低灌注和分子机制分别解释了患者发作时的刻板和频发现象。本组患者未发现明显的颅内外动脉狭窄,也无低血压,病灶为运动通路上的腔梗,比较支持上述机制。Lee等[8]报道了1例大脑中动脉主干狭窄阻塞豆纹动脉开口导致的CWS,经支架治疗后症状缓解,DWI未见梗死灶。也有学者认为反复TIA发作的机制是脉络膜前动脉狭窄导致终末血管的灌注不足[9]。提示CWS的责任血管可能也可以是大脑中动脉或脉络膜前动脉本身,只是最直接的原因是阻塞了穿支动脉而产生症状,这也可能表明某些病例的发病机制属于这一类型,导致常规干预疗效不好。载体动脉粥样硬化斑块阻塞穿支或穿支动脉粥样硬化目前还需要足够的手段证实。鉴于临床难以发现大血管病变的依据,CWS与穿支动脉病变关系更大,因此好的动物模型、高分辨率MRI成像、动态DWI的演变观察和动脉粥样硬化斑块的分析将有助于更好地阐明发病机制,扩充TIA的概念。一些少见原因,如显微镜下多发性血管炎[10]、大脑中动脉夹层[11]、硬脑膜窦血栓[12]也见有个案报道。尽管存在治疗抵抗,治疗方案也无定论,但由于存在穿支动脉低灌注可能,因此维持血压、扩容及抗栓治疗仍很必要,联合治疗可能对预防梗死恶化有效。对于短期可能出现脑梗死,是否值得溶栓也需要探讨[13]。
总之,CWS的特殊性值得重视,应寻找小动脉病变的证据,并进一步探究其病理生理机制,进行及早干预以避免病情恶化。
[1]Donnan GA,O’Malley HM,Quang L,et al.The capsular warning syndrome:pathogenesis and clinical features[J].Neurology,1993,43(5):957-962.
[2]Staaf G,Geijer B,Lindgren A,et al.Diffusion-weighted MRI findings in patients with capsular warning syndrome[J].Cerebrovasc Dis,2004,17(1):1-8.
[3]Sheehan OC,Merwick A,Kelly LA,et al.Diagnostic usefulness of the ABCD2score to distinguish transient ischemic attack and minor ischemic stroke from noncerebrovascular events:the North Dublin TIA Study[J].Stroke,2009,40(11):3449-3454.
[4]韩鸿宾,谢敬霞.MR扩散与灌注成像在脑缺血诊断中的应用[J].放射学杂志,1998,32(6):364-369.
[5]Saposnik G,Noel de Tilly L,Caplan LR.Pontine warning syndrome[J].Arch Neurol,2008,65(10):1375-1377.
[6]Fahey CD,Alberts MJ,Bernstein RA.Oral clopidogrel load in aspirin-resistan capsular warning syndrome[J].Neurocrit Care,2005,2(2):183-184.
[7]Lalive PH,Mayor I,Sztajzel R.The role of blood pressure in lacunar strokes preceded by TIAs[J].Cerebrovasc Dis,2003,16(1):88-90.
[8]Lee J,Albers GW,Marks MP,Capsular warning syndrome caused by middle cerebral artery stenosis[J].J Neurol Sci,2010,296(1-2):115-120.
[9]Caporale CM,Notturno F,Caulo M,et al.Capsular warning syndrome mimicking ajacksonian sensory march[J].J Neurol Sci,2009,285(1-2):262-264.
[10]Tang CW,Wang PN,Lin KP,et al.Microscopic polyangiitis presenting with capsular warning syndrome and subsequent stroke[J].J Neurol Sci,2009,277(1-2):174-175.
[11]Prabhakaran S,Krakauer JW.Multiple reversible episodes of subcortical ischemia following postcoital middle cerebral artery dissection[J].Arch Neurol,2006,63(6):891-893.
[12]Ferro JM,Falcao F,Melo TP,et al.Dural sinus thrombosis mimicking“capsular warning syndrome”[J].J Neurol,2000,247(10):802-803.
[13]Vivanco-Hidalgo RM,Rodriguez-Campello A,Ois A,et al.Thrombolysis in capsular warning syndrome[J].Cerebrovasc Dis,2008,25(5):508-510.
