急性髓系白血病患者SALL4基因的甲基化改变及其临床意义
2013-11-22焦夕琴陈芹林江杨静陈星星汤琴钱震马吉春
焦夕琴,陈芹,林江*,杨静,陈星星,汤琴,钱震,马吉春
(1.江苏大学附属金坛医院检验科,江苏金坛213200;2.江苏大学附属人民医院中心实验室,江苏 镇江212002;3.江苏大学附属人民医院血液科,江苏镇江212002;4.江苏大学附属金坛医院血液科,江苏金坛213200)
婆罗双树样基因4(Sal-like 4,SALL4)是果蝇婆罗双树基因spalt的同源基因SALL家族成员,编码蛋白是1个含有8个锌指基序的转录因子,是维持胚胎干细胞多潜能分化和自我更新及增强造血干细胞自我更新的重要调控基因[1-2]。近年来研究发现,SALL4基因在造血系统肿瘤[急性髓系白血病(acute myeloid leukemia,AML)、慢性髓系白血病、B细胞急性淋巴细胞白血病]、生殖细胞肿瘤和肝样胃癌中表达增高,可能与这些疾病的发生发展相关[3-7]。但SALL4基因高表达的机制至今还未清楚。鉴于DNA甲基化对基因表达的可能调控作用,并且罕见AML患者中SALL4基因启动子的甲基化状况报道,我们建立了甲基化特异性PCR(methylation-specific PCR,MSP)技术对AML患者SALL4基因启动子甲基化状态进行检测并评价其临床意义。
1 对象与方法
1.1 病例
45例初诊原发AML患者,其中男29例,女16例,年龄15~86岁(中位年龄56岁),所有患者依据2008年世界卫生组织AML分型标准[8]进行诊断、分型,均经细胞形态学、免疫学、染色体和(或)融合基因检测证实。其中AML伴t(8;21)4例、AML伴t(15;17)9例、AML不成熟型7例、AML成熟型9例、急性粒-单核细胞白血病13例、急性原始单核细胞白血病和急性单核细胞白血病2例、急性红白血病1例。另以20例缺铁性贫血患者的骨髓mRNA和基因组DNA作为对照。
1.2 细胞系
5 种人白血病细胞株(HL60、HEL、NB4、THP1和U937)以1×106/mL的密度置于细胞培养瓶中,加入5 mL含10%胎牛血清的RPMI 1640培养液,置于含5%CO2的细胞培养箱中。于指数生长期收获细胞提取总RNA和基因组DNA。
1.3 主要试剂和仪器
参见文献[9]。
1.4 骨髓单个核细胞(bone marrow mononuclear cell,BMNC)分离和基因组DNA制备
全部受试者于骨髓穿刺时取骨髓10 mL,肝素抗凝,Ficoll密度梯度离心法分离BMNC。基因组DNA提取按试剂盒说明书操作,经紫外分光光度仪定量后置于-20℃保存备用。
1.5 DNA亚硫酸氢盐修饰
每例取DNA标本1 μg,按DNA甲基化修饰试剂盒操作步骤进行亚硫酸氢盐修饰处理,-80℃保存备用。
1.6 总RNA提取、反转录及SALL4表达检测
总RNA提取方法、反转录体系、反应条件和检测SALL4表达的RQ-PCR引物、反应体系及反应条件见文献[6]。
1.7 SALL4基因启动子MSP检测
SALL4基因甲基化(M)上游引物:5'-CGTATTTTCGGGTTTGTCGC-3',下 游 引 物:5'-TTTCTACCCGAACTACGCCG-3';未甲基化(U)上游引物:5'-TTTGTATTTTTGGGTTTGTTGT-3',下游引物:5'-CTTTTCTACCCAAACTACACCA-3'。热启动PCR反应体系为25 μL,包括10 ×PCR 缓冲液、2.5 mmol/L MgCl2、2.5 mmol/L dNTP、上下游引物各 0.4 μmol/L、1 U热启动Taq DNA酶及修饰后的样本DNA 2 μL。MSP反应条件经梯度PCR仪优化,为95℃预变性5 min,然后94℃ 30 s。退火温度:甲基化为63℃ 30 s、未甲基化为59℃ 30 s,然后72℃延伸30 s,扩增40个循环,最后72℃延伸7 min。未甲基化和甲基化阳性对照分别为经亚硫酸氢盐修饰的正常人胎盘DNA和亚硫酸氢盐修饰的人白血病K562细胞株DNA,去离子水作为阴性对照。扩增产物在2%琼脂糖凝胶上采用100 V电压电泳1 h,在Gene Genius凝胶成像仪下观察电泳结果。
1.8 MSP特异性、敏感性及重复性检测
K562细胞和正常人胎盘DNA分别经测序后鉴定为SALL4完全甲基化和完全未甲基化。应用MSP甲基化和未甲基化反应体系分别对硫化和未硫化的K562细胞DNA标本、胎盘DNA标本及双蒸水进行检测,确定MSP特异性。取80 ng经亚硫酸氢盐修饰的正常人胎盘DNA,应用经亚硫酸氢盐修饰后的K562细胞DNA进行梯度稀释后行未甲基化MSP检测,即未甲基化阳性对照经甲基化阳性对照进行梯度稀释以确定未甲基化MSP方法的敏感性。同时对1例正常人胎盘DNA标本进行亚硫酸氢盐修饰后分装,将其在同一批次MSP未甲基化检测中重复3次,2%琼脂糖凝胶电泳并拍照;将剩余的阳性DNA置于-20℃冻存,每3天进行一次未甲基化检测,2%琼脂糖凝胶电泳并拍照,比较1个月内条带亮度是否有明显变化。
1.9 PCR产物克隆测序
用AxyPrep DNA凝胶回收试剂盒对PCR阳性产物进行纯化回收,将其克隆入pMD®19T克隆载体,对感受态大肠埃希菌DH5α进行转化和蓝白斑筛选,挑选白色菌落进行PCR扩增鉴定,将PCR扩增为阳性结果的甲基化和未甲基化产物送上海生工生物技术有限公司测序。
1.10 细胞遗传学检查
将患者初诊时采集的骨髓细胞采用直接法和24 h短期培养法制备染色体标本,然后进行R显带处理。按《人类细胞遗传学国际命名体制(ISCN)》进行核型分析。根据患者预后情况将染色体分为3组:低危组[t(15;17)、t(8;21)、t(16;16)等]、中危组[正常核型、t(9;11)、9q-、11q-、-Y、+21、+8等]、高危组[复杂核型、11q23重排、t(9;22)、5q-、-5、-7、7q-等][10]。
1.11 统计学分析
应用SPSS 17.0软件对MSP结果进行统计。分类变量之间差异的比较采用Pearson卡方检验或Fisher确切概率法;连续性变量之间差异分析采用Mann-Whitney U检验。所有分析均设定P值为双侧分布,以P<0.05为差异有统计学意义。
2 结果
2.1 MSP 测序结果
SALL4甲基化和未甲基化阳性产物测序结果见图1。甲基化产物中所有胞嘧啶和鸟嘌呤二核苷酸(CpG)中的胞嘧啶保持不变,而CpG以外的胞嘧啶均转变为胸腺嘧啶;未甲基化产物中的胞嘧啶全部转变为胸腺嘧啶。

图11 例AML患者SALL4基因甲基化特异性PCR阳性产物测序结果
2.2 MSP特异性、敏感性及重复性
硫化修饰后的K562细胞DNA显示为甲基化条带,而无未甲基化条带;硫化后的胎盘DNA显示未甲基化条带,而无甲基化条带;未硫化的K562细胞DNA和胎盘DNA及双蒸水甲基化和未甲基化结果均为阴性,说明我们建立的MSP方法具有良好的特异性。未甲基化阳性对照用甲基化阳性对照进行梯度稀释后,SALL4未甲基化检测的最大灵敏度达1∶50(2%)。见图2。同一批次MSP未甲基化检测中3次结果及每3天对冻存标本进行一次未甲基化检测的重复性良好,1个月内条带亮度无明显变化。

图2 SALL4启动子未甲基化阳性模板倍比稀释结果
2.3 AML患者SALL4基因低甲基化频率
5种白血病细胞株 HL60、HEL、NB4、THP1 和U937均呈不同程度的SALL4低甲基化,其MSP结果见图3。典型的患者标本MSP检测结果见图4。

图3 5种白血病细胞株甲基化特异性PCR产物

图4 AML患者MSP产物电泳结果
20例缺铁性贫血标本均为甲基化MSP产物阳性、低甲基化MSP产物阴性,低甲基化阳性率为0%(0/20);45例AML标本均为甲基化MSP产物阳性,其中9例呈低甲基化产物阳性,低甲基化阳性率为20.0%(9/45),与对照组差异具有统计学意义(P<0.05)。统计学分析揭示SALL4基因低甲基化改变与患者的年龄、性别、血红蛋白、血小板计数等结果均无相关性(P>0.05),但与患者的白细胞计数显著相关,低甲基化患者的白细胞水平明显高于甲基化患者(P=0.027)。见表1。
2.4 AML患者中SALL4低甲基化与SALL4表达的相关性
我们检测了23例AML患者的mRNA SALL4表达水平,SALL4表达水平和SALL4低甲基化明显相关,低甲基化患者(3例)的SALL4表达水平明显高于甲基化患者(20例,P<0.05,表1)。5种白血病细胞株均呈SALL4阳性表达[6],与本研究检测的细胞株SALL4低甲基化阳性结果相符。
2.5 SALL4低甲基化改变与AML亚型的关系
AML患者WHO分型中,不同亚型的患者间SALL4低甲基化频率不同,但7类亚型间差异并无统计学意义(P >0.05,表1)。
2.6 SALL4低甲基化改变与染色体核型的关系
33例患者获得染色体核型资料,其中,核型异常者占57.6%(19/33)。2例SALL4低甲基化阳性患者染色体分析失败,其余7例低甲基化阳性患者均见于中危和高危患者,低危患者均未见SALL4低甲基化,两组差异具有统计学意义(P<0.05,表1)。
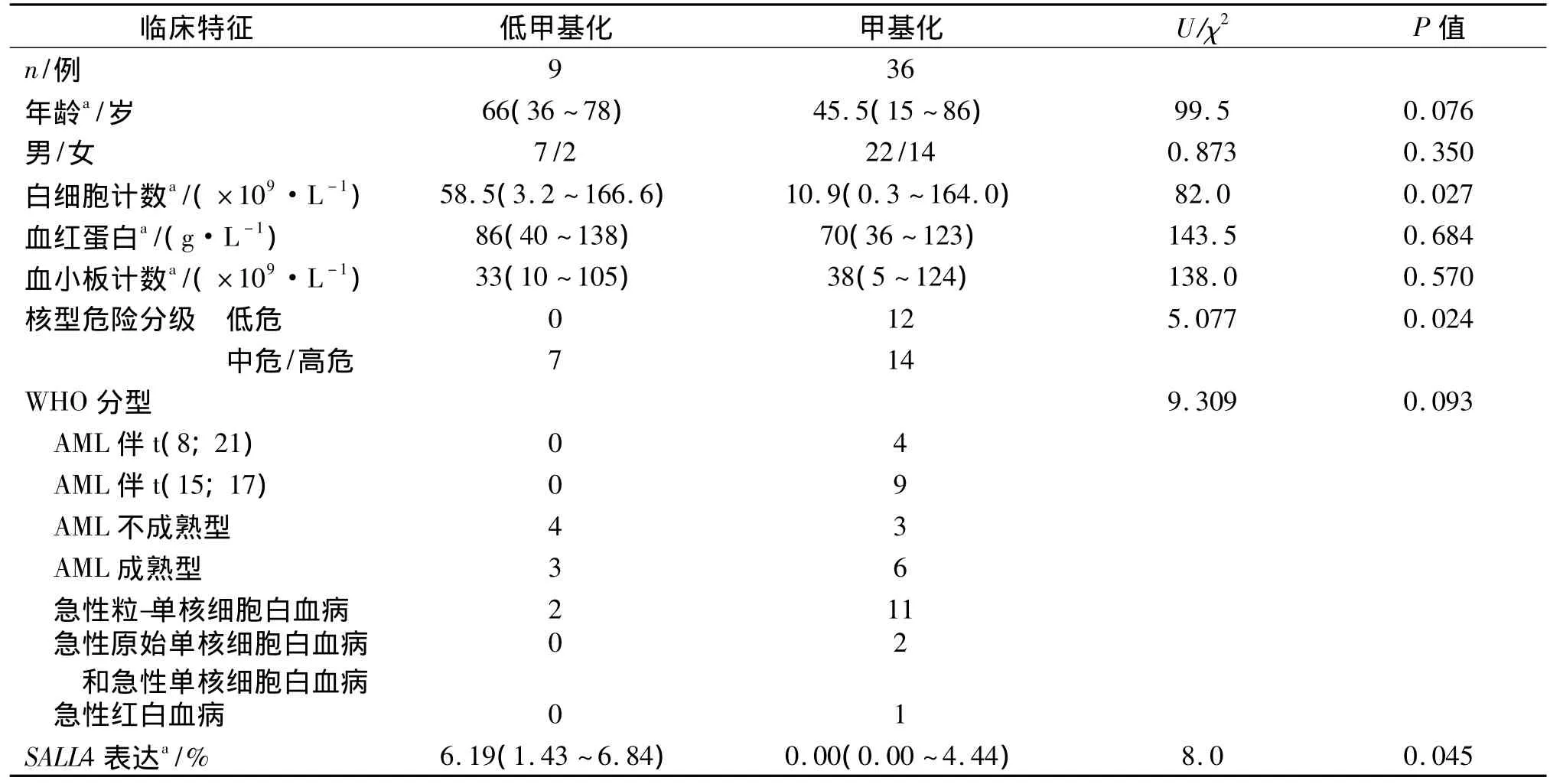
表1 SALL4甲基化状态与AML患者临床特征的相关性
3 讨论
DNA甲基化是细胞的一种表观遗传现象,在细胞分化、发育及增殖过程中起着十分重要的作用。DNA的异常甲基化与肿瘤的发生发展密切相关,低甲基化改变是肿瘤形成过程中的一个特征性表观遗传学改变[11]。近年来,DNA甲基化已经在肿瘤发生学领域得到广泛研究,尤其是在肿瘤的早期诊断、分级分类、疾病监测及预后评估中的潜在价值受到越来越多的关注。
本研究建立了SALL4基因启动子甲基化检测的MSP技术,该方法经证明具有良好的特异性、敏感性和重复性,并且对1例随机选取的阳性标本测序证明其序列是正确的,保证了结果的可靠性,这些充分说明我们建立的MSP技术可用于临床标本SALL4基因启动子甲基化状态的检测。本研究对45例AML患者标本进行检测,证实初发AML患者中存在SALL4基因启动子低甲基化,其阳性率为20.0%,与对照组间的差异具有统计学意义(P<0.05),揭示 SALL4启动子低甲基化改变可能与AML发病相关。
AML患者及白血病细胞株中SALL4基因启动子低甲基化和SALL4基因高表达相关,提示该基因启动子甲基化状态是调控该基因表达的一个机制。5-氮杂胞苷和5-氮杂-2'-脱氧胞苷是两种强有力的DNA去甲基化药物,现已用于治疗骨髓增生异常综合征和AML。但是,这类药物的弊端在于可以激活沉默的癌基因,使之表达,导致肿瘤的生长[11-12]。近期一项研究发现,SALL4基因可以通过调节ATP结合盒转运基因和维持侧群细胞的数量而产生耐药作用[13],故AML患者中SALL4基因能否被激活还需要通过对DNA去甲基化药物的临床应用加以确定。
AML患者中SALL4启动子低甲基化和患者的核型危险分级相关。SALL4低甲基化只出现在中危和高危患者中,未出现于t(8;21)或t(15;17)这类预后良好的核型患者中,提示SALL4基因启动子低甲基化改变可能与AML患者预后相关。
我们的研究结果还表明,AML患者中SALL4低甲基化与高水平的白细胞计数相关,这点可能反映SALL4基因在控制白血病细胞的增殖中起作用。
综上所述,SALL4低甲基化是AML患者中一个常见分子事件,可能与AML患者中高危核型相关。
[1] Zhang J,Tam WL,Tong GQ,et a1.Sall4 modulates embryonic stem cell pluripotency and early embryonic development by the transcriptional regulation of Pou5f1[J].Nat Cell Biol,2006,8(10):1114 -1123.
[2] Yang J,Aguila JR,Alipio Z,et a1.Enhanced self-renewal of hematopoietic stem/progenitor cells mediated by the stem cell gene Sall4[J].J Hematol Oncol,2011,4:38.
[3] Ma Y,Cui W,Yang J,et al.SALL4,a novel oncogene,is constitutively expressed in human acute myeloid leukemia(AML)and induces AML intransgenic mice[J].Blood,2006,108(8):2726 -2735.
[4] Cui W,Kong NR,Ma Y,et a1.Differential expression of the novel oncogene,SALL4,in lymphoma,plasma cell myeloma,and acute lymphoblastic leukemia[J].Mod Pathol,2006,19(20):1585 -1592.
[5] 郭野,崔巍,崔京涛,等.急性髓细胞白血病中婆罗双树样基因4的表达及其临床意义[J].中华检验医学杂志,2009,32(1):25-29.
[6] 陈芹,钱军,林江,等.急性和慢性髓系白血病患者SALL4基因的表达[J].中国实验血液学杂志,2013,21(2):315-319.
[7] 林江,纪润璧,钱军.转录因子婆罗双树样基因4(SALL4)研究进展[J].中国实验血液学杂志,2011,19(3):820-823.
[8] Swerdlow SH,Campo E,Harris NL,et al.WHO classification of tumours of haematopoietic and lymphoid tissues in 2008[M].Lyon,France:IARC Press,2008.
[9] 李云,钱军,陈芹,等.慢性髓系白血病PDLIM4基因表达与其启动子甲基化水平的关系[J].江苏大学学报:医学版,2013,23(1):17-21,25.
[10] Slovak ML,Kopecky KJ,Cassileth PA,et al.Karyotypic analysis predicts outcome of preremission and postremission therapy in adult acute myeloid leukemia:a SouthwestOncology Group/Eastern Cooperative Oncology Group Study[J].Blood,2000,96(13):4075 -4083.
[11] Esteller M.Epigenetics in cancer[J].N Engl J Med,2008,358(11):1148 -1159.
[12] Kelly TK,De Carvalho DD,Jones PA.Epigenetic modifications as therapeutic targets[J].Nat Biotechnol,2010,28(10):1069 -1078.
[13] Jeong HW,Cui W,Yang Y,et al.SALL4,a stem cell factor,affects the side population by regulation of the ATP-binding cassette drug transport genes[J].PLoS One,2011,6(4):e18372.
