内镜黏膜下层剥离术治疗胃肠道间质瘤26例临床报告
2013-11-22蒋小猛徐岷魏金文王晓燕张尤历陈萍徐美东
蒋小猛,徐岷,魏金文,王晓燕,张尤历,陈萍,徐美东
(1.江苏大学附属医院消化科,江苏镇江212001;2.复旦大学附属中山医院普外科,上海200032)
胃肠道间质瘤(gastrointestinal stromal tumors,GIST)是一类较为罕见的间叶源性肿瘤,于1983年首次作为一类具有独立病理特征的肿瘤被人们认识。传统的放化疗对GIST患者几乎无效,手术切除成为治疗的主要手段[1]。但手术创伤大,术后恢复慢,特别是对于一些直径较小的肿瘤,外科手术已渐渐失去优势。内镜下黏膜下层剥离术(endoscopic submucosal dissection,ESD)可以对病变进行整块切除,具有更高的根治切除率,而且能够最小化切除部位,从而提高患者的生活质量,目前越来越多被用于胃肠道早期肿瘤的治疗[2]。我们应用内镜下黏膜下层剥离术治疗胃肠道黏膜下隆起性病变,特别是胃肠道间质瘤,取得了较好的疗效,现报告如下。
1 对象与方法
1.1 一般资料
收集2009年6月至2012年7月间江苏大学附属医院经常规内镜检查发现的黏膜下肿瘤患者共26例临床资料。其中男17例,女9例;年龄31~74(平均50.81±11.97)岁。所有患者均行超声内镜(endoscopic ultrasonography,EUS)检查,对确定肿瘤来源于固有肌层、初步诊断为GIST的患者进行ESD治疗。患者主要临床症状为上腹不适、隐痛(16例),黑便(2例),吞咽困难及胸骨后不适(2例),腹泻(1例),体检发现5例。肿瘤直径0.5~4.0(平均2.07±1.10)cm。肿瘤位于食管 7例、胃底 10例、胃体5例、胃窦3例、直肠1例。25例为单发肿瘤,1例为胃底两个相邻肿瘤。所有患者术前检查血常规、凝血常规、肝肾功能、心电图等无明显异常,术前1周内未服用阿司匹林及氯吡格雷等抗凝药物。术前告知手术风险及收益,签署知情同意书。
1.2 手术器械
GIF-H260电子胃镜、CF-Q260电子肠镜、黏膜下注射针、黏膜下剥离刀(KD-630L Flex刀、KD-620LR Hook刀、KB-611L IT刀)、D201系列透明帽、HX-610-135内镜钛夹(奥林巴斯公司,日本);ICC 200高频电切装置及APC300氩气发生器(ERBE公司,德国)。
1.3 ESD 方法
1.3.1 一般处理 患者的所有操作在手术室进行。静脉注射丙泊酚诱导麻醉。上消化道手术患者常规行气管插管。
1.3.2 ESD主要步骤 ① 标记:在隆起病灶边缘外约0.5 cm处进行电凝标记;② 黏膜下注射:将5 mL靛胭脂、1 mL肾上腺素及100 mL生理盐水配成的混合溶液于隆起病灶边缘标记点外侧进行多点黏膜下注射,使得病灶充分隆起;③预切开:沿病灶边缘标记点预切开黏膜,以便充分显示黏膜下病变,利于进一步剥离肿瘤;④ 剥离病变:用IT刀或Flex刀切开黏膜下层,显露固有肌层病变后,于病灶边缘对病变进行完整剥离,对较大病变,特别是直径大于3 cm的病灶,在剥离近结束时,采用圈套器于病变根部圈套病变进行完整电切;⑤创面处理:切除过程中及切除结束后,对创面显露的小血管及时应用氩离子血浆凝固术(argon plasm coagulation,APC)进行预防性止血。对术中发生的穿孔或切除后病变薄弱处采用钛夹封闭。⑥标本处理:大头针固定切除标本于平板上,10%中性甲醛液浸泡送病理科检查。同时做波形蛋白、CD34、CD117、平滑肌肌动蛋白等免疫组化染色。见图1。
1.3.3 ESD术后处理 术后第1天禁食禁饮,静脉补充水、电解质及能量,常规使用抗生素及止血药物。观察生命体征、消化道出血及腹痛、腹胀等情况。留置胃管者观察胃管引流液体量及颜色。如无异常,第2天可进食流质,第3天进食软食。术后3~6个月复查胃肠镜了解创面愈合情况。
2 结果
ESD手术时间(自黏膜下注射至完全剥离病变为止)为30~150 min,平均(59.62 ±28.18)min。27个瘤体,成功切除26个(96.30%)。22例(84.62%)瘤体一次性完整剥离。3例(11.54%)因肿瘤瘤体大于3 cm,且位置较深,未能保持瘤体完整剥离,1例(3.85%)因胃底有两个相邻病变,故先剥离较大病变,3月后在外院再次行ESD术摘除小病变。
ESD操作过程中,创面均有少量出血,平均出血量不超过50 mL,操作过程中见到出血及显露的血管时,使用切开刀电凝、APC或钛夹止血,ESD术后无持续活动性及迟发性出血。
2例(7.69%)胃底瘤体直径大于3 cm的黏膜下病灶剥离过程中发生穿孔,穿孔大小约0.4~0.8 cm,均应用多枚钛夹成功封闭裂孔。术后给予胃肠减压、半卧位、营养支持及防治感染等治疗,未转外科开腹手术。其余术后并发症主要表现为发热4例、咽喉部不适2例、上腹部隐痛2例、胸骨后痛2例、肺部感染1例。
26例术前诊断为间质瘤的黏膜下病灶,术后病理及免疫组化确定间质瘤诊断的为17例,其他诊断为平滑肌瘤7例(5例位于食管,2例位于胃部),胃异位胰腺1例,胃血管球瘤1例。17例间质瘤中,良性间质瘤14例(胃部13例),食管及胃潜在恶性间质瘤各1例,直肠恶性间质瘤1例。
全组患者术后住院时间2~8 d,平均(4.15±1.71)d。术后随访期 9~46月,平均(27.73±12.16)月。1例直肠恶性间质瘤患者ESD术后转外科进一步手术。2例潜在恶性间质瘤患者未口服化疗药物。3个月及6个月胃镜及超声胃镜检查未提示肿瘤残留及复发。
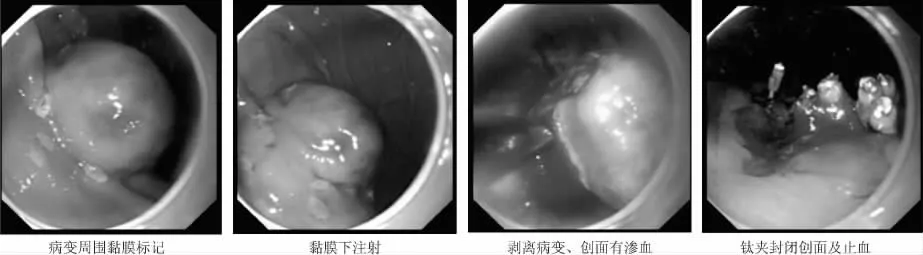
图1 ESD切除胃体胃肠道间质瘤过程
3 讨论
胃肠道间质瘤起源于胃肠道Cajal间质细胞或其共同干细胞,年发病率约1/100 000,无症状间质瘤可能更为普遍[3]。本组病例中,平时没有症状,因为体检发现的间质瘤占到了19.23%(5/26),提示无症状间质瘤可能发病率更高。间质瘤最常发生于胃(55%~60%),其次小肠(30%),十二指肠(5%),结直肠(5%),食管、阑尾、胆囊及胃肠外器官较罕见。本组病例中,发生于胃部的间质瘤占到了69.23%(18/26),符合GIST好发于胃的特点。但是通常认为,不论大小及发生部位,GIST都具有潜在恶性,因此对于直径大于2 cm的局限性的间质瘤,手术是首选治疗方案[4]。对于直径小于2 cm的黏膜下隆起性病变,手术非首选,需要进一步确定是否是间质瘤[5]。间质瘤一旦确诊,即使病灶很小,也需要完整切除病变,减少肿瘤生长及转移的可能性,术后应进一步进行病理分析评估危险分层。ESD作为早期胃癌的标准治疗方案已经被广泛接受[6],随着内镜器械及内镜技术的进一步发展,近年来其在治疗胃肠道黏膜下隆起性病变中逐渐得到广泛的应用,手术切除成功率可达90%[7]。ESD治疗GIST的主要适应证:瘤体直径小于5 cm;辅助检查提示边界清楚、质地均匀;无消化道外侵犯和腹腔转移征象。
本组病例中,肿瘤成功切除率为96.30%(26/27),肿瘤一次性完整切除率为84.62%(22/26),肿瘤未能一次性完整切除的原因主要发生在肿瘤较大(直径大于3 cm)、位置较深(向下潜伏生长)及肿瘤多发(2个或2个以上)病例。手术时间平均(59.62 ±28.18)min,主要与肿瘤部位和肿瘤大小有关。一般位于胃底,特别是靠近贲门的肿瘤手术难度较大,手术时间会延长。其他手术难度较大的部位有胃体小弯侧后壁、胃窦后壁及胃角。内镜前端置透明膜,操作过程中使用负压吸引进行钝性分离可使操作更便利,缩短手术时间。手术过程中有少量出血,为减少出血及防止术后出血,应采取预防性的止血措施,对于创面显露的小血管,即使无出血,也要及时使用APC或电凝止血。手术结束时充分观察创面,对薄弱创面使用钛夹加固。相对于ESD治疗早期胃癌4%的穿孔率,有文章报道ESD治疗间质瘤的穿孔率为28%[8],高穿孔率限制了ESD治疗GIST的应用。充分的黏膜下注射使黏膜下病变充分抬举及在切除过程中及时或多次进行黏膜下注射,可能有助于防止切除过深,从而减少穿孔的发生。即使发生穿孔,由于术前患者多禁食及经过肠道准备,穿孔引起的腹膜炎体征比较轻,钛夹封闭穿孔后,气腹可很快吸收。对于腹腔内游离气体过多,腹压较高,影响呼吸者,可于上腹部用20G穿刺针排气减压。本组病例穿孔发生率7.69%,均内科保守治疗成功,未转外科手术。
常规内镜活检诊断GIST较为困难。超声内镜提示来源于固有肌层的低回声肿瘤有助于间质瘤的诊断,诊断正确率可高达91.7%[9]。对比本组ESD手术前后标本,超声内镜诊断正确率为65.38%(17/26),对ESD完整切除标本进行病理学检查,有助于进一步确定GIST的诊断,并可以进行肿瘤恶性生物学行为判断。GIST术后,仍有潜在的复发转移可能,因此对ESD术后患者,必须进行随访及复查。特别是对肿瘤未能一次性完整剥离、创面有肿瘤残留及病理检查提示恶性或潜在恶性的GIST。随访复查可采用胃肠镜及超声胃镜检查。本组病例中,术后随访期9~46个月(平均27.73月),未提示肿瘤残留及复发,其中包括3例未能一次性切除病例及3例恶性及潜在恶性GIST患者。
总之,ESD治疗GIST近期疗效安全、可靠,病变可以被完整切除并提供详细的病理学诊断资料,无严重手术相关并发症。但由于病例数较少,随访期较短,其治疗GIST的远期疗效需要进一步随访观察。
[1] 梁建芳,郑绘霞,肖虹,等.胃肠间质瘤病理诊断新进展[J].世界华人消化杂志,2010,18(1):58-64.
[2] Park YM,Cho E,Kang HY,et al.The effectiveness and safety of endoscopic submucosal dissection compared with endoscopic mucosal resection for early gastric cancer:a systematic review and metaanalysis[J].Surg Endosc,2011,25(8):2666-2677.
[3] Agaimy A,Dirnhofer S,Wünsch PH,et al.Multiple sporadic gastrointestinal stromal tumors(GISTs)of the proximal stomach are caused by different somatic KIT mutations suggesting a field effect[J].Am J Surg Pathol,2008,32(10):1553-1559.
[4] Kong SH,Yang HK.Surgical treatment of gastric gastrointestinal stromal tumor[J].J Gastric Cancer,2013,13(1):3-18.
[5] Valad a˘o M,Linhares E,The role of the surgeon in the management of GIST[J].Rev Col Bras Cir,2009,36(3):261-265.
[6] Choi MH,Hong SJ,Han JP,et al.Therapeutic outcomes of endoscopic submucosal dissection in undifferentiatedtype early gastric cancer[J].Korean J Gastroenterol,2013,61(4):196-202.
[7] Catalano F,Rodella L,Lombardo F,et al.Endoscopic submucosal dissection in the treatment of gastric submucosal tumors:results from a retrospective cohort study[J].Gastric Cancer,2013,16(4):563-570.
[8] Bai J,Wang Y,Guo H,Zhang P,et al.Endoscopic resection of small gastrointestinal stromal tumors[J].Dig Dis Sci,2010,55(7):1950-1954.
[9] Ito H,Inoue H,Ryozawa S,et al.Fine-needle aspiration biopsy and endoscopic ultrasound for pretreatment pathological diagnosis of gastric gastrointestinal stromal tumors[J].Gastroenterol Res Pract,2012,2012(9):1-6.
