一种基于16SrRNA基因检测猪嗜血支原体PCR方法的建立
2013-11-22文辉强刘永刚石文达武嘉男姜成刚张交儿蔡雪辉
文辉强,刘永刚,石文达,武嘉男,姜成刚,张交儿,蔡雪辉
(中国农业科学院哈尔滨兽医研究所 兽医生物技术国家重点实验室/动物疫病诊断及技术服务中心,黑龙江 哈尔滨150001)
猪嗜血支原体病是由猪嗜血支原体寄生在人或多种哺乳动物的红细胞表面、血浆和骨髓中的一种人兽共患病。Splitter于1950年在《Science》杂志上将该病原列为附红细胞体属[1]。2002年,Neimark等根据其16SrRNA序列发现原附红细胞体与支原体较为接近,正式将该病原更名为猪嗜血支原体(Mycoplasma suis)[2-3]。本试验根据猪嗜血支原体16SrRNA基因序列,设计合成出特异性引物,建立了猪嗜血支原体PCR诊断方法,并初步应用于临床诊断。
1 材料与方法
1.1 主要试剂 AxyPrepTMBlood Genomic DNA试剂盒、AxyPrepTMBacterial Genomic DNA试剂盒、AxyPrepTMPlasmid Blood Genomic DNA试剂盒、AxyPrepTMDNA gel Extration DNA试剂盒、pMD18-T Vector、X-Gal、IPTG、TaqDNA 聚合酶均为宝生物工程(大连)有限公司产品;E.coliDH5α菌株为北京全式金生物技术有限公司产品。
1.2 猪嗜血支原体基因组提取 从临床症状疑似病例中无菌采集EDTA抗凝血,用AxyPrepTMBlood Genomic DNA Miniprep kit提取M.suis基因组DNA。
1.3 引物设计与合成 根据GenBank上发表的猪嗜血支原体16SrRNA基因序列(ID:U88565),Oligo 6.0设计特异引物:FP:5′-AAGGAAGCGTAGGCTGAAGT-3′; RP:5′-TTGGTAAGGTTTTGCGTGTA-3′。引物由北京永红英俊科技发展有限公司合成,扩增的目的片段为411bp。
1.4 PCR反应体系及反应程序 对样本DNA进行PCR扩增。50μL体系:DNATaq酶1.5U,10×PCR Buffer 2.5μL,dNTP Mixture 2μL,模板2μL,引物各0.5μL,加灭菌蒸馏水至50μL。反应程序:预变性95℃5min,变性94℃1min,退火56℃1min,延伸72℃1min,35个循环;终末延伸72℃10min。
1.5 克隆与序列测定 将扩增产物按照AxyPrepTMDNA gel Extration进行回收纯化,回收片段进行载体与目的片段连接,按照文献[4]上方法转化E.coliDH5α,在X-gal/IPTG、LB培养基上进行筛选,挑选白色菌落37℃振摇培养,扩增菌液进行质粒提取和PCR鉴定,取菌液2mL送北京永红英俊科技发展有阴公司测序。利用NCBI-BLAST进行同源比对。
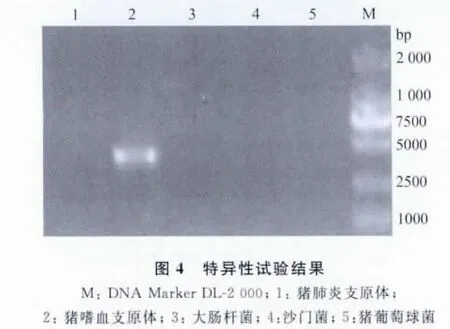
1.6 特异性试验 按 AxyPrepTMBacterial Genomic DNA提取猪肺炎支原体、大肠杆菌、沙门菌、葡萄球菌的基因组DNA(以上病原菌由中国农业科学院哈尔滨兽医研究所动物疫病诊断中心提供)。用紫外分光光度计检测提取后DNA含量,以确认模板中含有各病原体的基因组DNA。
1.7 敏感性试验 提取DNA,测定其OD260值,进行10倍稀释后进行PCR扩增,从而确定该方法的敏感性。
1.8 临床样本的检测 从哈尔滨地区采集疑似猪嗜血支原体血液样本30份进行检测,并对阴性样本进行重复检测。
1.9 重复性试验与符合率 就以上1.6、1.7与1.8分别在3个不同时间对特异性试验、敏感性试验与临床样品的重复性检测验证与符合率。
2 结果
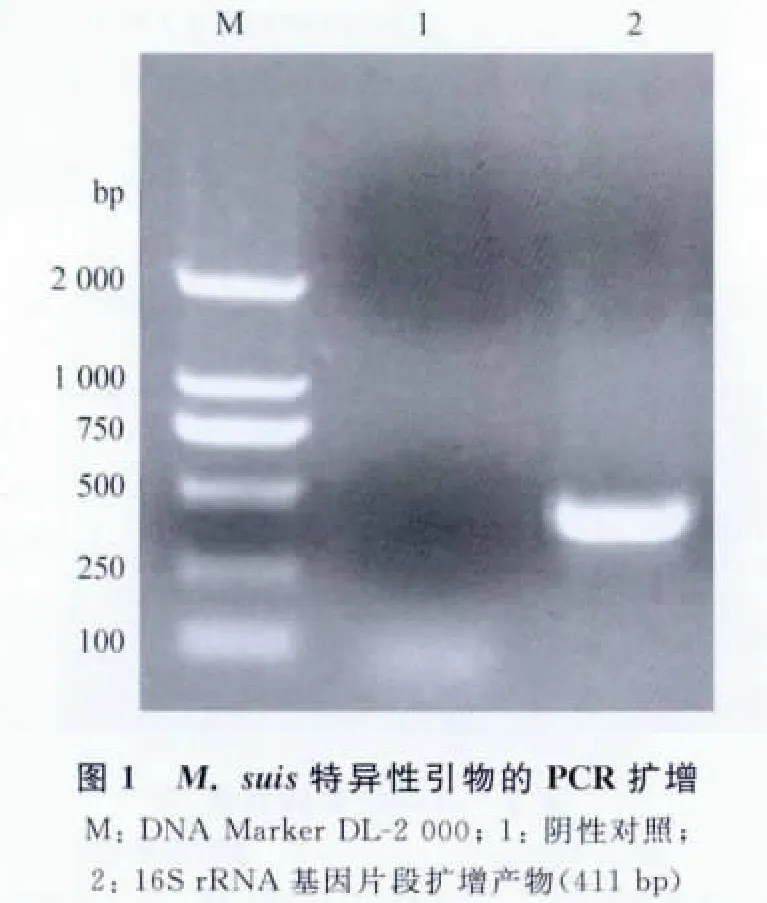
2.1 目的片段PCR扩增的结果 以M.suis的16SrRNA基因设计的特异性引物进行PCR扩增,经1%琼脂糖凝胶电泳检测,在约411bp出可见相应条带,与理论大小相符,阴性对照没有条带出现(见图1)。
2.2 质粒PCR鉴定与序列分析 将PCR产物克隆到pMD18-T载体中,经转化、蓝白斑筛选、扩大培养、质粒DNA提取后,以质粒为模板进行PCR检测。经1%琼脂糖凝胶电泳检测,证实得到相应的目的条带。测序结果显示,目的片段为411bp(见图2和图3),经NCBI-BLAST搜索同源性分析表明,该序列与参考序列(U88565)对应大小序列同源性为97.57%。

2.3 特异性试验 电泳结果显示,只有M.suis基因组能扩增出约410bp的片段,而其余对照基因组DNA均无扩增条带出现(见图4)。
2.4 敏感性试验 经紫外分光光度计测定,血液基因组DNA OD260nm值为750ng/μL,连续10倍稀释后进行PCR扩增,结果表明,该体系检测M.suis基因组DNA的最大稀释倍数为1×109,能检测到的最高敏感度约为0.75fg/μL,约1 000copies/μL(见图5)。
2.5 临床样品的检测 从黑龙江哈尔滨地区不同猪场采集疑似猪嗜血支原体血液样本30份,进行PCR检测,结果有3份呈阳性,其余均为阴性。

图3 重组质粒DNA测序结果 (411bp)

2.6 重复性试验与符合率 通过分别在3个不同时间对特异性试验、敏感性试验与临床样品的重复性检测验证结果证明,特异性试验、敏感性试验与临床样品的符合率均为100%。
3 讨论
迄今为止,尚无猪嗜血支原体体外连续培养方法[5],从而对M.suis诊断方法研究有一定的阻碍作用。因此,临床上猪嗜血支原体病的诊断仍然借助于鲜血压片、吉姆萨或瑞氏染色法,但这类形态学观察的局限性在于低特异性和低敏感性[6]。相对而言,吖啶橙染色方法比上述方法有较高的特异性和敏感性[7]。随着分子生物学的不断发展,依据16S rRNA基因或M.suis特异性基因组片段的PCR检测成为鉴定各种动物源嗜血支原体最有效的方法[3,8-9]。而且PCR诊断对M.suis急性感染病例或长期慢性感染病例均具有很高的特异性和敏感性。本试验根据已成功分离并提取的M.suis基因组DNA,根据GenBank中登录的16SrRNA基因序列(ID:U88565)所涉及的特异性引物,经PCR扩增约410bp的基因片段,并成功克隆该片段,为以后了解其流行病学及致病机理有着重要意义。本实验室进行M.suis人工感染猪,重复试验结果表明,感染后24h即可检测出M.suis,这与Gwaltney报道相一致[3,8]。
2008年冯会权等基于 Hoelzle报道[10]的M.suis特异性基因组片段设计引物并对疑似感染猪血样进行PCR扩增,并且检测血液基因组DNA的最低检测量为 0.65fg/μL[11]。本试验中基于 16S rRNA基因序列所设计的特异性引物,证实该方法具有较高特异性和敏感性,检测血液基因组DNA的最低检测量为0.75fg/μL,与冯会权等报道结果为同一数量级。且该方法经重复试验后结果具有良好一致性,提示该PCR方法较为稳定。本试验建立的PCR诊断方法具有较好的特异性、敏感性,是一种有效的确诊手段,可用于猪嗜血支原体病的流行病学调查、诊断及疗效监测等。
[1] Splitter E J.Eperythrozoonsuisn spEperythrozoonparvumnsp 2new blood parasites of swine[J].Science,1950,111(2889):513-514.
[2] Neimark H,Johansson K E,Rikihisa Y,etal.Revision of haemotrophic Mycoplasma species names[J].Int J Syst Evol Microbiol,2002,52(2):683.
[3] Gwaltney S M,Hays M P,Oberst R D.Detection ofEperythrozoonsuisusing the polymerase chain reaction[J].J Vet Diagn Invest,1993,5(1):40-46.
[4] SAmbrook J,Maniatis J.分子克隆实验指南[M].金冬雁,黎孟枫,侯云德,译.北京:科学出版社,2002.
[5] Messick J B.Hemotrophic mycoplasmas (hemoplasmas):a review and new insights into pathogenic potential[J].Vet Clin Pathol,2004,33(1):2-13.
[6] Hoelzle L E,Helbling M,Hoelzle K,etal.First LightCycler real-time PCR assay for the quantitative detection ofMycoplasmasuisin clinical samples[J].J Microbiol Methods,2007,70(2):346-354.
[7] 郑丽艳,张衍俊,常维山.附红细胞体病瑞氏、姬姆萨、吖啶橙染色法及PCR检测法的比较研究[J].中国人兽共患病学报,2008,22(3):243-245.
[8] Gwaltney S M,Oberst R D.Comparison of an improved polymerase chain reaction protocol and the indirect hemagglutination assay in the detection ofEperythrozoonsuisinfection[J].J Vet Diagn Invest,1994,6(3):321-325.
[9] Oberst R D,Gwaltney S M,Hays M P,etal.Experimental infections and natural outbreaks of eperythrozoonosis in pigs identified by PCR-DNA hybridizations[J].J Vet Diagn Invest,1993,5(3):351-358.
[10]Hoelzle L E,Adelt D,Hoelzle K,etal.Development of a diagnostic PCR assay based on novel DNA sequences for the detection ofMycoplasmasuis(Eperythrozoonsuis)in porcine blood[J].Vet Microbiol,2003,93(3):185-196.
[11]冯会权,苏玉虹,苏荣健,等.猪附红细胞体特异性基因的克隆和PCR诊断方法的建立[J].中国预防兽医学报,2008,30(5):372-375.
