顺式-四氢环丁烷[1,2-b:3,4-b′]骈二吡啶-四羧酸乙酯的合成及晶体结构
2013-11-21牛建兵李荣强张军丽
牛建兵,李荣强,张军丽
(黄淮学院 化学化工系,河南 驻马店 463000)
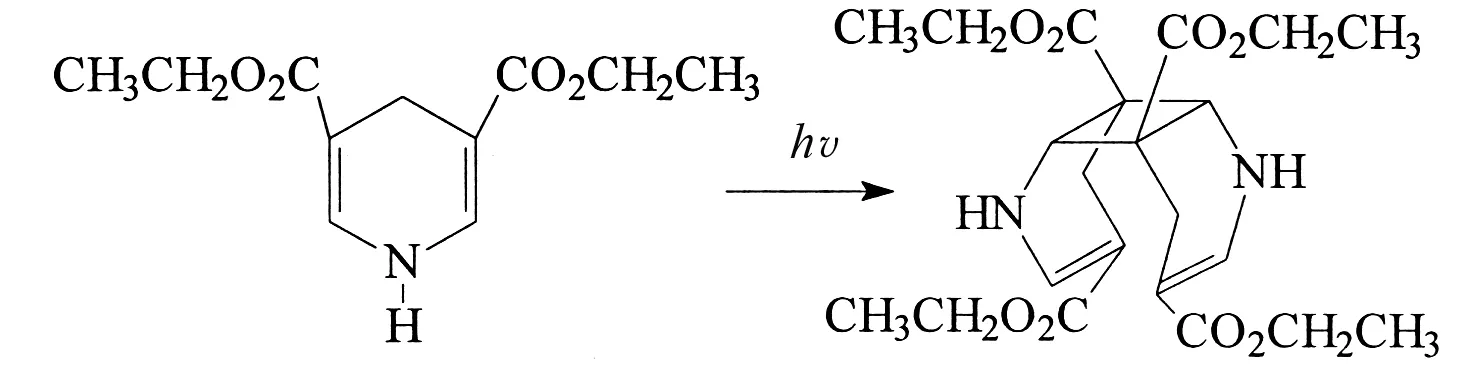
近年来,1,4-二氢吡啶类化合物由于其生物学性质受到化学界的关注,特别是HILGEROTH等人报导了2,6-位无取代基的1,4-二氢吡啶类化合物,在紫外光的照射下,能生成具有抗HIV-1活性的笼形化合物二氮杂四星烷而备受关注[1-2],同时对于2,6-位无取代基的1,4-二氢吡啶类化合物光二聚生成的非笼形产物的药理活性也有文献报道[3-4],但所报道的都是4-位有芳基取代的1,4-二氢吡啶的光二聚反应,本文作者对2,4,6-位无取代的3,5-二羧酸乙酯-1,4-二氢吡啶光二聚合成顺式-1,5,8,8bβ-四氢环丁烷[1,2-b:3,4-b′]二吡啶-3,4αβ,7,8αβ(4H,4bβH)-四羧酸乙酯的反应进行探讨,同时,对产物进行单晶培养,所得数据证明了化合物的构型(CCDC: 259473). 反应方程式如下:
1 实验部分
1.1 仪器和试剂
所用试剂均为化学纯. 熔点仪为XT4A显微熔点测定仪(北京科仪电光仪器厂),熔点未经校正;红外光谱仪为Bruker Vertex 70 IR;核磁共振仪为ARX-400;含量测定用Waters 600 HPLC;单晶衍射仪为Rigaku RAXIS IP(MO,Kα,石墨单色器);光反应器自制.
1.2 标题化合物的合成及单晶培养
3,5-二羧酸乙酯-1,4-二氢吡啶参照文献方法自制[5].
方法1:取0.1 g 3,5-二羧酸乙酯-1,4-二氢吡啶溶于20 mL二氯甲烷中,密封在石英烧瓶中,放在阳光照射到的地方,不时用冷水冷却,累计照射约18 h后,经快速柱层析(乙酸乙酯和石油醚1∶3),可得目标化合物0.04 g,收率为40%. 方法2:取2 g 3,5-二羧酸乙酯-1,4-二氢吡啶溶于80 mL无水苯中,放在石英玻璃的光反应器中,在高纯氮的保护下,用400 W中压汞灯照射16 h,可直接析出白色的固体,同时,把反应液旋干后进行快速柱层析(乙酸乙酯和石油醚1∶3),可得到另一部分产物,把二者混合后用石油醚和乙酸乙酯重结晶后,共得到0.516 g无色晶体,收率为25.8%.

取适量标题化合物用乙酸乙酯和石油醚重结晶,可得适用于X射线衍射分析用的无色晶体.
1.3 单晶X射线衍射结构分析
选取尺寸为0.45 mm×0.15 mm×0.08 mm的单晶,在Rigaku RAXID IP 四圆衍射仪上,使用高定位石墨晶体单色器单色化的Mo Kα射线,在293 K下,以2θ-ω方式,在2.05°~25.03°范围内收集衍射强度数据,得独立衍射点15 153个(Rint= 0.042 6),观测衍射点4 077个. 部分键长和键角见表1.

表1 标题化合物的键长及键角Table 1 Bond lengths and angles for the title compound
标题化合物的分子式为C22H30N2O8,该晶体属单斜晶系,空间群P2(1)/c,晶胞参数为:a= 1.193 7(2) nm,b= 2.091 3(4) nm,c= 0.976 3(2) nm,α= 90.00°,β= 108.46(3)°,γ= 90.00°,V= 2.311 9(8) nm3,Mr=450.48,Z= 4,D= 1.294 g/cm3,μ= 0.099 mm-1,F(000) = 960. 采用的数据使用SHELXL-97程序,用直接法求得结构参数,用全矩阵最小二乘法修正,氢原子采用各向同性热参数修正,非氢原子采用各向异性热参数修正,最终偏离因子为R1= 0.064 0,wR2= 0.147 0,最终差值电子云密度的最高峰为465 e/nm3,最低峰为-275 e/nm3. 图1是标题化合物的分子结构图和晶胞堆积图.
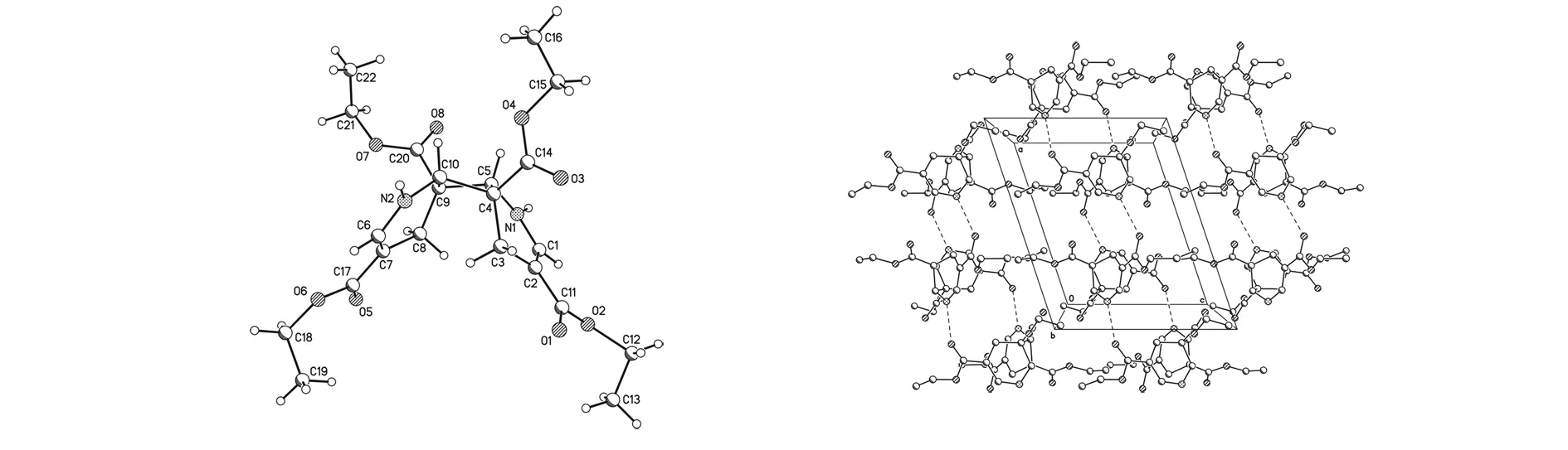
图1 标题化合物的分子结构图和晶胞堆积图Fig.1 Molecular structure and packing of the title compound
2 结果与讨论
2.1 标题化合物合成方法的研究
分别用不同的溶剂对标题化合物的合成进行研究,结果发现,用苯、四氢呋喃和二氯甲烷作溶剂,都可得到该化合物,特别是用二氯甲烷作溶剂,在太阳光的照射下,可高产率地得到该化合物,且分离提纯相对简单;而用苯和四氢呋喃作溶剂,在400 W中压汞灯照射时,根据TLC点板分析,还有另外几种化合物生成,不便于标题化合物的分离提纯,主要原因是因为中压汞灯的光强太大,易于诱发其他的副反应. 同时对最佳反应时间也进行了探讨,见表2. 从表2中可以看出,在用苯和四氢呋喃作溶剂时,产物的产率随反应时间的增加而增加,但18 h以后,产物产率反而有所减少,而在用太阳光作光源,二氯甲烷作溶剂时,产物的产率在光照20 h后没有太大的变化,可能原因是因为在光源强度太强时,标题化合物中的两个双键会发生进一步的环合加成反应,而太阳光的强度不足以引发产物发生进一步的环合加成反应. 所以,合成标题化合物的最佳条件为用二氯甲烷作溶剂,用太阳光照射约18 h,产率可达到40.1%.
表2不同溶剂中反应时间对标题化合物产率的影响

Table 2 Effect of reaction time in different solvent on the yield of the title compound %
2.2 晶体结构

参考文献:
[1] HILGEROTH A, BILLICH A. Cage dimeric N-acyl- and N-acyloxy-4-aryl-1,4-dihydropyridines as first representatives of a novel class of HIV-1 protease inhibitors [J]. Arch Pharm Pharm Med Chem, 1999,332(11): 380-384.
[2] HILGEROTH A, BAUMEISTER U. Formation of novel photodimers from 4-aryl-1,4-dihydropyridines [J]. Chem Eur J, 2001, 7(21): 4599-4603.
[3] HILGEROTH A, LANGNER A. Bioanalysis of syn dimeric HIV-1 protease inhibitor N-benzyl-4-aryl-1,4-dihydropyridine H19: metabolic and cytotoxic properties in Hep G2 cells. [J]. Arch Pharm Pharm Med Chem, 2000, 333(6): 195-197.
[4] HILGEROTH A, BILLICH A, LILIE H. Synthesis and biological evaluation of first N-alkyl syn dimeric 4-aryl-1,4-dihydropyridines as competitive HIV-1 protease inhibitors [J]. Eur J Med Chem, 2001, 36(4): 367-374.
[5] LI Rong Qiang, YAN Hong. New method for synthesizing 1,4-dihydropyridine under microwave [J]. Chin J Syn Chem, 2005, 13(6):597-599.
