干扰素-α与拉米夫定配伍治疗对慢性乙型肝炎预后的影响 *
2013-11-21西安交通大学第二附属医院感染科西安710004赵文学武文华蔡芝芳刘拉羊纪泛扑
西安交通大学第二附属医院感染科(西安710004)赵文学 武文华 蔡芝芳 刘拉羊 纪泛扑 邓 红
乙型肝炎病毒(Hepatitis B virus,HBV)活跃复制导致肝脏炎症坏死纤维化,疾病急性加重,肝脏失代偿,部分慢性肝炎患者进展至肝硬化、肝功能衰竭或原发性肝癌,是主要的疾病死亡因素之一。最大限度的抑制HBV复制以达到最大程度的控制或延缓疾病进展是慢性乙型肝炎(Chronic hepatitis B,CHB)抗病毒治疗的根本目的。目前尚无治愈慢性乙肝的特效药,公认的抗病毒药包括干扰素(IFN)和核苷(酸)类似物。本文对我院2002年6月至2005年6月收治的456例CHB患者的资料进行回顾性分析,旨在评价抗病毒治疗对其预后的影响。
资料与方法
1 一般资料 本组456例患者HBsAg均阳性,男性387例,女性69例,平均年龄36.68±12.77岁,极差7~73岁,平均病程7.60±7.18年,极差0~35年;168例患者有肝硬化/肝癌家族史。139例患者进展至终末期肝病(End stage liver diseases,ESLD),包括重症肝炎29例,原发性肝癌40例,代偿期/失代偿期肝硬化未发生重症化或癌变者70例;317例患者仍处于慢性肝炎阶段。
456例患者中365例未曾接受抗病毒治疗;91例曾接受干扰素-α或(和)拉米夫定治疗者,治疗前HBV DNA>104copies/ml,ALT>2倍正常值上限,且肝脏影像学和AFP检查除外肝硬化或原发性肝癌。所有病例均有肝功能、HBV血清学标志、血清HBV-DNA定量,均除外HCV、HDV、HAV、HEV等肝炎病毒重叠感染。所有病例均符合2000年西安《病毒性肝炎防治方案》CHB、慢性重症肝炎、肝硬化诊断标准[1]。
2 方 法 对上述456例慢性HBV感染相关肝病患者进行回顾性调查,根据治疗情况分为未治疗组、干扰素-α组和拉米夫定组,三组患者的一般资料,见表1。部分患者接受两种药物联合或连续抗病毒治疗定义为干扰素-α+拉米夫定组,分析既往曾有干扰素-α或(和)拉米夫定治疗对CHB进展至ESLD,包括重症肝炎、肝硬化、原发性肝癌的影响。IFN-α治疗定义为曾接受剂量≥3MIU,1次/2d,肌注,连续治疗疗程≥6个月;拉米夫定治疗定义为曾接受剂量100mg,1次/d,口服,连续治疗疗程≥12个月。病毒学应答定义为治疗结束时HBV-DNA阴性,生化学应答定义为治疗结束时ALT水平正常。
表1 未治疗组、干扰素-α组和拉米夫组患者的一般资料(±s)
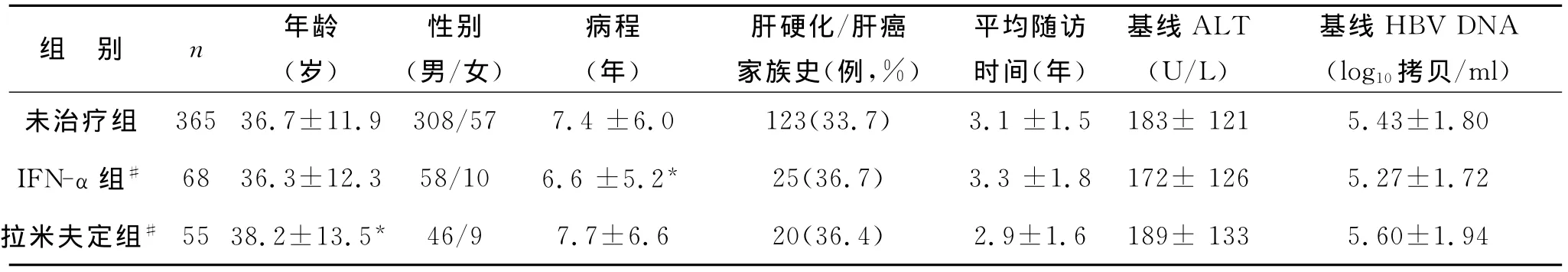
表1 未治疗组、干扰素-α组和拉米夫组患者的一般资料(±s)
注:与未治疗组比较,*P<0.05;#32例患者曾接受拉米夫定和IFN-α联合或连续治疗
组 别 n 年龄(岁)性别(男/女)病程(年)肝硬化/肝癌家族史(例,%)平均随访时间(年)基线ALT(U/L)基线HBV DNA(log10拷贝/ml)3.1±1.5 183±121 5.43±1.80 IFN-α组# 68 36.3±12.3 58/10 6.6±5.2* 25(36.7) 3.3±1.8 172±126 5.27±1.72拉米夫定组# 55 38.2±13.5* 46/9 7.7±6.620(36.4)未治疗组 365 36.7±11.9 308/57 7.4±6.0123(33.7)2.9±1.6 189±133 5.60±1.94
HBVM检测采用ELISA法,HBV DNA采用荧光定量PCR法(<103copies/ml为阴性)(试剂由广州中山医科大学达安基因公司提供)。生化学检查采用我院全自动生化检测仪。
3 统计学方法 应用SPSS13.0统计软件,计量资料采用t检验,计数资料采用χ2检验,P<0.05为差异有统计学意义。
结 果
1 干扰素-α治疗对CHB预后的影响 456例患者中既往有IFN-α、拉米夫定治疗、无抗病毒治疗者分别有68、55、365例,与未治疗组比较,IFN-α治疗能降低CHB患者进展为ESLD的风险(P=0.004),见表2。根据IFN-α治疗结束时应答情况进行分层分析显示30例治疗结束时获得病毒学和生化学联合应答者中仅有2例,而38例治疗结束时仅有病毒学或生化学应答和无应答者中有8例进展至ESLD,与未治疗组患者比较,获得病毒学和生化学联合应答者预后明显改善(P=0.004和0.173)。
2 拉米夫定治疗对CHB预后的影响 55例拉米夫定治疗组患者疗程为12~26月,平均15.8月,46例治疗结束时获得病毒学和生化学联合应答。与未治疗组比较,拉米夫定治疗未能显著降低CHB患者进展为ESLD的发生率(P=0.222),见表2。
3 既往拉米夫定和干扰素-α治疗对CHB预后的影响 32例患者曾接受拉米夫定和IFN-α联合或连续治疗。其中20例首先接受IFN-α治疗未获得病毒学和生化学联合应答改用拉米夫定治疗,6例拉米夫定耐药后改用IFN-α,1例拉米夫定停药后复发改用IFN-α,5例两者联合治疗。与未治疗组比较,未能显著降低其进展为ESLD的风险(P=0.245),见表2。
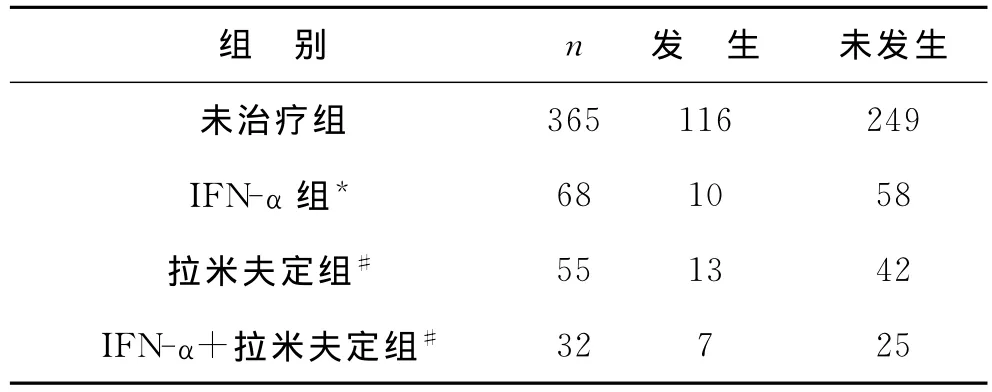
表2 干扰素-α和(或)拉米夫治疗对CHB患者进展至ESLD的影响
讨 论
研究表明IFN-α治疗能减轻 HBeAg阴性和HBeAg阳性CHB患者肝脏炎症坏死和纤维化程度,减慢其向肝硬化进展的速度,明显降低ESLD发生率[2~5]。Brunetto等人的研究还显示治疗后获得持续病毒学应答者肝病无进展,仅有20%复发和无应答患者疾病进展,与未治疗者相比,显著降低患者进展为肝硬化的比率[2]。Papatheodoridis和 Lamperticode的研究亦表明IFN-α治疗后获得生化学和(或)病毒学应答者长期预后改善且肝病相关病死率明显降低[3,4]。但是,对上述资料的累积分析显示IFN-α治疗并不能显著降低肝细胞癌的发病率[2~4]。而近期台湾一项大规模的回顾性研究则显示IFN-α治疗既可以延缓HBeAg阳性CHB患者进展至肝硬化,同时也可明显降低发生肝细胞癌的风险,尤其对于治疗结束时和结束后获得 HBeAg血清转换者[6]。我们的研究显示IFN-α治疗能显著降低CHB患者ESLD发生率,通过对IFN-α治疗结束时的应答情况进行分层分析,结果显示93%(28/30)治疗结束时获得病毒学和生化学联合应答者疾病无进展。38例治疗部分应答或无应答者有8例进展至ESLD,与未治疗组比较无显著性差异。表明持续抑制病毒复制能够减轻肝脏炎症坏死,延缓疾病进展至肝硬化、肝癌或肝病重症化,与上述文献报道的一致。
拉米夫定具有高效抑制HBV复制、良好的安全性和耐受性而广泛地应用于慢性HBV感染相关肝病的治疗[5,7,8]。长期拉米夫定治疗 HBeAg阴性CHB,5年存活率为96%,无严重并发症存活率达93%,与IFN-α治疗无应答和未接受治疗者相比,明显提高存活率,降低发生严重并发症的风险[7]。亚太地区一项纳入651例进展期肝病患者的研究显示,持续3年拉米夫定治疗能够显著降低肝脏失代偿的发生率,降低发生肝细胞癌风险[8],即便出现拉米夫定耐药,与安慰剂治疗组比较,继续治疗仍然能够显著降低疾病进展风险[8]。且拉米夫定单药治疗已经报道可显著抑制乙型肝炎肝硬化患者HBV的复制,改善患者肝功能,减少肝硬化失代偿的发生率[9]。
我们的结果显示,既往较短疗程拉米夫定治疗不能明显降低ESLD发生率(P>0.05)。与上述文献报道不太一致,分析其原因可能有以下几点:①本研究中患者拉米夫定治疗疗程相对较短(平均15.8月),停药后持续应答率低、复发率高,使得肝脏炎症不能获得持续缓解;②部分患者治疗尚未达到停药指征时即停药,出现复发时又不能及时应用拉米夫定再治疗;③当时阿德福韦酯和恩替卡韦在中国尚处临床试验阶段,出现病毒学和生化学反弹时,尚无有效抗病毒治疗方案。
与未治疗组比较,曾有拉米夫定和IFN-α抗病毒治疗者亦未能显著降低其进展为ESLD风险(P>0.05),似乎与上述结论矛盾。但分析其原因可以发现,接受两者治疗的患者中大部分是IFN-α治疗部分应答或无应答后改用拉米夫定治疗,进一步支持干扰素治疗达病毒学和生化学联合应答者,预后优于未达联合应答者。
总之,IFN-α治疗能减少CHB患者进展至ESLD,尤其是治疗结束时获得病毒学和生化学联合应答者;短疗程拉米夫定治疗未能明显影响其预后。由于干扰素治疗疗程较短且相对固定,对于治疗结束时获得完全应答者,大部分患者病情可以长期稳定;部分患者可以出现延迟应答,如果没有治疗禁忌证,建议作为首选抗病毒方案,尤其是青年,短期内有生育需求,病毒载量较低,免疫清除明显的初治患者。拉米夫定抗病毒作用较强且治疗费用低,对于经济欠发达地区仍然是初治患者的理想选择之一。短疗程拉米夫定治疗未能明显影响其预后,需要长期治疗以持续抑制病毒复制。治疗过程中需严密监测HBV-DNA,早期评估应答情况决定是否联合阿德福韦酯治疗以减少耐药的发生,如果发生YMDD变异,出现病毒学突破应尽早联合阿德福韦酯抗病毒。
[1]中华医学会传染病与寄生虫病学分会、肝病学分会.病毒性肝炎防治方案[J].肝脏,2000,5:257-262.
[2]Brunetto MR,Oliveriet F,Coco B,et al.Outcome of anti-HBe positive chronic hepatitis B in interferon-аtreated and untreated patients:a long term cohort study[J].J Hepatol,2002,36:263-270.
[3]Papatheodoridis GV,Manesis E,Hadziyanni SJ,et al.The long term outcome of interferon-аtreated and untreated patients with HBeAg negative chronic hepatitis B[J].J Hepatol,2001,34:306-313.
[4]Lampertico P,Del Ninno E,Vigano M,et al.Extended interferon therapy increases hepatitis suppression and reduces liver-related morbidity of hepatitis B e antigen negative chronic active hepatitis B [J].Hepatology,2003,37:756-763.
[5]Lau GK,Piratvisuth T,Luo KX,et al.Peginterferon Alfa-2a,lamivudine,and the combination for HBeAgpositive chronic hepatitis B [J].N Engl J Med,2005,352:2682-2695.
[6]Lin SM,Yu ML,Lee CM,et al.Interferon therapy in HBeAg positive chronic hepatitis reduces progression to cirrhosis and hepatocellular carcinoma [J].J Hepatol,2007,46:45-52.
[7]Papatheodoridis GV,Dimou E,Dimakopoulos K,et al.Outcome of hepatitis B e antigen-negative chronic hepatitis B on long-term nucleos(t)ide analog therapy starting with lamivudine[J].Hepatology,2005,42:121-129.
[8]Liaw YF,Sung JJ,Chow WC,et al.Cirrhosis Asian Lamivudine Multicentre Study Group.Lamivudine for patients with chronic hepatitis B and advanced liver disease[J].N Engl J Med,2004,351:1521-1531.
[9]罗春英,贾小洲.拉米夫定联合复方牛胎肝提取物片治疗乙型肝炎肝硬化34例 [J].陕西医学杂志,2011,40(10):1363-1365.
