p38MAPK在Aβ25-35诱导AD大鼠不同脑区的表达*
2013-11-21西安交通大学第二附属医院神经内科西安710004
西安交通大学第二附属医院神经内科(西安710004)
张桂莲 杜 赟 姚 丽 张 茹 刘璟洁 卜 宁 吴海琴 张 磊 郭英英 李婷婷
已有报道,阿尔茨海默病(Alzheimer’s disease,AD)与嗅觉损害有关,嗅觉阈值与AD的程度有关[1,2]。单纯毁损嗅球可降低大鼠学习记忆功能[3]。嗅觉损害可能在主要临床症状出现前出现[4]。在AD的早期阶段,嗅球即被涉及,大量的淀粉样蛋白(amyloid-β,Aβ)斑和tau蛋白纤维缠结贯穿了嗅觉神经系统,这是对嗅觉早期损害的有力支持[2,5]。然而,也有研究认为,虽然在嗅觉中枢出现AD的特征性病理改变,而嗅觉的损害并没有优先[6]。我们早期的研究分别观察了侧脑室注射Aβ25-35后MAPK信号转导通路家族的成员之一—磷酸化p38MAPK(p-p38)在海马CA1区及嗅球的各自表达,为了进一步探讨是否嗅球的损害先于海马,我们拟对比观察p-p38在大鼠嗅球与海马CA1的表达,进一步探讨不同脑区p38与AD临床结果的关系。
材料和方法
1 材 料
1.1 实验动物的筛选及分组:选择健康成年雄性SD大鼠,体质量260±20g,根据实验要求标准环境下喂养1周,每笼3~5只。大鼠在Y型迷宫内适应3min后,给予适当电击,直至3臂均探索进入为止,选择活跃、对电击反应敏感、逃避反应迅速的72只大鼠供实验用。将其随机分为阴性对照组、痴呆组、抑制剂组和溶媒对照组,每组18只。再根据观察时间点将每组大鼠分为4d、7d和14d三组,每组6只。
1.2 实验试剂及其配制:β-淀粉样蛋白多肽片段(Aβ25-35)、p-p38抗体(Thr180/Tyr182)、p38抑制剂—SB203580、二甲基亚砜(DMSO)分别由美国Sigma,Alexis Cell及Signaling公司提供。
SB203580溶液及Aβ25-35聚合态的制备:将Aβ25-35用无菌生理盐水稀释,配制成浓度为3nmol/μl的溶液,使用前将Aβ25-35溶液在37℃孵育4d即可成为聚合态的 Aβ25-35。用1%DMSO配制成浓度为0.1nmol/μl的SB203580溶液,-20℃保存备用。
2 方 法
2.1 动物模型的构建:术前12h给大鼠禁食,4h禁水。用1%戊巴比妥钠(40mg/kg)腹腔注射麻醉,等大鼠的翻正反射消失后,将大鼠俯卧位固定于脑立体定位仪上。选择右侧侧脑室为注射靶区,于前囟向后0.8mm,中线旁开1.5mm处,用牙科钻钻开颅骨,挑破硬脑膜。①痴呆组:用微量注射器垂直进针3.8mm,以1μL/min的速度缓慢注入 Aβ25-35溶液5μl,留针5min后缓慢拔针,缝合切口。②阴性对照组:用同样方法将等量生理盐水注入大鼠右侧侧脑室。③抑制剂组:同法将SB203580溶液5μl注入大鼠右侧侧脑室。30min后,将Aβ25-35溶液5μl注入。④溶媒对照组:用同样方法将1%DMSO5μl注入大鼠右侧侧脑室,30min后,再将Aβ25-35溶液5μl注入。术后动物单笼饲养至清醒,并每日肌注青霉素钠5万单位,共3d以防感染。
2.2 动物行为学测试:四组大鼠于以上处理后4d、7d、14d行Y迷宫测试。记录实验中每只大鼠达到学会标准的训练次数(Number,N),完成所有反应中错误反应的次数(Error number,EN),全天总反应时间(Total reaction time,TRT)。
2.3 免疫组化检测:四组大鼠在行为学测试后快速灌注取脑,分离嗅球及海马,分别常规进行石蜡包埋切片,层厚5μm。采用免疫组化SABC法检测p-p38蛋白表达量,p-p38抗体的浓度为1∶50。
2.4 图像采集及分析:选取每只大鼠的海马及嗅球切片各1张,用图像分析仪检测每张切片海马CA1区及内嗅小球层p-p38表达阳性细胞的灰度,每张切片随机检测5次,取其平均值(灰度值范围为0~255,分别由黑色~白色表示);灰度值越低,表示表达的阳性细胞数越多。
2.5 统计学方法:所有数据采用SPSS13.0软件建库、处理。各指标用±s表示。两组以上计量数据比较采用单因素方差分析,即F检验,其中两两比较采用LSD检验。P<0.05认为有统计学差异。
结 果
1 行为学检测 由表1可见,在AD大鼠建模4d时,各组大鼠的行为学指标基本正常;阴性对照组各时间点间比较,大鼠达到学习标准的N、EN和TRT无明显统计学差异(P>0.05)。痴呆组在Aβ注射7d、14d后,N、EN和 TRT均明显增加(P<0.05)。抑制剂组与痴呆组比较,N、EN和TRT有改善(P<0.05)。抑制剂组与溶媒对照组之间差异有统计学意义(P<0.05)。提示痴呆组大鼠在Aβ注射7d后,学习记忆能力显著下降;而应用抑制剂SB203580后,大鼠学习记忆能力得到改善。
表1 每组动物的行为学结果(n=6,±s)

表1 每组动物的行为学结果(n=6,±s)
注:与阴性对照组比较,*P<0.05;与溶媒对照组比较,#P<0.05;与抑制剂组比较,△P<0.05
学会标准的训练次数 完成所有反应中错误反应的次数 全天总反应时间组 别4d 7d 14d阴性对照组 19.67±3.88 19.50±3.62 23.17±3.19 3.38±1.76 3.55±1.78 3.64±1.95 4d 7d 14d 4d 7d 14d 506.03±41.66 524.06±46.01 533.95±26.50痴呆组 22.50±2.95 41.50±4.95*△51.33±6.80*△ 3.61±1.86 5.26±0.81*△ 6.95±1.19*△ 520.18±35.41 933.39±35.76*△1320.62±84.42*△溶媒对照组 22.83±4.02 42.83±4.17 51.67±4.23 3.63±1.63 5.11±1.52 6.88±2.14 526.53±56.80 963.19±41.89 1282.60±89.66抑制剂组 23.67±3.56 30.00±5.76# 34.50±3.94# 3.54±1.57 4.06±1.25# 4.10±1.68# 537.15±56.74 660.08±41.12# 856.02±43.31#
2 p-p38蛋白在大鼠海马CA1区及嗅球的表达经过免疫组化染色,光镜下的p-p38蛋白免疫反应产物呈棕黄色,主要表达于细胞核内。由表2及图1A-F可见,在海马CA1区,阴性对照组各时间点可见少量p-p38蛋白表达;痴呆组在Aβ注射4d出现明显的pp38蛋白表达,随着观察时间的延长,p-p38蛋白表达逐渐增多;且各时间点均显著高于阴性对照组(P<0.01);而抑制剂组各观察时间点,p-p38蛋白的表达介于阴性对照组和痴呆组之间,同时与溶媒对照组也明显不同,在应用SB2035804d时,p-p38蛋白几乎被完全抑制,而在7d,14d被部分抑制。
另外,由表2及图2A-F可见,每组各时间点pp38蛋白在嗅球的表达均低于海马的表达(P<0.01),但p-p38蛋白在嗅球的表达规律与在海马CA1区的表达规律相一致。
表2 每组大鼠海马与嗅球p-p38蛋白的灰度(n=6,±s)

表2 每组大鼠海马与嗅球p-p38蛋白的灰度(n=6,±s)
注:与阴性对照组比较,*P<0.01;与抑制剂组比较,△P<0.01;与痴呆组7d和14d比较,▲P<0.01;与痴呆组14d比较,★P<0.01;与溶媒对照组比较,#P<0.01;与CA1区比较,※P<0.01
组 别嗅球阴性对照组 182.24±1.49 197.08±2.19※ 180.08±1.80 194.58±1.42※ 180.69±2.05 194.22±2.38 4d CA1区 嗅球7d CA1区 嗅球14d CA1区※痴呆组 177.36±1.12*△▲186.60±3.79*△▲※ 168.57±2.23*△★ 180.85±5.11*△★※ 161.93±0.77*△ 174.70±3.49*△※溶媒对照组 176.98±1.48 185.91±0.58※ 167.09±2.05 183.32±1.39※ 159.55±1.48 182.52±3.20※抑制剂组 181.37±0.98# 194.75±2.08#△☆※ 175.67±2.26# 191.55±1.62#△※ 170.38±1.34# 186.65±3.47#△※
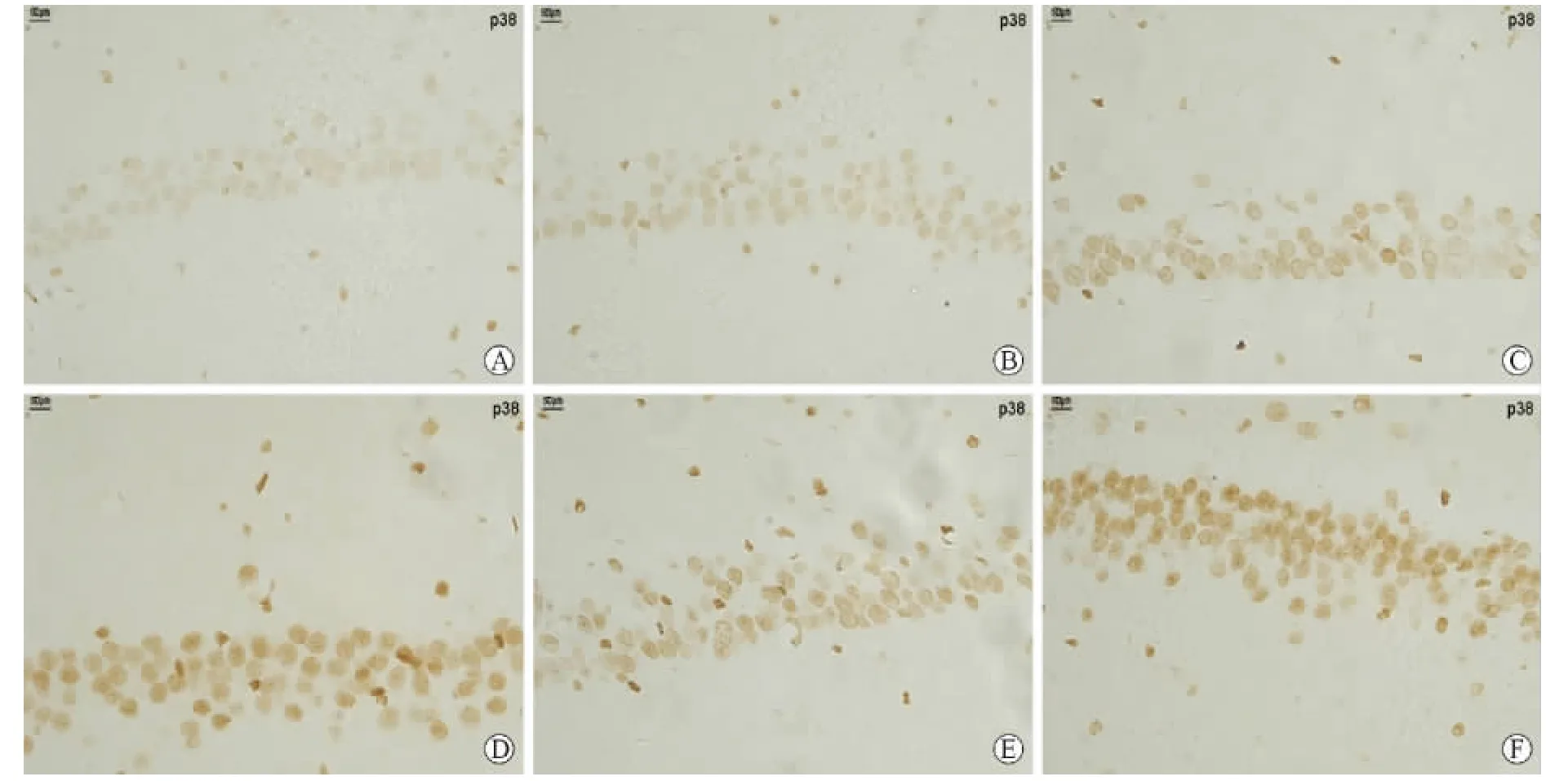
图1 p-p38蛋白在Aβ诱导大鼠损伤海马CA1的表达

图2 p-p38在Aβ诱导大鼠损伤嗅球的表达
讨 论
研究报道,p38在细胞应激时的炎症反应,参与了风湿性关节炎等外周疾病的病理过程。近年来发现,除了外周的作用,p38可能作为激酶级联中的终末激酶、参与转录调控、参与炎症反应、促使tau蛋白过磷酸化、促使神经元凋亡或与其他信号转导通路协同介导细胞应激诱发的基因表达和酶活力改变等途径,在AD病理机制中发挥作用[7,8],研究显示,在 AD发生发展中,p38的作用可能类似炎症过程的正反馈环,除了炎症,尚有许多物质以及AD形成中的各类神经元和非神经元均可诱导其产生效应[7,9],这种变化不仅出现于大脑皮质,也出现在海马及嗅球,p38的激活贯穿于AD的全过程。本研究比较了注射Aβ25-35后AD大鼠嗅球与海马p-p38蛋白的表达状况,结果发现,建模第4天p-p38蛋白在海马及嗅球均明显表达,随着观察时点的延长,于第7天和第14天表达的p-p38蛋白逐渐增多,在各观察时点嗅球与海马CA1区p-p38蛋白的表达规律相一致,p-p38蛋白在海马的表达均高于嗅球的表达,提示p38信号转导通路确实参与了AD的病理过程,海马CA1区对Aβ25-35诱导损伤更敏感。
在传统的抑制剂中,SB203580具有很强的选择性,它可以通透细胞对细胞内的p-p38活性发挥抑制作用。研究认为,SB203580并非通过阻断上游激酶对p38的激活,而是通过竞争结合蛋白激酶ATP-结合袋,使p-p38失去了与ATP结合的能力,抑制p38催化活性而发挥作用[10]。
本实验用0.1nmol/μl共5μl的SB203580于 Aβ注射前30min注入大鼠侧脑室,观察大鼠各项指标的变化。与痴呆组比较,抑制剂组大鼠的学习记忆障碍明显改善,比较海马CA1区及嗅球的p-p38阳性细胞数发现,不论在嗅球还是海马,抑制剂组与痴呆组比较,在Aβ注射4d时活化的p-p38几乎被完全抑制,而在Aβ注射7d,14d则被部分抑制,提示SB203580可能减轻的AD病理过程,有可能在AD治疗中发挥作用,但是这种抑制作用并不持久,与相关报道一致[11]。分析p-p38仅被部分抑制的原因可能如下:由于p38在AD病程中处于一个类似炎症过程的正反馈环内,新的应激以及Aβ持续存在,会不断刺激更多p38分子活化,p38处于持久活化状态,而抑制剂SB203580是通过与ATP竞争p38结合位点发挥作用,故无法阻断上游激酶对p38的激活;并且,作为竞争性抑制剂,SB203580的应用剂量是有限的,不能抑制无限增长的p38与ATP结合活化。
由此得出,p38信号转导通路的激活贯穿于Aβ25-35诱导的AD全过程,磷酸化的p38可表达于大鼠嗅觉中枢及海马,虽然AD早期即有嗅觉障碍,但是海马CA1区p-p38的表达比嗅球更明显,说明海马对Aβ25-35的损伤更敏感。p38抑制剂SB203580能部分减弱Aβ25-35的神经毒性作用,有望成为治疗AD的新靶点。然而,由于机体的复杂性、AD发病机制的复杂性及信号转导通路的复杂性,加之,信号通路之间的串话现象,p38在AD发病中的作用仍需要大量的研究支持。
[1]Schiffman SS.Taste and smell losses in normal aging and disease[J].JAMA,1997,278(16):1357-1362.
[2]Arnold SE,Lee EB,Moberg PJ,et al.Olfactory epithelium amyloid-beta and paired helical filament-tau pathology in Alzheimer disease[J].Ann Neurol,2010,67(4):462-469.
[3]刘智斌,牛文民,杨晓航,等.损毁嗅球对痴呆大鼠学习记忆功能影响作用的实验研究[J].陕西医学杂志,2009,38(1):17-19.
[4]Wilson RS,Arnold SE,Schneider JA,et al.Olfactory impairment in presymptomatic Alzheimer's disease[J].Ann N Y Acad Sci,2009,1170:730-735.
[5]Wesson DW,Wilson DA,Nixon RA.Should olfactory dysfunction be used as a biomarker of Alzheimer’s disease[J]?Expert Rev Neurother,2010,10(5):633-635.
[6]Kovács T,Cairns NJ,Lantos PL.Olfactory centres in Alzheimer's disease:olfactory bulb is involved in early Braak's stages[J].Neuroreport,2001,12(2):285-288.
[7]Zhu X,Mei M,Lee HG,et al.P38activation mediates amyloid-βcytotoxicity[J].Neurochem Res,2005,30(6-7):791-796.
[8]Cao M,Liu F,Ji F,et al.Effect of c-Jun N-terminal kinase(JNK)/p38mitogen-activated protein kinase(p38 MAPK)in morphine-induced tau protein hyperphosphorylation[J].Behavioural Brain Research,2013,237(15):249-255.
[9]Obata T,Brown GE,Yaffe MB.MAP kinase pathways activated by stress:The p38MAPK pathway[J].Crit Care Med,2000,28(4Suppl):67-77.
[10]Gum RJ,McLaughlin MM,Kumar S,et al.Acquisition of sensitivity of stress-activated protein kinases to the P38 inhibitor,SB 203580,by alteration of one or more amino acids within the ATP binding pocket[J].J Biol Chem,1998,273(25):15605-15610.
[11]Lenka M,Alaina JA.Targeting p38MAPK pathway for the treatment of Alzheimer's disease[J].Neuropharmacology,2010,58(3):561–568.
