血小板膜糖蛋白Ⅱb/Ⅲa基因多态性与血小板输注疗效的关系
2013-11-20姚如恩傅启华
顾 萍,王 静,张 帆,姚如恩,傅启华
(上海交通大学医学院附属上海儿童医学中心检验科,上海200127)
血小板膜糖蛋白(GP)Ⅱb/Ⅲa,又称整合素αⅡbβ3,是血小板(PLT)膜上含量最多的膜糖蛋白,通常以复合物形式分布于PLT和巨核细胞表面,是PLT膜的主要受体。GPⅡb/Ⅲa基因的多态性构成不同的PLT血型,是造成PLT输注无效的免疫性因素。
材料和方法
一、对象
98例单采PLT输注患者均来自上海儿童医学中心血液肿瘤科,2010年8月至2011年10月的血液病治疗期间共输注单采PLT 1 468袋,均为输注单采PLT 3次以上且历时半年以上。其中男59例,女39例,年龄5个月~16岁。患者来源为全国各地,江苏、浙江、上海地区占大多数。对照组30例,均为非血液病患者,因PLT减少或术中输注单采PLT 2次以下。
二、方法
1.标本采集 采集患者静脉血标本,以0.109 mol/L柠檬酸钠1∶9抗凝。标本为分2份,1份用于PLT抗体检测,分离血浆于-20℃冻存,1周内检测完毕;另 1份用于抽提 DNA,-80℃冻存。
2.单采PLT来源 单采PLT由上海市血液中心提供。使用Haemonetics MCS+全自动血液成份分离机采集健康献血者PLT。每单位PLT容量约250 mL,含 PLT 约2.5×1011个。
3.试剂与仪器 TIANamp Blood DNA Kit试剂盒由北京天根生化科技有限公司生产。引物设计参照 NCBI GenBank中 GPⅡb/Ⅲa基因(ITGA2B和ITGB)序列(序列号 NG008331),由上海英骏生物技术有限公司合成,引物序列见表1。聚合酶链反应(PCR)扩增试剂由TaKaRa公司(大连宝生物)生产。PLT抗体检测试剂盒(固相凝集法)及专用离心机由长春博德生物技术有限责任公司生产。PLT计数采用SYSMEX XS-800i全自动血液分析仪,配套试剂、校准品及质控品等均由Sysmex公司生产。
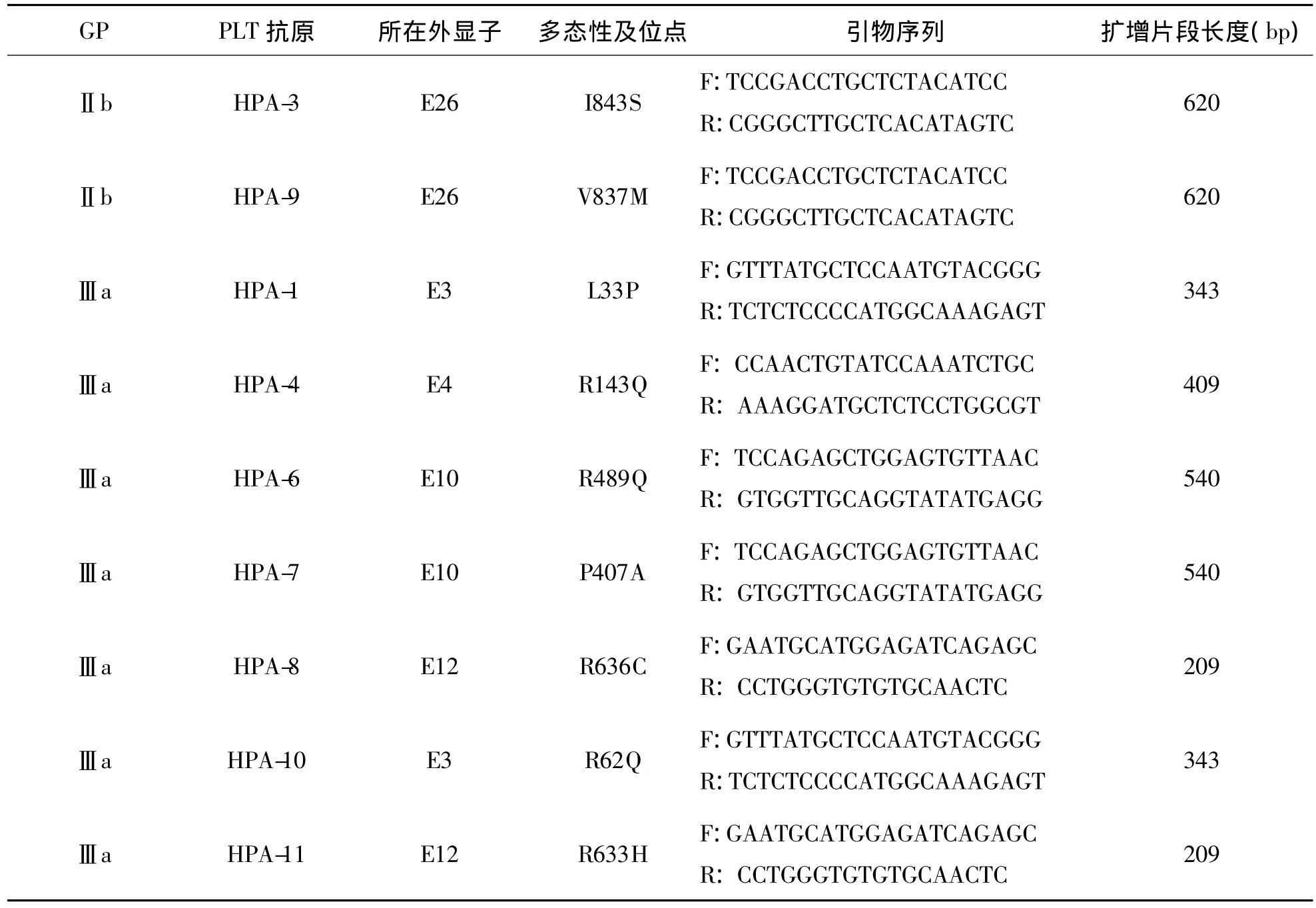
表1 GPⅡb/Ⅲa上的PLT抗原扩增引物序列
4.GPⅡb/Ⅲa基因多态性检测 按试剂盒说明书要求,提取患者基因组DNA进行PCR扩增反应。反应总体积 25μL,包括患者 DNA 1 μL、Taq DNA 聚合酶(5 U/μL)0.25 μL、10× 缓冲液2.5 μL、dNTP(10 mmol/L)2 μL、上下游引物(10 μmol/L)各1 μL、H2O 17.25 μL。扩增条件:95℃ 5 min,然后95℃变性30 s,56~62℃退火30 s,72 ℃ 延伸 30 s,30个循环后,72 ℃10 min。PCR产物经虾碱酶(上海申能博彩生物科技有限公司产品)纯化后直接测序,所用仪器型号为ABI 3730 DNA测序仪。
5.PLT特异性及相关性抗体检测 按试剂盒说明书采用固相凝集法检测患者血浆中IgG型PLT抗体。
6.PLT输注指征 患者PLT减少,有颅内出血、体表有出血点、紫癜、鼻衄、龈血、血尿、消化道出血等出血症状或/和PLT计数<20×109/L伴或不伴出血症状。
7.PLT输注疗效评价 本研究采用输注后24h PLT计数纠正增加指数(corrected count increment,CCI)作为评判依据。CCI=绝对增加数×体表面积/输入PLT总数。输注后24h CCI>4.5为输注有效,否则为输注无效。
三、统计学方法
采用SPSS 13.0软件统计。采用卡方检验进行数据分析。P<0.05为差异有统计学意义。
结 果
一、GPⅡb/Ⅲa基因多态性检测结果
对所有患者的GPⅡb的E26和GPⅢa的E3、E4、E10、E12 外显子进行测序分析,并与Genbank(序列号NG008331)相比对,结果除GPⅡb的E26存在T18809G的变异外,其他外显子未发现变异。T18809G变异导致Ⅱb基因编码843位的异亮氨酸为丝氨酸所取代,产生I843S(Ile843Ser)多态性。此多态性形成了PLT特异性抗原(human platelet antigen,HPA)-3血型的3种基因型,即 HPA-3aa、HPA-3ab、HPA-3bb(图1)。3种基因型的例数分别为31、46、21例。
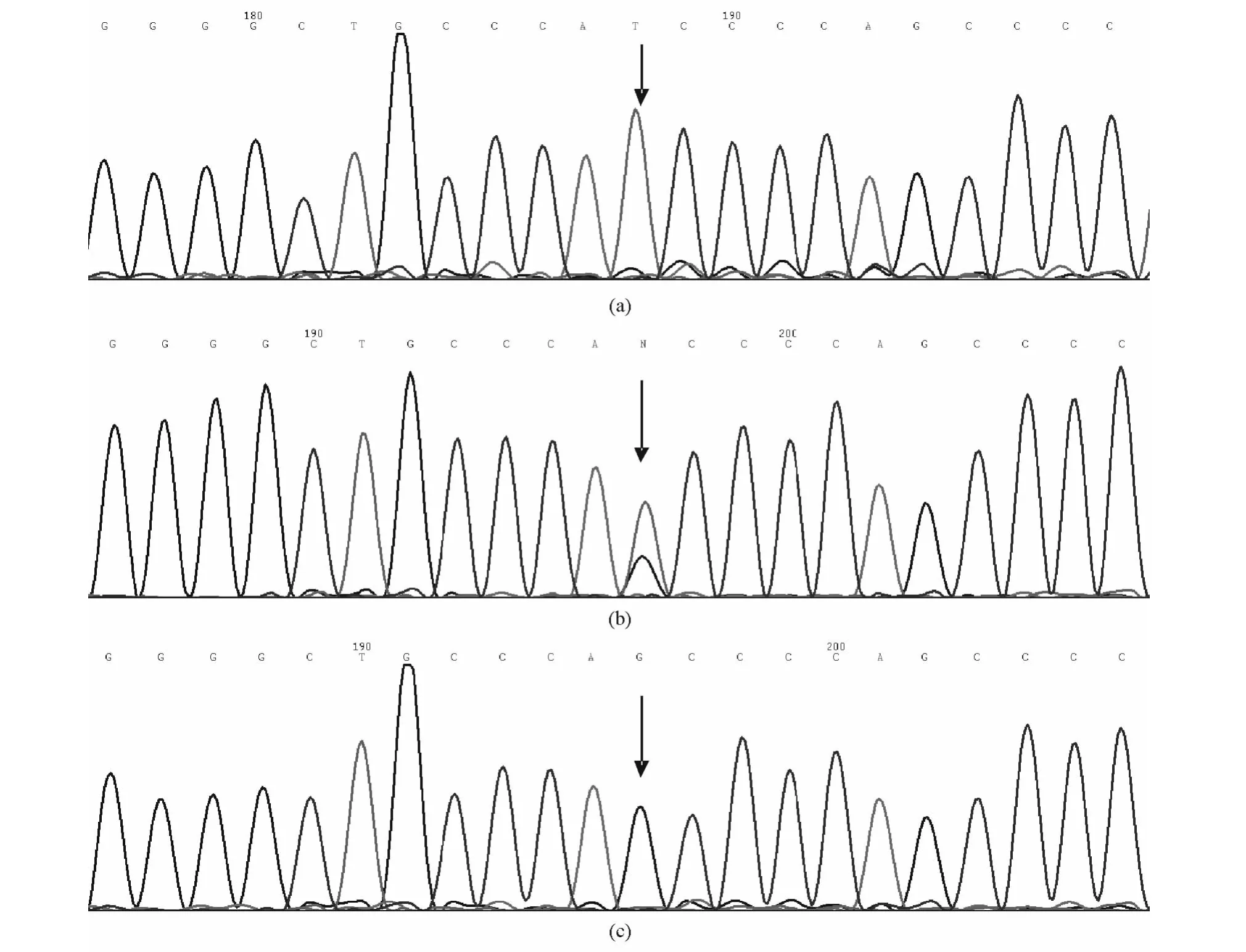
图1 HPA-3基因多态性产生的3种血小板血型
二、PLT特异性及相关性抗体检测结果
PLT抗体包括由PLT HPA产生的PLT特异性抗体和由HLA、红细胞抗原等共同抗原产生的相关性抗体。患者组PLT抗体阳性率为52.0%,明显高于对照组(13.3%,P<0.01),见表2。说明PLT抗体在多次输注PLT的血液科患者中明显升高。3种HPA-3基因型之间PLT抗体阳性率无差异(P>0.05),说明HPA-3 3种基因型患者在多次输注PLT后都会产生PLT抗体,相互间无区别。见表3。
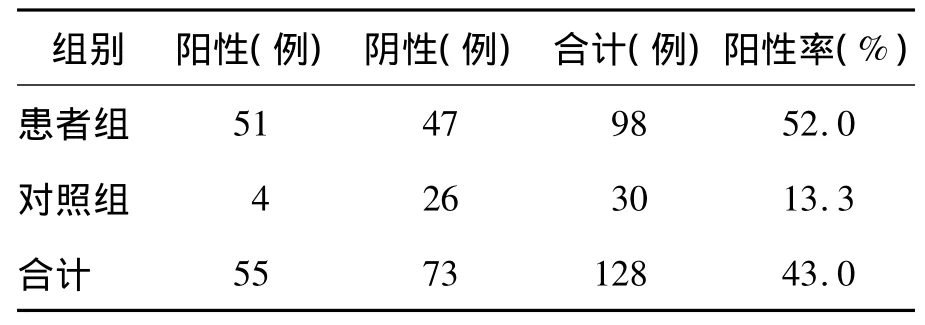
表2 PLT抗体检测结果

表3 3种HPA基因型产生PLT抗体的比较
三、PLT输注效果评价
1 468袋PLT中有1 142袋输注后24h CCI>4.5,有效率为77.8%。PLT输注的有效性在HPA-3的3个基因型中无明显差异(P>0.05),其中HPA-3ab略高,见表4。对51例存在PLT抗体的患者中的21例做了PLT配合性输注,共输注单采 PLT 65袋,有效输注54次,有效率为83.1%。
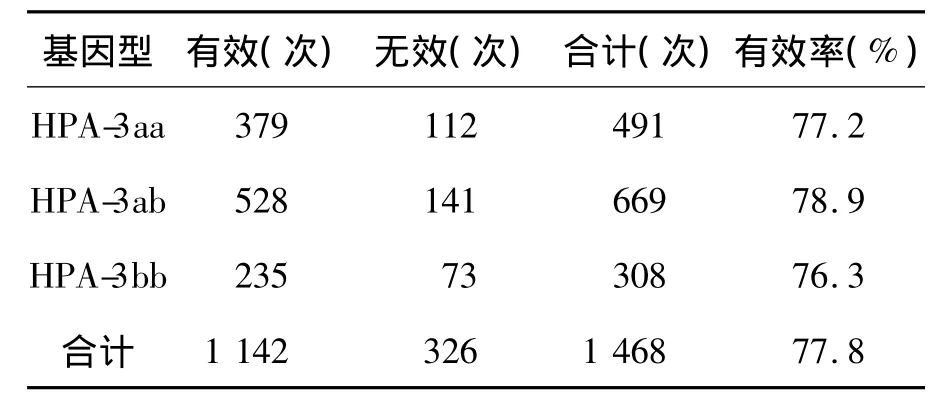
表4 PLT输注疗效在HPA-3基因型中的比较
讨 论
PLT GPⅡb/Ⅲa复合物是由α和β以非共价键结合而组成的异二聚体蛋白,其编码基因ITGA2B和ITGB3均位于染色体17q21~22上,以常染色体双等位基因以共显性模式控制。GPⅡb基因(ITGA2B)长17.2 Kb,含30个外显子,编码1 039个氨基酸。GPⅢa基因(ITGB3)长度为46 Kb,属于单拷贝基因,含15个外显子,编码778个氨基酸。GPⅡb和GPⅢa上均有很高的多态性,除HPA-14w外,绝大多数是由相应PLT GP结构基因中的单核苷酸多态性(SNP)引起,其多态性构成了人类PLT HPA,并表现为PLT独特的遗传多态性。
GPⅡb的第26外显子上存在I843S和V837M 2个多态性,分别构成HPA-3和HPA-9血型。GPⅢa的第3、4、10、12外显子上存在L33P、R143Q、R489Q、P407A、R636C、R62Q、R663H 多态性,构成 HPA-1、HPA-4、HPA-6、HPA-7、HPA-8、HPA-10和HPA-11共7个血型。
本研究通过对98例长期输注PLT的血液病患者GPⅡb和GPⅢa的9个多态性位点的检测,发现GPⅡb上存在I 843S多态性,即HPA-3aa、HPA-3ab和HPA-3bb 3个基因型,其余多态性未检出。迄今为止,已有多篇文献[1-7]报道了不同国家、不同地区、不同人群的HPA基因检测频率存在差异。我国汉族人群的HPA多态性大多集中在HPA-1~6和 HPA-15上,特别是 HPA-3和HPA-15,该二者的a、b等位基因频率几乎各占一半,其a/b抗原不配合几率越高,在PLT输注时刺激受者免疫系统产生PLT抗体的几率就越大,HPA-3尤为严重。本研究结果显示,98例患者HPA-3的基因频率趋势与报道类似,因是收治的血液病患者而非普通人群调查,所以只能显示大体趋势。本研究未检出多态性的HPA-4、7、8、9、10、11的aa型频率在江苏、浙江、上海地区汉族人群中均为100%[6],HPA-1、6的 aa型频率均>98%。本研究的标本量相对较小,是未能检出多态性的原因。
GPⅡb/Ⅲa基因多态性导致分子结构的空间构象发生改变,改变了其抗原性,调节了其表达水平,表面抗原构象的改变导致抗体的产生,进而影响PLT输注的疗效,出现输注耐受现象。PLT抗体包括特异性抗体和相关性抗体,分别由HPA、共同抗原(包括 HLA和ABO、Lewis、P等红细胞血型抗原)免疫刺激而产生。本研究结果显示,98例患者长期输注PLT后,有52%的患者产生PLT抗体,有效输注率为77.8%。产生PLT抗体的患者并非每次输注随机的PLT都无效,本研究结果显示,HPA-3ab型患者输注有效率最高(78.9%),aa 型 居 中 (77.2%),bb 型 最 低(76.3%)。这种情况可能与献血员的PLT血型有关。如aa型患者数量多于bb型,根据基因频率,此型献血员数量也应该多于bb型,而ab型患者可接受aa、bb和ab 3种基因型的PLT,这些因素可能是造成aa型和ab型患者PLT输注有效率略高的原因。此外,PLT相关抗体中的HLA抗体对PLT输注效果影响很大,故HPA-3ab型患者并非每次输注都有效,而且21例有抗体的患者输注65袋配合型的PLT后,疗效仅为83.1%。HPA抗体最易产生,但由于HLA更具多态性,因此HLA抗体更常见。机体产生的HLA抗体往往具有多特异性。当HLA抗体合并HPA抗体时,PLT输注无效更易发生。HLA抗体数量占主要地位,其次为HPA抗体[8-9]。故PLT抗体是造成输注无效的免疫性原因,PLT GP多态性是产生PLT抗体的主要原因之一。
全世界每年用于治疗性输注的PLT有几百万单位,但随之而来的是由此而引发的同种免疫应答等造成的输注无效[10]。治疗PLT输注无效,应当从病因着手,采取不同的治疗方案。由非免疫因素引起的输注无效,应以治疗原发病为主,如抗感染、脾切除、增加PLT输注量来提高效果,而由免疫因素引起的,则应首先选择PLT相容性输注[11],即选择 ABO同型、HLA和 HPA交叉配型均相合的单采PLT输注[12],给患者输注“合适的PLT”,取代随机性 PLT的输注[13]。但在实际工作中寻找三者完全相同的PLT非常困难,只有部分患者可在其亲属中找到,因此除依靠采血机构建立HLA和HPA供者分型库提供及时、有效的输注途径外,临床上使用去除白细胞的PLT、γ-辐照PLT、药物(丙种球蛋白)等也是必不可少的治疗方案。
[1]Jones DC,Bunce M,Fuggle SV,etal.Human plateletalloantigens(HPAs):PCR-SSP genotyping of a UK population for 15 HPA alleles[J]. Eur J Immunogenet,2003,30(6):415-419.
[2]Pavkovic M,Petlichkovski A,Strezova A,etal.Gene frequencies of human platelet antigens in the Macedonian population[J].Tissue Antigens,2006,67(3):241-246.
[3]Nie YM,Zhou HJ,Fu YS,etal.The allele frequencies of HPA 1-16 determined by PCR-SSP in Chinese Cantonese donors[J].Transfus Med,2010,20(6):376-382.
[4]刘建军,李志强.上海地区汉族人群人类血小板抗原基因的多态性研究[J].临床输血与检验,2008,10(3):209-214.
[5]李执如,王乃红,杨群身,等.HPA抗原基因频率和不配合率[J].中国输血杂志,2006,19(3):236-237.
[6]林岳兴,朱玲玲,徐建忠.浙江汉族人群血小板抗原1-16多态性调查[J].中国输血杂志,2007,20(6):487-490.
[7]李 双,王赤林,谢毓斌,等.长沙地区固定血小板献血者血小板抗原1~5、15系统基因多态性及分析[J].中国输血杂志,2006,19(3):198-200.
[8]Fullard JF.The role of the platelet glycoproteinⅡb/Ⅲa in thrombosis and haemostasis[J].Curr Pharm Des,2004,10(14):1567-1576.
[9]Lo SC,Lin DT,Lin SW,etal.Frequency and characterization of platelet-specific antibodies in patients who received multiple platelet transfusions[J].J Formos Med Assoc,2000,99(12):902-905.
[10]Stroncek DF,Rebulla P.Platelet transfusions[J].Lancet,2007,370(9585):427-438.
[11]Curtis BR.Genotyping for human plateletalloantigen polymorphisms:applications in the diagnosis of alloimmune platelet disorders[J].Semin Thromb Hemost,2008,34(6):539-548.
[12]Marwaha N,Sharma RR.Consensus and controversies in platelet transfusion[J].Transfus Apher Sci,2009,41(2):127-133.
[13]于洪敏,刘凤华,曹荣祎,等.血小板输注效果的临床分析[J].国际检验医学杂志,2011,32(6):651-652.
