Livin、Caspase-3在结肠腺癌及结肠腺瘤组织中的表达及意义
2013-11-20杨长命刘洪玲李文思陈学军辽宁医学院病理教研室辽宁锦州200
杨长命 刘洪玲 李文思 陈学军 (辽宁医学院病理教研室,辽宁 锦州 200)
结肠腺瘤是结肠良性肿瘤,是结肠腺癌形成的一个必然经过,因此积极诊断和治疗结肠腺瘤是减少结肠腺癌发病的重要途径。Livin和Caspase-3是肿瘤发生和发展中起重要作用的相关蛋白。本研究通过免疫组织化学染色方法和Western印迹方法检测结肠腺癌、结肠腺瘤和结肠正常黏膜中Livin和Caspase-3的表达情况,探讨其在结肠腺癌中的临床意义。
1 材料与方法
1.1 临床资料 随机选取2008年1月至2012年1月我院病例完整的89例结肠腺癌手术存档蜡块,患者术后均经两位病理科医师确诊为结肠腺癌,术前均未接受化疗、放疗及其他治疗,其中男50例,女39例,年龄28~82(平均55)岁;高-中分化65例,低分化24例;TNM 分期,Ⅰ ~Ⅱ期50例,Ⅲ~Ⅳ期39例。89例病例中有39例发生淋巴结转移,50例无淋巴结转移。50例结肠腺瘤手术存档蜡块,经病理诊断学确诊为腺瘤。癌旁5 cm以外结肠组织均未见癌组织浸润作为正常组40例。所有组织标本均经10%甲醛固定,石蜡包埋。同时收集50例新鲜结肠腺癌、癌旁组织(距癌边缘5 cm以内)和结肠正常黏膜组织(距癌边缘5 cm以外)标本放入-80℃冰箱冷藏待Western印迹法检测。
1.2 主要试剂 采用免疫组化PV-9000和Western印迹法,一抗为兔抗人Lvin单克隆抗体(北京博奥森生物技术有限公司)和兔抗人Caspase-3单克隆抗体(北京博奥森生物技术有限公司)。工作浓度1∶100,免疫组化和Western印迹所用试剂盒均由北京中衫生物有限公司提供。
1.3 实验方法
1.3.1 免疫组织化学PV-9000两步法 切片厚4 μm,脱蜡至水。置于3%H2O2内10 min灭活内源性过氧化物酶的活性。高压抗原修复后,室温自然冷却,滴加一抗,4℃冰箱过夜;PBS液冲洗2 min 3次,滴加试剂1(聚合物辅助剂),37℃温箱内孵育20 min;PBS液冲洗2 min 3次,滴加试剂2(辣根酶标记羊抗鼠IgG多聚体),37℃温箱内孵育30 min;PBS液冲洗2 min 3次,DAB显色,蒸馏水冲洗、苏木精复染、乙醇脱水、二甲苯透明、中性树脂封片。每批均设已知阳性切片作对照,用PBS缓冲液代替一抗作阴性对照。
1.3.2 Western印迹方法 分别取冻存的不同结肠组织各50 mg,称重,粉碎、低温18 000 r/min、离心30 min、取上清液。试验设标准管、样品管、空白管,在波长为650 nm的条件下测定OD值。取50 μl蛋白样品,8%聚丙烯酰胺凝胶电泳分离,90 V,1.5 h。转膜至醋酸纤维素膜上,TBS液洗膜10 min,5%脱脂奶粉封闭过夜。TTBS洗涤2次,5 min/次,分别加入一抗,二抗,室温孵育,加入碱性磷酸酶底物,显色液显色。UPV扫描仪扫描成像。
1.4 结果判定
1.4.1 免疫组化结果判定及分析方法 Livin和Caspase-3两者均表达于细胞质,Livin也可以在细胞核表达,免疫组化阳性表达为棕黄色颗粒,且其着色强于背景非特异性染色,两人双盲法观察组织切片,每例切片随机选取5个高倍镜视野(400倍)进行结果判定。按染色强度及阳性细胞数占肿瘤细胞总数的百分比综合计分。染色强度:无色为0分,淡黄色为1分,棕黄色为2分,棕褐色为3分;阳性细胞数:<5%为0分,5% ~25%为1分,26% ~50%为2分,>50%为3分。染色强度得分与阳性细胞数得分相乘,0分为阴性“-”,1~3分为弱阳性“+”,4~5分为中度阳性“⧺”,≥6分为强阳性“⧻”。
1.4.2 Western印迹结果判定 Livin蛋白在33 kD处显示特异性条带,设分子量为42 kD β-actin为内参,Caspase-3蛋白在33 kD处显示特异性条带,设分子量42 kD β-actin为内参。
1.5 统计学分析 采用SPSS17.0软件,各组间率的比较采用χ2检验。分析Livin与Caspase-3蛋白间关系采用Spearman相关分析。
2 结果
2.1 Livin及Caspase-3蛋白在不同结肠组织中的表达 Livin及Caspase-3蛋白在不同结肠组织中的表达,均有显著差异(P<0.05)。见表1。

表1 Livin及Caspase-3蛋白在不同结肠组织中的阳性表达〔n(%)〕
2.2 结肠腺癌中Livin与Caspase-3蛋白表达与临床病理学参数的关系 Livin蛋白在TNMⅢ~Ⅳ期和淋巴结转移组阳性率显著高于TNMⅠ~Ⅱ期和无淋巴结转移组(P<0.05);在外膜浸润组阳性率高于肌层以内浸润组,低分化组Livin蛋白阳性率显著高于高-中分化腺癌组(P<0.05),但Livin蛋白的表达量与肿瘤大小无关(P>0.05)。Caspase-3蛋白在TNMⅢ~Ⅳ期和淋巴结转移组阳性率显著低于TNMⅠ~Ⅱ期和无淋巴结转移组;在外膜浸润组阳性率低于肌层以内浸润组,在低分化组Caspase-3蛋白阳性率显著低于高-中分化腺癌组(P<0.05),但Caspase-3蛋白的表达量与肿瘤大小无关(P>0.05)。见表2。

表2 结肠腺癌中Livin与Caspase-3蛋白阳性表达与临床病理学参数的关系〔n(%)〕
2.3 Livin和Caspase-3蛋白在结肠腺癌中表达的相关性 应用Spearman相关性分析,在结肠腺癌中Livin与Caspase-3蛋白表达之间呈负相关(r=-0.219,P<0.05)。
2.4 Western印迹结果 应用抗Livin单克隆抗体检测,在约33 kD处出现特异性染色条带;应用抗Caspase-3单克隆抗体检测,在约33 kD处出现特异性染色条带,以β-actin(42 kD)处作内参对照(图1)。对50例结肠腺癌、癌旁、正常组织的Western印迹结果进行灰度测定和分析,经方差分析发现结肠腺癌组织中Livin蛋白的表达量明显高于癌旁及正常结肠组织(P<0.05),结肠腺癌组织中Caspase-3蛋白的表达量明显低于癌旁及正常结肠组织(P<0.05)。见表3。

图1 各结肠组织Livin、Caspase-3 Western印迹表达情况
表3 Western印迹检测Livin和Caspase-3蛋白在各结肠组织中的表达(s)
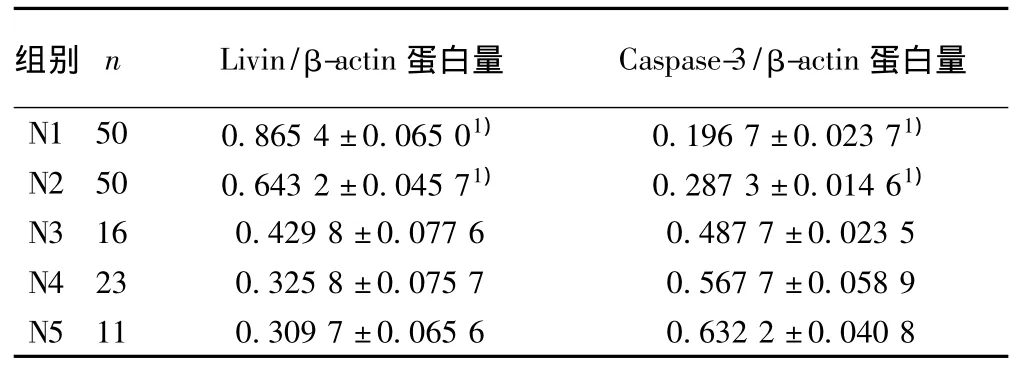
表3 Western印迹检测Livin和Caspase-3蛋白在各结肠组织中的表达(s)
N1为正常组,N2为癌旁组织,N3为高分化腺癌,N4为中分化腺癌,N5 为低分化腺癌,1)与 N3、N4、N5组比较:P <0.05
N1 50 0.865 4±0.065 01) 0.196 7±0.023 71)N2 50 0.643 2±0.045 71) 0.287 3±0.014 61)N3 16 0.429 8±0.077 6 0.487 7±0.023 5 N4 23 0.325 8±0.075 7 0.567 7±0.058 9 N5 11 0.309 7±0.065 6 0.632 2±0.040 8
3 讨论
Livin蛋白的表达具有明显的组织选择性,现已证实在很多恶性肿瘤中有Livin蛋白的过度激活及表达,其中包括黑色素瘤、浅表性膀胱癌、神经母细胞瘤及卵巢癌等〔1~5〕。本研究提示Livin在蛋白水平上表达上调可能在促进结肠上皮细胞异常增殖和恶性转化中起着重要作用。邹爱民等〔6〕在12种肿瘤细胞系和50例不同肿瘤组织中检测了Livin蛋白的表达,发现Livin蛋白在8个细胞系中有阳性表达,本文中肿瘤组织的Livin表达均高于相应的癌旁组织,分析其与结肠腺癌临床病理特征的关系发现,随着结肠腺癌临床分期的增加,Livin蛋白的阳性表达率及蛋白表达量亦显著升高,而与肿瘤的直径无关,与肿瘤的病理分级及有无淋巴结转移有显著关系。Yagihash等〔7〕研究证明,用荧光定量RT-PCR检测多种消化道肿瘤细胞系,包括胰腺癌、胃癌、结肠癌以及肝癌,发现胃肠道肿瘤中存在Livin mRNA过表达,与人消化系统肿瘤的发生存在一定关系。在胃肠道肿瘤患者的血清中抗Livin抗体也显著升高,预示Livin可作为一种新肿瘤抗原来检测胃肠道肿瘤。
活化的Caspase-3执行效应Caspase的作用,非选择性分裂水解其他蛋白、内源性核酸内切酶以及本身,激活DNA片段因子,导致DNA降解、核浆碎裂、细胞凋亡。本实验显示Caspase-3蛋白呈阳性表达率明显低于正常结肠组织及癌旁组织。Livin能够与Caspases蛋白结合发挥抗细胞凋亡的作用。它特异性表达于人的胚胎组织、胎盘组织及大多数人类实体瘤细胞。此外,在正常成人组织的表达见于心脏、脾、卵巢、肺、脑、骨骼肌和淋巴细胞,但含量很低〔8〕。Kasof等〔9〕证明 Livin能够直接抑制Caspase-3、-7、-9的酶水解作用。Livin抑制Caspases活性的作用是由BIR结构域来完成的,可能阻止Caspase蛋白在细胞凋亡时执行蛋白切除功能。Livin的RING结构域可引起Caspase蛋白的降解,发挥其抗凋亡作用。
联合检测Livin和Caspase-3蛋白的表达可能作为结肠癌诊断的指标之一,同时Livin在结肠癌中过度表达,有望成为结肠癌靶向治疗的一个新的分子靶点,进一步提高结肠癌临床治疗效果。Livin蛋白高表达、Caspase-3蛋白低表达与肿瘤浸润和转移密切相关,通过检测Livin、Caspase-3蛋白表达情况对患者的预后作出评估。由于肿瘤的发生发展过程受诸多因素的影响,是多种基因、蛋白相互协助作用的结果,因此,结肠癌的发生发展、浸润转移机制仍需进一步探讨。
1 Ross L,Bette Caan,Rowan T,et al.Low-fat dietary pattern and risk of invasive breast cancer〔J〕.JAMA,2006;295(6):629-42.
2 Vucic D,Stennicke HR,Pisabarro MT,et al.ML-IAP,a novel inhibitor of apoptosis that is preferentially expressed in human melanomas〔J〕.Curr Biol,2000;10(21):1359-66.
3 Gazzanign P,Gradilone A,Giuliani L,et al.Expression and prognostic significance of Livin,Survivin and other apoptosis-related genes in the progression of superficial bladder Cancer〔J〕.Ann Oncol,2003;14(1):85-90.
4 Kim DK,Alvarado CS,Abramowsky CR,et al.Expression of inhibit or ofapoptosis protein(IAP)Livin by neuroblastoma cells:correlation with prog nositic factions and outcome〔J〕.Pediator Dev Pathol,2005;8(6):621-9.
5 Nedelcu T,Kubista B,Koller A,et al.Livin and Bcl-2 expression in high grade osteosarcoma〔J〕.Cancer Res Clin Oncol,2008;134(2):237-44.
6 邹爱民,沈建军,高 萍,等.恶性肿瘤细胞及组织中凋亡抑制蛋白livin的表达及其临床意义〔J〕.肿瘤,2007;27(7):570-2.
7 Yagihash IA,Asanuma K,Tsuji N,et al.Detection of anti-livin-body in gastrointestinal cancer patients〔J〕.Clin Chem,2003;49(7):1206-8.
8 Ashhab Y,Alian A,Poliack A,et al.Two splicing variants of a new inhibitor of apoptosis gene with different biological propenies and tissue distribution pattern〔J〕.FEBS Lett,2001;495(12):56-60.
9 Kasof GM,Comes BC.Livin,a novel inhibitor of apoptosis protein family member〔J〕.Biol Chem,2001;276(5):3238-46.
