结直肠癌组织中Ang-2、Tie-2 mRNA的表达及K-ras基因突变的检测*
2013-11-20王瑞华谢建国常玉玺
王瑞华,谢建国,付 强,谢 天,马 杰,常玉玺
1)上海市奉贤区中心医院消化内科 上海 201499 2)郑州大学附属肿瘤医院普外科 郑州 450008 3)郑州大学附属肿瘤医院病理科 郑州 450008
肿瘤的血管生成受到多种血管生成因子的调控,近年来,越来越多的研究关注促血管生成素家族,尤其促血管生成素-2(angiopoietin-2,Ang-2)[1]。Ang-2是Tie/angiopoeitin信号通路的一部分,涉及血管的形成和发育。Ang-2及其特异性酪氨酸激酶受体-2(tyrosine kinase receptor-2,Tie-2)是肿瘤血管生成的重要调节因子[2]。Ang-2/Tie-2信号通路激活将导致血管内皮细胞结构不稳定,诱导血管生成[3]。ras基因是最常见的癌基因,它由K-ras、H-ras和N-ras家族组成。研究[4]表明K-ras为大肠癌转化基因,其突变是大肠癌发生发展过程中早期分子事件之一。作者对结直肠癌组织中Ang-2、Tie-2 mRNA的表达及K-ras基因突变进行检测、分析,探讨其在结直肠癌发生发展过程中的作用。
1 材料与方法
1.1组织来源标本来自郑州大学附属肿瘤医院普外科2010年6月至2011年6月经手术切除、病理证实的结直肠腺癌40例,10例正常大肠组织取自切除肠段的断端。其中男21例,女19例,年龄27~78岁。高中分化癌31例,低未分化癌9例;Dukes分期:A期4例,B期19例,C期13例,D期4例;大体类型:隆起型22例,溃疡型16例,浸润型2例;无淋巴结转移21例,有淋巴结转移19例(包括肝转移4例);浸润深度:浸润至肌层14例,浸润至浆膜层26例。将组织标本装于冻存管中,迅速置于液氮中保存待检。
1.2试剂及仪器oligo-(dT)(TaKaRa D510),Ribonuclease Inhibitor(TaKaRa D2310A),M-MLV Reverse Transcriptase(Promega M170A),RNA抽提试剂盒、BioEasy SYBR Green Ⅰ Real-time PCR试剂盒(北京尚柏生物医学技术有限公司)。其余生化试剂均为进口分析纯。Line-gene 荧光定量PCR检测系统(杭州博日科技有限公司),DYY-7C型电泳仪及紫外分析仪(北京六一仪器厂),DYCP-31D型水平式电泳槽(北京宾达英创科技有限公司)。
1.3Ang-2、Tie-2mRNA的检测采用Real-time PCR法。将组织在液氮中磨碎,裂解匀浆处理后,提取总RNA,取3 μL逆转录得cDNA,以此为模板行Real-time PCR。所用引物由北京尚柏生物医学技术有限公司合成,引物序列见表1。反应体系: 2×SYBR Mix 25 μL,上、下游引物各1 μL,蒸馏水20.7 μL,Taq DNA聚合酶0.3 μL,cDNA 2 μL。以B2微球蛋白(B2-MG)为内参。反应程序:95 ℃ 120 s;95 ℃ 20 s,59 ℃ 25 s,72 ℃ 30 s,45个循环。记录每个循环反应管中的荧光信号值,并描绘曲线。记录达阈值的最低循环数(Ct值),以2-ΔΔCt表示目的基因的表达量[5]。
1.4K-ras基因突变的检测采用PCR-SSCP方法。将液氮保存的组织匀浆用蛋白酶K消化,酚/氯仿抽提,冷无水乙醇沉淀,0.1×TE溶解,置4 ℃冰箱保存备用。K-ras基因PCR引物序列参照文献[2],由北京尚柏生物医学技术有限公司合成,序列见表2。以GAPDH为内参。PCR反应总体积50 μL,于PCR循环仪94 ℃变性75 s,54 ℃退火60 s,72 ℃延伸60 s,循环35次,最后72 ℃延伸5 min。取PCR产物5 μL与等量加样缓冲液混合,98 ℃变性10 min,冰浴骤冷5 min,然后加样在80 g/L聚丙烯酰胺凝胶上电泳5 h,银染鉴定。

表1 Ang-2、Tie-2及内参PCR引物序列

表2 K-ras及内参PCR引物序列
1.5统计学处理应用SPSS 11.0进行数据分析。正常和癌组织中Ang-2、Tie-2 mRNA表达量的比较,以及K-ras基因突变和未突变癌组织中两者mRNA表达量的比较采用两独立样本的t检验,对癌组织中Ang-2和Tie-2 mRNA表达量行Pearson相关分析,不同临床病理特征的癌组织中Ang-2、Tie-2 mRNA高表达率及K-ras基因突变率的比较采用χ2检验或精确概率法,检验水准α=0.05。
2 结果
2.1结直肠癌组织中Ang-2、Tie-2mRNA的表达
Ang-2、Tie-2 mRNA溶解曲线都为单峰,说明各基因扩增产物纯净,未扩增出非特异性产物。Ang-2、Tie-2 mRNA扩增曲线都呈典型S型,说明各基因产物扩增正常。Ang-2、Tie-2 mRNA在正常组织中的表达量均为1,癌组织中分别为(2.92±0.23)、(2.17±0.15),均较正常组织明显增高(t=39.960、9.490,P<0.001)。结直肠癌组织中Ang-2 mRNA与Tie-2 mRNA表达量呈线性正相关(r=0.772,P<0.001)。以Ang-2、Tie-2 mRNA表达量高于2.92和2.17为高表达,则两者高表达与结直肠癌临床病理特征的关系见表3。

表3 Ang-2、Tie-2 mRNA高表达与结直肠癌临床病理特征的关系 例(%)
*:校正χ2。
2.2结直肠癌组织中K-ras基因突变检测结果40例结直肠癌组织中K-ras基因突变率为42.5%(17/40)。突变的17例中,11例为12密码子由GGT到GAT突变,6例为13密码子由GGC到GAC突变。不同临床病理特征结直肠癌组织中K-ras基因突变率的比较见表4。
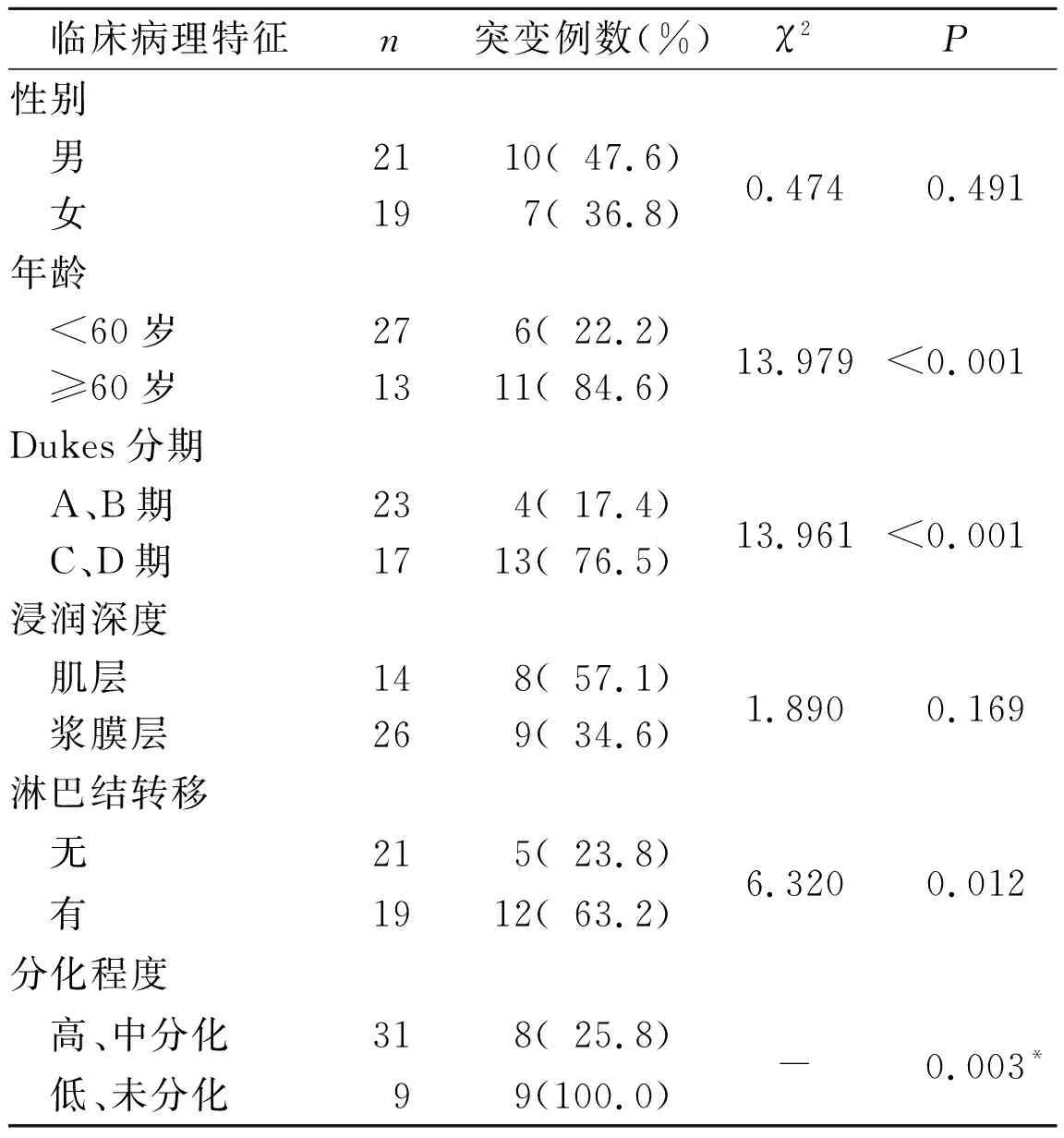
表4 不同临床病理特征结直肠癌组织中K-ras基因突变率的比较
*:精确概率法。
2.3结直肠癌组织中K-ras基因突变与Ang-2、Tie-2mRNA表达的关系见表5。
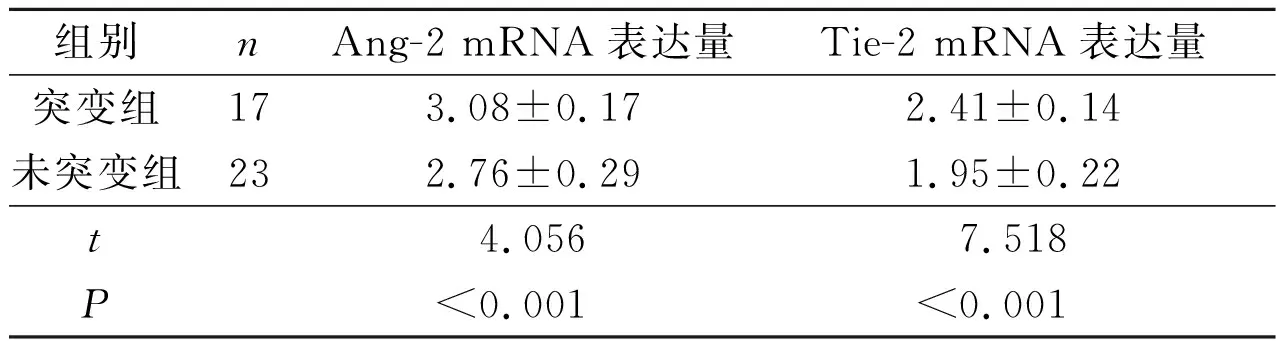
表5 结直肠癌组织中K-ras基因突变与Ang-2、Tie-2 mRNA表达的关系
3 讨论
Ang-2位于人类染色体的8p23.1,其受体为Tie-2,该受体的磷酸化参与血管生成的延续过程,使血管成熟稳定。有研究[6]表明Ang-2的表达是肿瘤性血管新生起始的强化因素,与肿瘤性血管生成的数目和肿瘤的侵袭转移密切相关。Ang-2与Tie-2受体特异性地结合,可拮抗Ang-1稳定血管结构的作用,消除血管基底膜和周围间质细胞对血管形成的限制,并增加内皮细胞对内皮生长因子等血管增殖因素的敏感性,诱导内皮细胞分裂、萌芽、迁移,从而促进血管生成,血管增生显著,管壁通透性明显增加,继而导致了高度不稳定渗漏性、不成熟性及内皮细胞高度增殖的肿瘤血管持续生成[7]。研究[8]表明,Ang-2是一个独立的指标,可用于临床评价肝细胞癌患者的病情,与肿瘤大小和患者的生存密切相关。有研究[9-12]发现,Ang-2过度表达可导致肺肿瘤不受控制的转移;抑制Ang-2则可减少肿瘤的淋巴结转移和自发性肿瘤的发生;Ang-2是非常有希望的肿瘤治疗靶点。
K-ras基因突变点固定在12、13和61密码子,其中以12位密码子突变最常见。作为一种原癌基因,K-ras基因突变在结直肠细胞癌变的早期即被启动,突变产生具有致癌活性的P21蛋白,通过Ras信号转导通路激活下游信号分子,持续刺激细胞生长、发育、增殖,引起细胞恶变。K-ras基因的激活有多种表现形式,可以是表达增加或是基因突变或是内在的GTP酶活性下降。
该研究结果显示:结直肠癌组织中Ang-2、Tie-2 mRNA的表达明显上调,两者的表达量呈线性正相关,且两者表达量与肿瘤的浸润深度、Dukes分期、淋巴结转移和肿瘤分化程度有关,与Goede等[13]研究结果相同。研究结果还显示,40例结直肠癌组织中K-ras基因突变率为42.5%,K-ras基因突变与性别、肿瘤细胞的浸润深度等无明显相关,但有淋巴结转移者K-ras基因突变率高于无转移者,Dukes分期C、D期者K-ras基因突变率高于A、B期。作者还发现,K-ras基因突变的结直肠癌组织中Ang-2、Tie-2 mRNA表达量高于无突变者,提示K-ras基因突变可能通过促进肿瘤血管的生成,参与了结直肠癌的侵袭、转移。
总之,Ang-2、Tie-2系统在结直肠癌的转移机制和未来的治疗靶点方面值得进一步研究;K-ras基因作为分子生物学指标,对判断结直肠癌转移和预后具有重要意义。
[1]Laurén J, Gunji Y, Alitalo K. Is angiopoietin-2 necessary for the initiation of tumor angiogenesis? [J]. Am J Pathol, 1998,153(5): 1333
[2]Huang H, Bhat A, Woodnutt G, et al. Targeting the ANGPT-TIE2 pathway in malignancy[J]. Nat Rev Cancer,2010,10(8): 575
[3]Saharinen P, Eklund L, Pulkki K, et al. VEGF and angiopoietin signaling in tumor angiogenesis and metastasis[J]. Trends Mol Med,2011,17(7): 347
[4]Mannan A, Hahn-Stromberg V. K-ras mutations are correlated to lymph node metastasis and tumor stage, but not to the growth pattern of colon carcinoma[J]. APMIS, 2012,120(6): 459
[5]张俊,罗娜,王勃,等.上调microRNA-150表达对肝癌SMMC7721细胞增殖和凋亡的影响[J]. 解放军医学杂志,2012,37(10):943
[6]Fagiani E, Lorentz P, Kopfstein L, et al. Angiopoietin-1 and -2 exert antagonistic functions in tumor angiogenesis, yet both induce lymphangiogenesis[J]. Cancer Res, 2011,71(17): 5717
[7]Gevertz JL, Torquato S. Modeling the efects of vasculature evolution on early brain tumor growth[J]. J Theor Biol, 2006,243(4): 517
[8]Kuboki S, Shimizu H, Mitsuhashi N, et al. Angiopoietin-2 levels in the hepatic vein as a useful predictor of tumor invasiveness and prognosis in human hepatocellular carcinoma[J]. J Gastroenterol Hepatol, 2008,23(7 Pt 2):e157
[9]Holopainen T, Saharinen P, D’Amico G, et al. Effects of angiopoietin-2 blocking antibody on endothelial cell-cell junctions and lung metastasis[J]. J Natl Cancer Inst,2012,104(6): 461
[10]Paez-Ribes M, Allen E, Hudock J, et al. Antiangiogenic therapy elicits malignant progression of tumors to increased local invasion and distant metastasis[J]. Cancer Cell, 2009,15(3): 220
[11]Ebos JM, Lee CR, Cruz-Munoz W, et al. Accelerated metastasis after short-term treatment with a potent inhibitor of tumor angiogenesis[J]. Cancer Cell,2009,15(3): 232
[12]Mazzieri R, Pucci F, Moi D, et al. Targeting the ANG2/TIE2 axis inhibits tumor growth and metastasis by impairing angiogenesis and disabling rebounds of proangiogenic myeloid cells[J]. Cancer Cell,2011,19(4): 512
[13]Goede V, Coutelle O, Neuneier J, et al. Identification of serum angiopoietin-2 as a biomarker for clinical outcome of colorectal cancer patients treated with bevacizumab-containing therapy[J]. Br J Cancer, 2010,103(9): 1407
