谷氨酸钠对PC12细胞钠离子通道蛋白1.7表达的影响*
2013-11-20潘帧婕任秀花王剑南邵金平臧卫东
潘帧婕,曹 靖,李 鸣,任秀花,王剑南,邵金平,臧卫东
郑州大学基础医学院人体解剖学教研室 郑州 450001
电压门控钠离子通道1.7的α亚单位(Nav1.7α)由SCN9A基因所编码(定位于染色体2q24.3),包括26个外显子,其主要表达在背根脊神经节细胞和交感神经节细胞[1]。SCN9A基因的突变与3种先天性疾病有关:原发性红斑肢痛症、阵发性剧痛症和先天性无痛症[2-3],说明Nav1.7α可能在疼痛的发生发展过程起重要作用。该实验利用谷氨酸钠刺激PC12细胞模拟疼痛刺激,观察Nav1.7表达量的变化,以判断在细胞水平Nav1.7的表达量与疼痛刺激的关系。
1 材料与方法
1.1主要试剂和仪器谷氨酸钠(美国Amresco公司,产品批号CAS#987-65-5),DMEM(北京Solarbio公司),胰蛋白酶、灭活胎牛血清(中国四季青公司),Nav1.7兔抗鼠多克隆抗体(美国Abcam公司);激光共聚焦显微镜(日本蔡司公司),PCR仪(德国Biometra公司),低温离心机(德国Heraeus公司),普通离心机(德国Eppendorf公司)。
1.2细胞培养PC12细胞由郑州大学基础医学院病理生理学教研室提供,培养于DMEM培养基中,其中含体积分数10%灭活胎牛血清、100 kU/L青霉素及100 μg/L链霉素。细胞置于37 ℃、体积分数5% CO2培养箱中培养,隔天换液,待细胞长至70%~80%融合后,2.5 g/L胰蛋白酶消化,传代培养。
1.3实验分组实验分为对照组和不同浓度的谷氨酸钠刺激组。①对照组:用正常DMEM培养基培养PC12细胞。②不同浓度的谷氨酸钠刺激组:在培养液中分别加入终浓度为5、10、20、40 nmol/L的谷氨酸钠,与PC12细胞共培养14 h。对照组与谷氨酸钠刺激组培养条件一致。
1.4不同浓度谷氨酸钠刺激后PC12细胞Nav1.7表达的免疫荧光检测PC12细胞分别用0、5、20、40 nmol/L谷氨酸钠培养14 h后用PBS冲洗3遍,采用40 g/L多聚甲醛固定30 min,用PBS冲洗5遍。经体积分数0.4% Triton 37 ℃通透10 min, PBS冲洗5遍。底物用含体积分数3% H2O237 ℃孵育10 min, PBS冲洗5遍。山羊血清37 ℃孵育30 min。用Nav1.7单克隆抗体( 150稀释)孵育4 h,PBS冲洗5遍。用绿色荧光二抗37 ℃孵育1 h,然后4 ℃冰箱过夜,PBS冲洗5遍。用Depi(1100稀释)复染细胞核,3 min,用PBS冲洗5遍,-20 ℃保存,共聚焦显微镜拍照。实验重复3次,每次结果选取10个细胞测定绿色荧光强度,结果取平均值。
1.5不同浓度谷氨酸钠刺激后PC12细胞SCN9AmRNA表达水平的RT-PCR检测PC12细胞分别用0、5、10、20、40 nmol/L谷氨酸钠培养14 h后,行SCN9A mRNA表达水平的RT-PCR检测。引物见表1。①细胞总RNA的提取: 收集各组细胞,加入1 mL Trizol,室温放置5 min,使细胞充分裂解。再用氯仿、异丙醇、乙醇等处理,提取总RNA。②逆转录合成cDNA:RNA 10 μL,Random 1 μL,5×反应缓冲液4 μL,RNA酶抑制剂1 μL,10 mol/L dNTP Mix 2 μL,逆转录酶1 μL。42 ℃ 60 min,最后70 ℃ 5 min,终止逆转录反应。③PCR扩增:反应总体系为20 μL。cDNA 2 μL,2×Mix 10 μL,上、下游引物各0.5 μL,DEPC水7 μL。反应程序:94 ℃ 5 min;94 ℃ 40 s,51 ℃ 30 s,72 ℃ 40 s,33个循环;最后72 ℃ 8 min。④PCR产物分析:10 g/L琼脂糖凝胶电泳,Glyko Bandscan软件分析。以SCN9A与内参照扩增产物的光密度值的比值表示SCN9A mRNA的表达水平。实验重复3次。
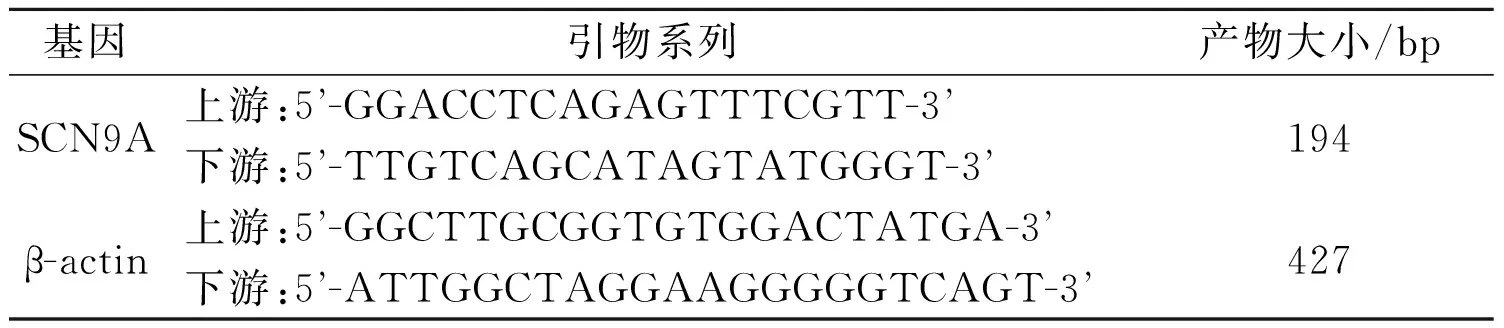
表1 RT-PCR的引物
1.6不同浓度谷氨酸钠刺激后PC12细胞Nav1.7表达的Western-blot检测PC12细胞分别用0、5、10、20 nmol/L的谷氨酸钠培养14 h后,换成正常DMEM培养基再培养24 h。常规胰蛋白酶消化后将胰蛋白酶吸出,加入培养基将细胞吹打起来,收集细胞于EP管中,4 000 r/min离心5 min。用PBS洗3次,4 000 r/min离心5 min,弃上清加入细胞裂解液PMSF 500 μL,冰上孵育5~10 min,14 000 r/min离心 5 min,收集上清,100 ℃ 5 min。Bradford法测蛋白浓度。等量上样后80 g/L分离胶电泳,110 V 90 min转PVDF膜,体积分数5%脱脂奶封闭2 h,洗涤后加Nav1.7一抗(1400稀释),4 ℃过夜,TBST洗涤3遍后加二抗(11 000稀释)室温2 h,增强型发光剂ECL显色,曝光。实验重复3次,结果取目的条带与β-actin条带光密度的比值。
1.7统计学处理采用Graphpad Prism 5进行统计学分析,各组PC12细胞免疫荧光、RT-PCR、Western-blot结果的比较采用单因素方差分析和SNK-q检验,检验水准α=0.05。
2 结果
2.1各组PC12细胞Nav1.7表达的免疫荧光检测结果见图1和表2。
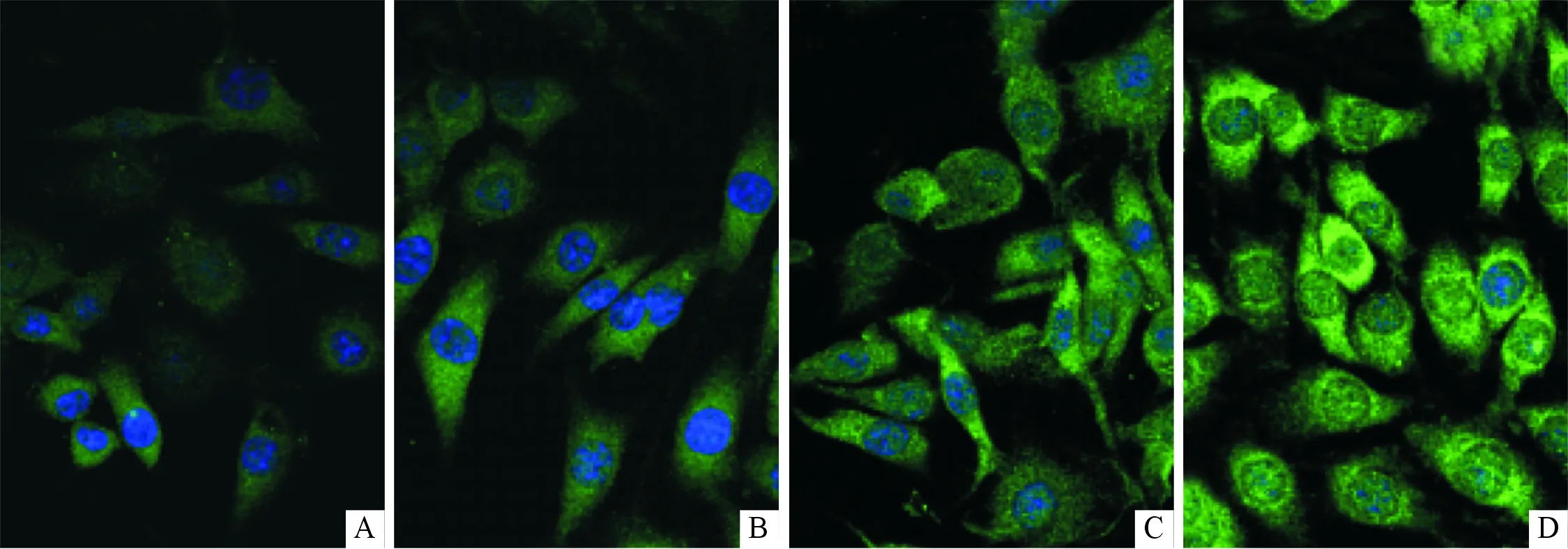
图1 各组PC12细胞Nav1.7的免疫荧光染色结果(×200)
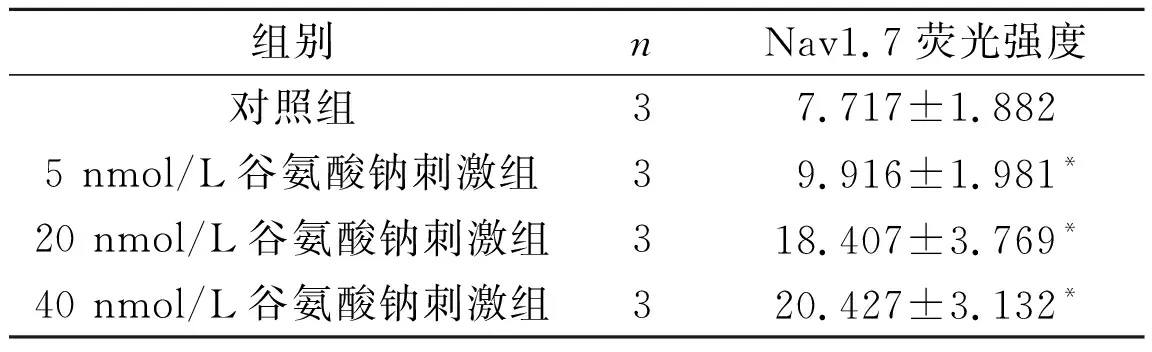
表2 各组PC12细胞Nav1.7免疫荧光检测结果
F=61.871,P<0.001;*:与对照组比较,P<0.05。
2.2各组PC12细胞SCN9AmRNA的表达水平
见图2和表3。
2.3各组PC12细胞Nav1.7表达的Western-blot检测结果见图3和表4。
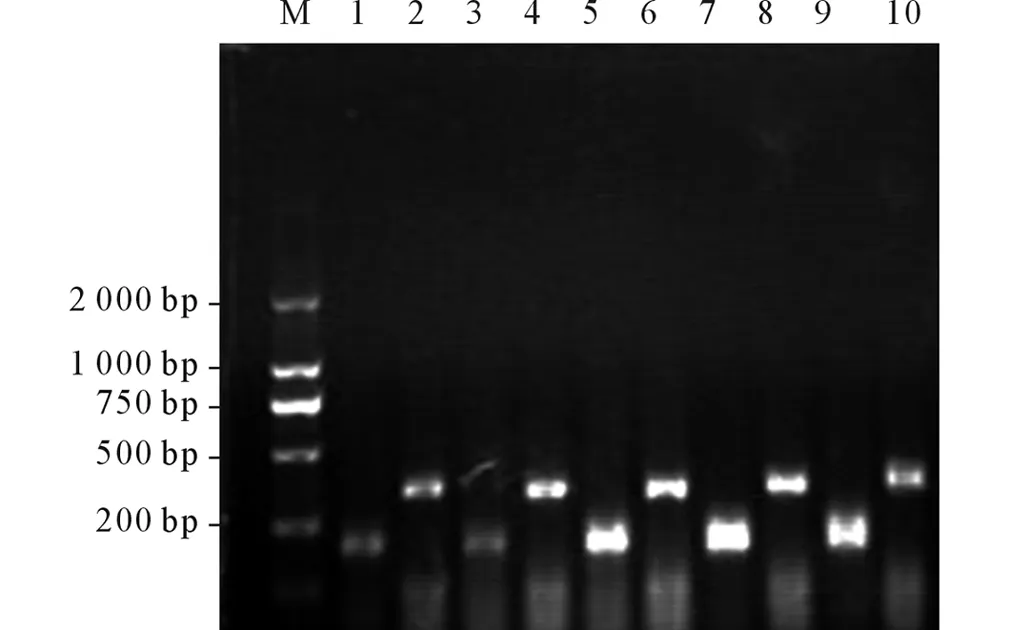
图2 各组PC12细胞SCN9A mRNA表达的RT-PCR检测结果

表3 各组PC12细胞SCN9A mRNA表达水平比较
F=11.821,P<0.001;*:与对照组比较,P<0.05。

图3 各组PC12细胞Nav1.7的Western-blot检测结果

表4 各组PC12细胞Western-blot检测结果
F=23.274,P<0.001;*:与对照组比较,P<0.05。
3 讨论
SCN9A表达于外周神经元及交感神经节,其单基因变异可导致3种与疼痛相关的遗传性疾病。因此SCN9A有可能是研究疼痛的一把关键钥匙[4]。有学者[5]观察到Nav1.7与炎性痛的发生发展密切相关,而与神经病理性疼痛无关。参与慢性疼痛形成与发展的神经递质有许多,其中兴奋性氨基酸[主要是谷氨酸(Glu)]是介导痛觉信息传递最主要的神经递质之一,以Glu为媒介的神经冲动传递诱发痛觉中枢产生高度兴奋性是慢性疼痛形成的重要基础[6]。Glu可以引起神经元兴奋阈值降低、兴奋性增高是慢性疼痛形成的重要起始因素。因此作者利用谷氨酸钠刺激PC12细胞模拟疼痛刺激观察细胞水平Nav1.7表达量的变化与疼痛刺激的关系。
PC12 细胞属大鼠肾上腺髓质嗜铬细胞瘤细胞系。通常它们在含血清的培养基中可增殖,在加入神经生长因子后细胞分化为交感神经元的形态[7],因此用PC12代替神经节细胞研究Nav1.7的功能及在疼痛中的作用。
该实验以PC12高分化细胞为实验材料。用不同浓度谷氨酸钠刺激细胞,建立细胞水平上的疼痛模型。作者用免疫荧光和RT-PCR的方法,检测不同浓度谷氨酸钠刺激后PC12细胞SCN9A基因和Nav1.7蛋白表达的变化,结果表明随着疼痛刺激强度的增加,Nav1.7的表达也随之增加。而谷氨酸钠与炎性痛、神经病理性痛均密切相关,提示Nav1.7在疼痛的发生发展中起重要作用,该研究结果为疼痛的治疗开辟了新的思路[8-10]。
[1]王云,杨勇,李颂.原发性红斑性肢痛症致病基因的定位及突变研究[J].中华皮肤科杂志, 2004, 37(7): 383
[2]Cox JJ, Reimann F, Nicholas AK, et al.An SCN9A channelopathy causes congenital inability to experience[J]. Nature, 2006,444(7121):894
[3]Lampert A, O’Reilly AO, Reeh P, et al.Sodium channelopathies and pain[J].Pflugers Arch, 2010,460(2):249
[4]Reimann F, Cox JJ,Belfer I, et al. Pain perception is altered by a nucleotide polymorphism in SCN9A[J]. Prco Natl Acad Sci USA, 2010,107(11):5148
[5]Nassar MA, Levato A, Wood JN. Neuropathic pain develops normally in mice lacking both Na(v)1.7 and Na(v)1.8[J]. Mol Pain, 2005, 1:24
[6]曹靖,王振全,任秀花,等.蛛网膜下腔移植APA-NIH3T3/rPENK对大鼠神经痛的镇痛效应[J]. 郑州大学学报:医学版, 2009,44(2):374
[7]Cox JJ, Sheynin J, Shorer Z, et al.Congenital insensitivity to pain: novel SCN9A missense and in-frame deletion mutations[J]. Hum Mutat, 2010, 31(9):E1670
[8]Wang W, Gu J, Li YQ, et al.Are voltage-gated sodium channels on the dorsal root ganglion involved in the development of neuropathic pain? [J].Mol Pain,2011,7:16
[9]Goss JR, Gold MS, Glorioso JC. HSV vector-mediated modification of primary nociceptor afferents: an approach to inhibit chronic pain[J]. Gene Ther, 2009,16(4):493
[10]刘艳红,张宏,徐龙河.大鼠骨癌痛模型的制备及电压依赖性钠通道Nav1.8在其背根神经节的表达研究[J].解放军医学杂志,2007,32(4):319
