食管鳞癌细胞中PTEN基因表达水平及突变位点分析*
2013-11-20侯桂琴贝维娟王琼叶鲁照明
侯桂琴,贝维娟,杨 帅,王琼叶,鲁照明#
1)郑州大学药学院临床药学系 郑州 450001 2)郑州大学第一附属医院消化科 郑州 450052
PTEN(phosphatase and tensine homolog deleted on chromosome 10)基因是迄今发现的第一个具有双磷酸酶活性的抑癌基因,定位于染色体10[1],通过双磷酸酶活性对多条细胞信号转导通路进行去磷酸化调节,从而实现对细胞生长的负调控。它的主要功能是诱导细胞凋亡,抑制细胞生长、迁移和黏附以及参与胚胎正常发育和维护免疫系统稳定性[2-3]。PTEN在很多肿瘤组织中缺失或低表达,尤其在子宫内膜癌、前列腺癌、神经胶质母细胞瘤和黑色素瘤等恶性肿瘤组织中突变率较高[4-5]。PTEN基因的突变、失活与肿瘤的发生发展密切相关[4,6]。食管鳞癌是最常见的恶性肿瘤之一,有报道[7]证实食管鳞癌组织中存在PTEN缺失或低表达。作者采用RT-PCR方法检测了EC9706、Eca109和EC1等3种食管鳞癌细胞株细胞中PTEN mRNA的表达水平,然后从这3株细胞中克隆出PTEN基因全长并分析其突变位点,为探讨PTEN在食管鳞癌发生发展中的作用及食管鳞癌的基因诊断和治疗提供实验基础。
1 材料与方法
1.1细胞和主要试剂EC9706购自上海中科院细胞库,EC1、Eca109及大肠杆菌JM109由课题组长期保存;RPMI 1640培养基、胰蛋白酶及胎牛血清购自Gibco公司;pcDNA3.1(+)载体购自Invitrogen公司;pMD18-T载体、BamHⅠ、HindⅢ、一步法RNA PCR试剂盒、Taq酶、dNTP、DNA Marker、胶回收试剂盒和质粒提取试剂盒均购自大连宝生物公司;反转录试剂盒购自上海生工生物工程技术服务有限公司。
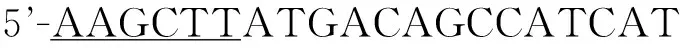
1.3细胞培养3种细胞均用含体积分数10%的胎牛血清、100 U/mL青霉素、100 mg/L链霉素的RPMI 1640培养液,于37 ℃、体积分数5% CO2及饱和湿度条件下培养,取对数生长期细胞用于实验。
1.4PTENmRNA的RT-PCR检测用Trizol试剂提取细胞总RNA,用紫外分光光度计测定RNA纯度,用甲醛变性的琼脂糖凝胶电泳鉴定RNA完整性。将总RNA用反转录试剂盒反转录成cDNA,利用PTEN检测引物行PCR。PCR反应体系25 μL,其中含cDNA 0.5 μL,上、下游引物各0.25 μL,Taq酶0.2 μL,dNTP 2 μL,10×buffer 2.5 μL。扩增条件:95 ℃ 2 min;95 ℃ 30 s,52 ℃ 30 s,72 ℃ 1 min,共30个循环;最后72 ℃延伸5 min,4 ℃终止。取5 μL产物进行琼脂糖凝胶电泳。实验重复3次。采用BandScan 5.0对电泳条带进行灰度分析,以目的基因与内参条带灰度值的比值表示目的基因mRNA的表达水平。
1.5PTEN全基因序列的扩增提取细胞总RNA,采用一步法RNA PCR试剂盒,按照操作说明扩增细胞中PTEN全基因序列。PCR扩增条件: 50 ℃ 30 min,94 ℃ 2 min;94 ℃ 30 s,52 ℃ 30 s,72 ℃ 6 min,共35 个循环;72 ℃延伸10 min,4 ℃终止。取 5 μL PCR产物进行琼脂糖凝胶电泳检测。
1.6PTEN基因突变位点的分析用10 g/L琼脂糖凝胶电泳回收全基因序列扩增的目的片段,与pMD18-T 载体16 ℃连接过夜,构建重组质粒pMD18-PTEN。将重组质粒转化感受态JM109受体菌,然后将其涂布于含50 mg/L氨苄西林(Amp) 的LB琼脂平板,37 ℃培养14~16 h。从平板上随机挑取白色菌落,接种于含Amp的LB液体培养基中,37 ℃振荡过夜培养。提质粒,HindⅢ和BamHⅠ 37 ℃双酶切。把酶切鉴定正确的质粒送生物公司测序。将测序结果与GenBank上野生型PTEN基因序列进行比对,分析突变位点。为了减少误差,每个质粒同时分别送3家公司测序,将两家以上公司测出的共同突变点作为基因突变位点。
1.7统计学处理采用SPSS 10.0处理数据。3株细胞中PTEN mRNA表达水平的比较采用单因素方差分析及LSD-t检验,检验水准α=0.05。
2 结果
2.1 3株食管鳞癌细胞中PTENmRNA的表达水平提取的总RNA经琼脂糖电泳显示18S、28S两条带(图1),紫外分光光度计测定A(260 nm)/A(280 nm)>1.8,说明RNA的纯度和完整性符合PCR要求。RT-PCR结果(图2)显示,EC1、EC9706、Eca109细胞中PTEN mRNA 的表达水平分别为(0.06±0.02)、(0.24±0.02)、(0.41±0.01),3株细胞中PTEN mRNA的表达水平差异有统计学意义(F=306.330,P<0.001),Eca109细胞中PTEN mRNA的表达水平高于EC9706和EC1细胞(P<0.05)。
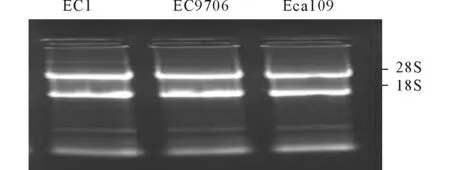
图1 3株细胞总RNA提取结果
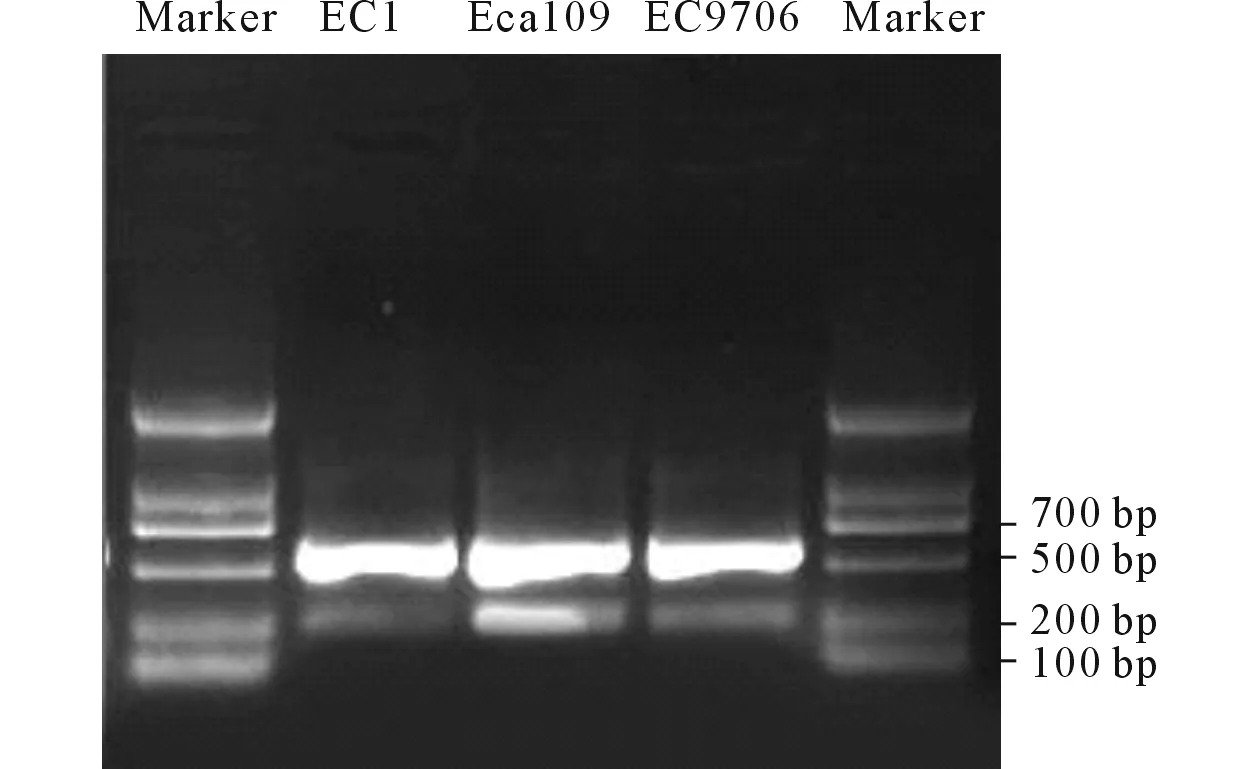
图2 3株细胞中PTEN mRNA的表达
2.2PTEN全基因序列扩增结果采用一步法RNA PCR试剂盒扩增PTEN基因,经过琼脂糖凝胶电泳(图3),可在1 500 bp附近见到一清晰的条带。

图3 3株细胞中PTEN全基因PCR扩增结果
2.3 3株食管鳞癌细胞中PTEN基因突变位点分析将重组质粒pMD18-PTEN转入感受态细菌JM109后,进行蓝白斑筛选,挑取白色菌落,扩大培养,提取质粒,进行双酶切鉴定,可以观察到1 500 bp和3 000 bp附近各有一条清晰的条带(图4)。将测序结果与野生型PTEN基因序列比对,找出从起始密码子(ATG)开始到终止密码子(TGA)间的突变,即编码区的突变。3株细胞的突变位点见表1~3。
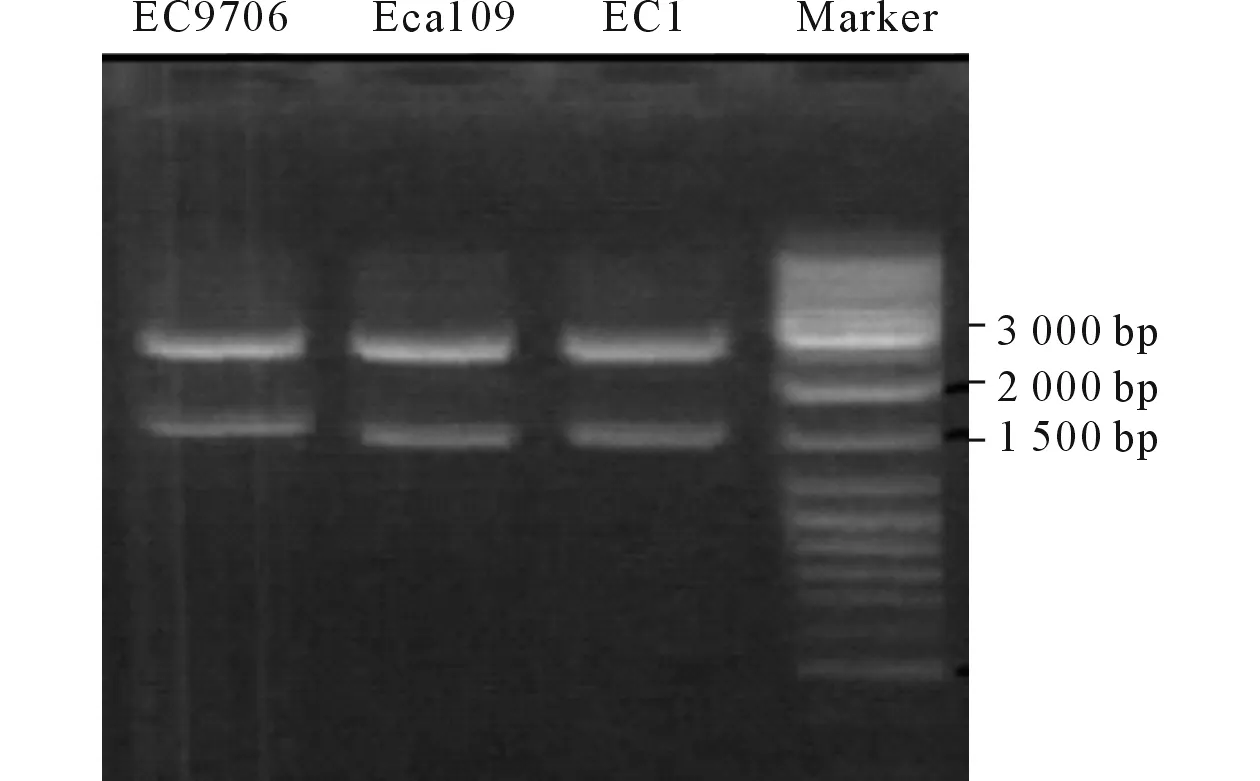
图4 重组质粒的双酶切鉴定结果

表1 EC9706细胞PTEN基因突变分析

表2 Eca109细胞PTEN基因突变分析

表3 EC1细胞PTEN基因突变分析
3 讨论
PTEN基因是1997年发现的第一个具有双特异性磷酸酶活性的抑癌基因,该基因包含9个外显子和8个内含子[1-2]。PTEN cDNA编码的蛋白由403个氨基酸组成,相对分子质量约55 000[1-2]。PTEN蛋白有两个比较重要的结构域:C端磷酸酶结构域和N端磷酸酶结构域。C端结构域包含蛋白质酪氨酸磷酸酶(PTP)催化区,它的结构与双特异性磷酸酶相似,可使 3, 4, 5-三磷酸磷脂酰肌醇(PIP3) 和局部黏附激酶(FAK) 去磷酸化,从而诱导细胞凋亡[2,8]。N端结构域与细胞骨架蛋白tensine和auxilin高度同源,这一特点在维持细胞结构和调控信号转导中起到了重要作用。因此PTEN的主要作用为:抑制细胞的迁移、延伸和局部黏附;参与胚胎正常发育,通过阻滞细胞于G1期或诱导细胞凋亡,抑制细胞的生长及端粒酶活性等[9]。
许多研究证实PTEN mRNA表达随细胞分化程度降低而降低。Zainuddin等[10]报道影响PTEN mRNA表达的因素复杂,一方面各种转录因子活性可对PTEN mRNA的转录产生影响,另一方面PTEN 5’端的非翻译序列也可影响其转录,此外5’端CPG岛甲基化可封闭转录。Weng等[11]报道,通过对前列腺癌细胞的去甲基化可以恢复PTEN mRNA 的表达水平,由此得出启动子区的甲基化可能是PTEN表达降低或缺失的原因之一。作者的检测结果也显示,高分化的Eca109细胞PTEN mRNA的表达水平明显高于其他两种低分化食管鳞癌细胞EC9706和EC1,说明在食管鳞癌细胞中,PTEN mRNA的表达与肿瘤的分化程度相关,其表达水平随着分化程度的降低而降低,但其机制还有待进一步研究。
PTEN是继p53基因之后,又一个突变率高且与肿瘤发生有密切关系的抑癌基因。目前已发现PTEN基因在多种肿瘤中存在突变,如乳癌、前列腺癌、子宫内膜癌、神经胶质瘤、黑色素瘤、肺癌、肾癌、肝癌等[5, 12-13]。PTEN基因一旦发生突变,其磷酸酶活性就会显著降低,从而失去对细胞生长的负调控,使得肿瘤细胞增殖能力增强[14]。作者的研究结果显示,从3株食管鳞癌细胞中克隆出的PTEN基因均存在外显子的突变,且突变均为错义突变或无义突变。EC9706细胞PTEN基因突变出现在第2、5、6、8外显子,其中第5和第8外显子各出现两处突变;而Eca109细胞PTEN基因突变出现在第5、8和9外显子;EC1细胞PTEN基因突变出现在第6、8、9外显子。研究结果证实在食管鳞癌细胞中PTEN基因突变位点多出现在第5、8外显子,这与国外报道的PTEN在其他肿瘤中的突变热点集中在第5、8外显子基本相符[15]。
综上所述,作者推测PTEN基因突变在食管鳞癌的发生中起着重要的作用。今后作者将进一步通过定位突变技术,对食管鳞癌细胞中PTEN基因突变进行深入研究,以了解PTEN基因突变尤其是热点突变如何具体影响其编码蛋白的结构和功能,从而探讨PTEN突变在食管鳞癌发生中的具体作用。
[1]Steck PA,Pershouse MA,Jasser SA,et al.Identification of a candidate tumour suppressor gene, MMAC1, at chromosome 10q23.3 that is mutated in multiple advanced cancer[J].Nat Genet,1997,15(4):356
[2]Song MS,Salmena L,Pandolfi PP.The functions and regulation of the PTEN tumour suppressor[J].Nat Rev Mol Cell Biol,2012,13(5):283
[3]李季林,肖建,于如同.肿瘤抑制基因 PTEN研究新进展[J].现代肿瘤医学,2010,18(5):1034
[4]王金湖,鞠少卿,王惠民.抑癌基因PTEN与人类肿瘤的研究进展[J].现代检验医学杂志,2003,18(1):57
[5]Aguissa-Touré AH,Li G.Genetic alterations of PTEN in human melanoma[J].Cell Mol Life Sci,2012,69(9):1475
[6]Simpson L,Parsons R.PTEN:life as a tumor suppressor[J].Exp Cell Res,2001,264(1):29
[7]黄绮国,倪仰鹏,陈蔓,等.食管鳞癌组织中PTEN的表达及其临床意义[J].中国实用医药,2010,5(15):34
[8]Mayers MP,Pass I,Batty IH,et al.The lipid phosphatase activity of PTEN is critical for its tumor supressor function[J].Proc Natl Acad Sci USA,1998,95(23):13513
[9]Alexiou GA,Voulgaris S.The role of the PTEN gene in malignant gliomas[J].Neurol Neurochir Pol,2010,44(1):80
[10]Zainuddin N,Jaafar H,Isa MN,et al.Malignant glioma:the involvement of loss of allelic heterozygosity and PTEN mutations in a group of Malay patients[J].Southeast Asian J Trop Med Public Health,2005,36(3):748
[11]Weng L,Brown J,Eng C.PTEN induced apoptosis and cell cycle arrest through phosphoinositol-3-kinase/Akt-dependent pathways[J].Hum Mol Genet,2001,10(3):237
[12]Koul D.PTEN signaling pathways in glioblastoma[J].Cancer Biol Ther,2008,7(9):1321
[13]徐寿水,沈文律.转PTEN基因对人结肠癌细胞的抑制作用[J].肿瘤防治研究,2005,32(4):202
[14]Liu W,Zhou Y,Reske SN,et al.PTEN mutation:many birds with one stone in tumorigenesis[J].Anticancer Res,2008,28(6A):3613
[15]Wang SI,Puc J,Li J,et al.Somatic mutations of PTEN in glioblastoma multiforme[J].Cancer Res,1997,57(19):4183
