原核表达重组牛凝乳酶原及重组牛凝乳酶酶学特性*
2013-11-19普燕李轶杰张富春
普燕,李轶杰,张富春
(新疆生物资源基因工程重点实验室,新疆大学生命科学与技术学院,新疆乌鲁木齐,830046)
凝乳酶是制造干酪过程中起凝乳作用的关键性酶,对干酪的质构及干酪特有风味的形成有非常重要的作用。它存在于未断奶的哺乳动物胃中,能够专一性裂解κ-酪蛋白多肽链105~106位的苯丙氨酸和甲硫氨酸之间的肽键[1-3],使得酪蛋白沉淀凝聚,乳清排出。凝乳酶的传统来源是吃奶的小牛皱胃(第四胃),可用来制作各种类型的干酪,也是衡量其他凝乳酶代用品的标准。随着世界范围内干酪市场需求的日益增长,来源于小牛皱胃的凝乳酶制剂难以满足干酪制作的需求量,人们开始寻找小牛凝乳酶替代品。凝乳酶按来源分为动物凝乳酶、植物凝乳酶、微生物凝乳酶以及基因工程凝乳酶。但植物蛋白酶受到时间与地域限制,不能大规模获得;微生物凝乳酶对蛋白质分解能力比皱胃酶高,干酪得率低,成熟后味苦,耐热性高,给乳清的利用带来不便;其他动物来源的凝乳酶虽能替代部分小牛凝乳酶制作干酪,但也存在来源不稳定,酶稳定性差或凝乳活性低等问题。目前仍然认为,小牛凝乳酶是最佳的干酪制作凝乳酶,因此基因工程成为解决凝乳酶制剂需求量的新途径,目前已成功获得牛[4-5]、水牛[6]、山羊[7]和单峰驼[8]等多种动物的基因工程重组凝乳酶。研究表明,基因工程凝乳酶与天然小牛皱胃酶几乎完全相同,酶学特性没有明显差异[9]。此外,重组牛凝乳酶产品的纯度高,含100%凝乳酶(小牛胃萃取液仅含70% ~90%凝乳酶)[10],所制造的干酪在收率与品质上也优于小牛胃凝乳酶制造的干酪。
本研究结合乳酸菌和大肠杆菌密码子的偏爱性合成了凝乳酶原基因,实现了凝乳酶原在大肠杆菌的高效表达。表达产物经包涵体纯化后,通过复性处理获得大量较高纯度的重组凝乳酶酶原,对其进行酸化/中和处理,获得具有活性的凝乳酶,并研究了凝乳酶的酶学特性,旨在为凝乳酶的工业化生产提供高效表达的菌种。
1 材料与方法
1.1 材料
1.1.1 菌种和质粒
大肠杆菌E.coliDH5α,E.coliBL21(DE3)、表达载体pET30a、含有牛凝乳酶原序列的质粒pGEX-4T-1-pCHY[11]为本实验室保存;密码子优化的牛凝乳酶原序列由上海生工(上海)有限公司合成,序列如下:
GAATTCGCTGAAATCACTCGTATCCCACTTTACAAAGGTAAATCACTTCGTAAAGCTCTTAAAGAACACGGTTTGCTTGAAGACTTCCTTCAAAAACAGCAATACGGTATCTCATCAAAATACTCAGGTTTCGGTGAAGTTGCTTCAGTTCCACTTACTAACTACCTTGATTCACAATACTTCGGTAAAATCTACCTTGGTACTCCACCACAAGAATTTACTGTTCTTTTCGATACTGGTTCATCAGATTTCTGGGTTCCATCAATCTACTGTAAATCAAACGCTTGTAAAAACCACCAACGTTTCGATCCACGTAAATCATCAACTTTCCAAAACCTTGGTAAACCACTTTCAATCCACTACGGTACTGGTTCAATGCAAGGTATCCTTGGTTACGATACTGTTACTGTTTCAAACATCGTTGATATCCAACAAACAGTAGGTTTGAGCACTCAAGAACCAGGTGATGTTTTCACTTACGCT-GAATTTGATGGTATCCTTGGTATGGCTTACCCATCACTTGCTTCAGAATACTCAATCCCAGTTTTCGATAACATGATGAACCGTCACCTTGTTGCGCAGGACTTGTTCAGCGTCTACATGGACCGTAACGGTCAAGAATCAATGCTTACTCTTGGTGCTATCAACCCATCATACTACACTGGTTCACTTCACTGGGTTCCAGTTACTGTTCAACAATACTGGCAATTCACTGTTGATTCAGTTACTATCTCAGGTGTTGTTGTTGCTTGTGAAGGTGGTTGTCAAGCTATCCTTGATACTGGTACTTCAAAACTTGTTGGTCCATCATCAGATATCCTTAACATCCAACAAGCTATCGGTGCTACTCAAAACCAATACGGTGAATTTGATATCGATTGTGATAACCTTTCATACATGCCAACTGTTGTTTTCGAAATCAACGGTAAAATGTACCCACTTACTCCATCAGCTTACACTTCACAAGATCAAGGTTTCTGTACTTCAGGTTTCCAATCAGAAAACCACTCACAAAAATGGATCTTAGGTGATGTTTTCATCCGTGAATACTACTCAGTTTTCGATCGTGCTAACAACCTTGTTGGTCTTGCTAAAGCTATCCTCGAGTAATCTAGA
1.1.2 试剂和培养基
核酸限制性内切酶和DNA Marker,大连宝生物工程有限公司;T4DNA连接酶,北京全式金生物技术有限公司;蛋白Marker,北京康为世纪生物科技有限公司和大连宝生物工程有限公司;胶回收试剂盒,北京天根试剂公司;卡那霉素,上海生工有限公司;商品重组凝乳酶(CHY-MAX○Rpowder Extra NB),丹麦科汉森公司;其他试剂为国产分析纯。
1.2 实验方法
1.2.1 大肠杆菌表达载体的构建与鉴定
将 pGEX-4T-1-pCHY[11]和 pET30a 质粒分别用EcoR I和XhoI酶切后,将载体pET30a与基因片段prochymosin连接并转化E.coliDH5α,提取质粒酶切鉴定后送上海生工公司测序,测序正确的重组质粒命名为pET30a-pCHY,并转化E.coliBL21(DE3),获得重组菌E.coliBL21(pET30a-pCHY)。
1.2.2 重组凝乳酶原基因诱导表达条件的优化
挑取表达重组凝乳酶原的阳性菌落,接种于5 mL新鲜含有卡那霉素(50 mg/L)的LB培养基37℃振荡培养过夜。次日,按1% 的接种量接至新鲜含有卡那霉素LB培养基中,当OD600达到0.6~0.8时:(1)加入终浓度为 0.005、0.01、0.02、0.05、0.08、0.1、0.2、0.3 mmol/L的异丙基硫代半乳糖苷(IPTG),37℃诱导表达4 h,离心收集菌体,用PBS洗涤后进行全菌蛋白SDS-PAGE电泳,观察蛋白表达情况,得出最优的IPTG添加量;(2)加入终浓度为0.02 mmol/L的异丙基硫代半乳糖苷(IPTG),37℃诱导表达 1、2、3、4、5、6、8、12 h,离心收集菌体,用 PBS洗涤后进行全菌蛋白SDS-PAGE电泳,观察蛋白表达情况,得出最优的收获菌体时间。
1.2.3 重组凝乳酶原大量表达与凝乳酶的初步纯化
诱导表达1 L菌液,8 000 r/min离心1 min后除去培养基上清液,菌体沉淀用20 mL PBS洗涤3次,加18 mL细胞裂解液(50 mmol/L Tris-HCl,2 mmol/L EDTA,pH 8.0),2 mL 10%Triton X-100,苯甲基磺酰氟(PMSF)至终浓度为1 mmol/L及添加溶菌酶至终浓度1 mg/mL,冰浴30 min,超声至菌液不再黏稠。12 000 r/min离心20 min,弃去上清液,沉淀加20 mL细胞裂解液和2 mL 2%脱氧胆酸,冰浴30 min,期间不断搅拌。12 000 r/min离心15 min,弃去上清液,重复洗涤3次。加6 mol/L尿素溶解包涵体,12 000 r/min离心去除不溶杂质,将溶液装入透析袋中,放入约50倍体积的透析液(20 mmol/L Tris-HCl,1 mmol/L EDTA,pH8.0)中透析,每12 h换一次尿素含量从高向低逐级递减的透析液,最后用不含尿素的透析液透析3次,12 000 r/min离心20 min,上清液分装保存。
将获得的重组凝乳酶原用1 mol/L HCl调pH到2.0,室温放置2 h,再用1.5 mol/L Tris回调 pH到6.0。此时出现大量絮状沉淀,将此液于12 000 r/min离心10 min,上清液中只含有活化的凝乳酶与his标签融合的酶原N端释放肽段,此即为初步纯化的凝乳酶。商品重组凝乳酶作为对照,用蒸馏水按1∶20(w/v)配制后进行相关测定。
1.2.4 重组凝乳酶活性测定
采用阮小华等[12]方法,略有修改。取 10 mL 10%的脱脂乳(用0.01 mol/L CaCl2配制),在35℃下保温5 min,加入0.5 mL初步纯化的凝乳酶液,迅速混合均匀,直到在管壁上观察到凝乳颗粒,准确记录从加入酶液到乳液凝固的时间(s),把40 min凝固1 mL 10%的脱脂乳定义为1个索氏单位(soxhlet unit)。

式中:t为乳液凝固时间,s;D为酶液稀释倍数。
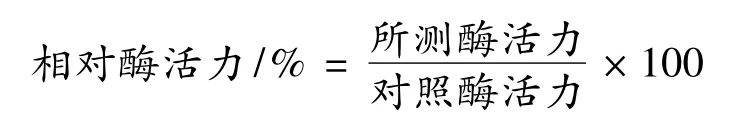
1.2.5 凝乳酶作用最适温度的测定
采用李玉秋等[13]方法。将酶反应体系在20、22、25、27、30、32、35、37、40、42、45、47、50、52、55、57、60、62、65、67、70℃下检测重组凝乳酶的活力,将最高的酶活力定义为100%,分别计算不同温度下凝乳酶的相对酶活力,商品重组凝乳酶作为对照,实验重复3次。
1.2.6 凝乳酶的热稳定性
采用李玉秋等[13]的方法,略有改动。将酶液分装于试管中,分别在 35、40、45、50、55 ℃水浴中温育,每隔10 min取样(55℃每隔2 min取样),迅速冰浴冷却。在35℃下测定残余重组凝乳酶的活力,将未处理酶活力定义为100%,分别计算不同温度条件下凝乳酶的相对酶活力。商品重组凝乳酶作为对照,实验重复3次。
1.2.7 凝乳酶作用的最适pH值
采用阮小华等[12]的方法,略有改动。用浓度为2 mol/L HCl和2 mol/L NaOH将10%脱脂乳的pH调到 5.0、6.0、7.0、8.0、9.0,在 35℃ 水浴中温育 5 min,进行酶活力的测定,将最高的酶活力定义为100%,分别计算不同pH乳液中凝乳酶的相对酶活力。商品重组凝乳酶作为对照,实验重复3次。
1.2.8 凝乳酶的pH稳定性
采用阮小华等[12]的方法,略有改动。用浓度为0.2 mol/L的 HCl和0.2 mol/L的NaOH将酶液的pH 调到 2.0、3.0、4.0、5.0、6.0、7.0、8.0,在冰上放置2 h,将酶液pH回调到6.0,测定酶活,比较未处理的酶活力计算相对酶活。商品重组凝乳酶作为对照,实验重复3次。
1.2.9 金属离子对酶活的影响
采用Jiang等[5]的方法,略有改动。将酶液中添加 NH4Cl、KCl、NaCl、AlCl3、FeCl3、CaCl2、ZnSO4、MgCl2、CuSO4、NiCl2的水溶液,使金属离子终浓度达到10 mmol/L,4℃放置2 h测定酶活,比较未处理的酶活力计算相对酶活。商品重组凝乳酶作为对照,实验重复3次。
1.2.10 蛋白酶抑制剂对酶活力的影响
采用姜媛媛等[14-15]方法,略有改动。将胃蛋白酶抑制剂pepstatin A和苯甲基磺酰氟(PMSF)配制成储存浓度,按一定量加入酶液中混匀,放37℃下温育1 h和24 h,同时做空白对照(不加任何蛋白酶抑制剂)。商品酶按1∶10(g∶mL)配制并进行相同处理。在35℃下测定残余酶活力。将空白对照酶液的酶活力定义为100%,分别计算不同处理条件酶液的相对活力。
2 结果
2.1 表达载体pET30a-pCHY的构建与重组牛凝乳酶原诱导表达条件的优化
表达载体pET30a-pCHY经EcoR I和XhoI酶切鉴定,得到约1.1 kb的片段,与理论值大小相符,测序结果与合成序列完全一致,表明表达载体pET30apCHY构建成功。将重组质粒转化BL21(DE3)进行重组蛋白表达。通过添加不同的IPTG浓度及在不同的诱导时间取样,我们观察到添加IPTG诱导后,在47 kDa左右出现与理论值相符的目的蛋白,即牛凝乳酶原,同时在37℃,220 r/min条件下,最佳的诱导表达条件为:IPTG添加终浓度为0.02 mmol/L,诱导时间为4 h(见图1)。
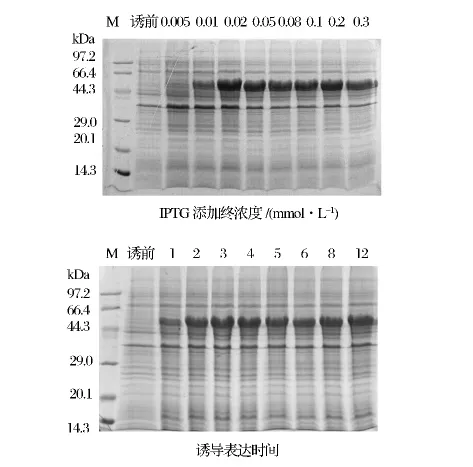
图1 重组蛋白表达条件的优化Fig.1 Optimization of the recombinant protein expression
2.2 重组菌株的诱导表达与初步纯化
将转化pET30a-pCHY重组质粒的E.coliBL21(DE3)按1%接种1 L新鲜卡那霉素抗性的LB培养基,诱导表达重组蛋白。诱导前和诱导后全菌菌体分别留样,其余培养物离心收集菌体,用PBS洗净菌体沉淀后超声裂解至菌液不再黏稠,对菌裂解上清液和菌裂解沉淀、包涵体悬液、尿素溶解包涵体及透析蛋白分别取样进行SDS-PAGE检测。如图2所示,目的蛋白为包涵体形式表达,用凝胶图像分析软件band-scan5.0分析,目的蛋白表达量占总菌蛋白的66.3%,包涵体的复性率达83.2%,通过计算,1 L新鲜的LB培养基可以最终获得目的蛋白约200 mg。

图2 重组蛋白表达检测Fig.2 Detection of the recombinant protein expression
2.3 重组牛凝乳酶原活化及凝乳活性检测
透析复性的重组蛋白经过酸化/中和处理,取处理前和处理后样品进行SDS-PAGE电泳检测。由图3可以看出,与处理前的蛋白相比,经酸化/中和处理后,47 kDa左右处的条带消失,在37 kDa与10 kDa处出现了新的特征性条带,其中37 kDa处条带与理论成熟凝乳酶(36.5 kDa)大小相近,10 kDa与his标签融合凝乳酶原N端释放肽段大小相符,表明初步纯化出的凝乳酶原保留自剪切功能活性。
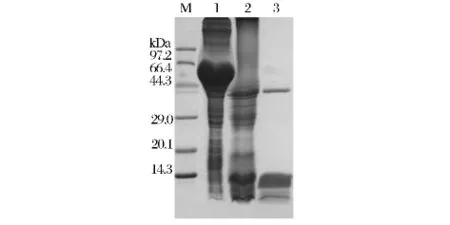
图3 重组牛凝乳酶原的活化Fig.3 Activation of the recombinant bovine prochymosin
继续进行凝乳酶活性检测,在10%脱脂乳(含0.01 mol/L CaCl2)中加入活化的重组凝乳酶,乳液凝固,而未加酶的对照脱脂乳不凝,说明重组凝乳酶有凝乳活性。将重组凝乳酶原和凝乳酶分别进行冻干并复水,均保留原有活性,且计算得出冻干凝乳酶活力达到600 000 SU/g。从图3中观察到,酸化/中和处理后的凝乳酶液中含有较多的杂蛋白,经过12 000 r/min离心10 min处理,可以得到仅含有凝乳酶和his标签融合凝乳酶原N端释放肽段的酶液(第3泳道),用该方法可初步纯化凝乳酶,用于后续酶学特性实验。
2.4 重组牛凝乳酶酶学特性分析
2.4.1 重组酶的最适作用温度
从图4可以看出,原核表达重组凝乳酶与商品凝乳酶反应体系最适凝乳温度在57~62℃,反应体系高于65℃,凝乳活性迅速下降。
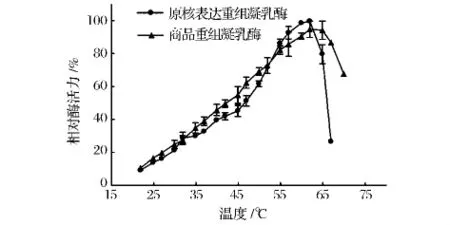
图4 重组牛凝乳酶的最适作用温度Fig.4 The optimum activity temperature of the recombinant chymosin
2.4.2 重组酶的最适作用pH值
从图5可以看出,原核表达重组凝乳酶与商品凝乳酶均随酶反应体系pH值增高,凝乳活力下降。pH大于8时,凝乳活性完全丧失。
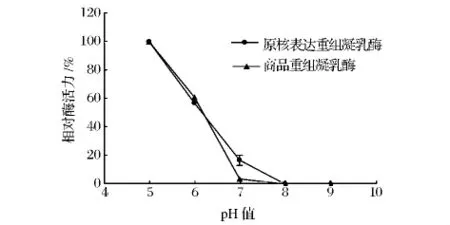
图5 重组酶的最适作用pHFig.5 The optimum activity pH of the recombinant chymosin
2.4.3 重组酶的热稳定性
由图6看出,原核表达重组凝乳酶与商品凝乳酶在35℃和40℃中放置1 h,酶活力保持良好,随着温度的增加,酶活力出现明显的下降趋势,商品凝乳酶较原核表达重组酶更为明显。温度达55℃时,两者在短时间酶活丧失。

图6 重组凝乳酶的热稳定性Fig.6 The thermal stability of the recombinant chymosin
2.4.4 重组酶的pH稳定性
如图7所示,原核表达重组凝乳酶与商品重组凝乳酶在pH 2~7,酶活稳定,保持在85%以上,当pH值大于7时,酶迅速失活。
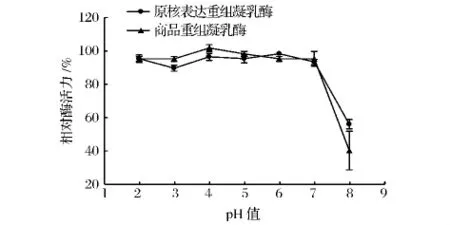
图7 重组凝乳酶的pH稳定性Fig.7 The pH stability of the recombinant chymosin
2.4.5 金属离子对酶活的影响
从图8可以看出,Al3+、Fe3+和Cu2+对原核表达酶活力有增强作用,比较未处理组的酶活,相对酶活力达到150%、130%、128%;但这3种离子作用的商品酶活力分别为106%、78%、94%,即除了Al3+对商品酶活力作用为增强之外,Fe3+和Cu2+对其酶活有抑制作用。其次Zn2+对二者的作用也不同,相对酶活分别为105%和93%。其他离子中,Ni2+对两者酶活均有明显抑制作用,NH4+、K+、Na+、Ca2+、Mg2+对酶活作用不明显。
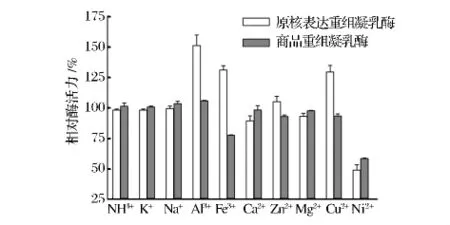
图8 金属离子对酶活的影响Fig.8 The effect of metal ions on enzyme activity
2.4.6 酶活性抑制实验
利用1 μmol/L和25 μmol/L的 pepstatin A 对酶活进行抑制效果分析(图9,图10)。37℃处理1 h,原核表达重组凝乳酶活力下降10%和38%,商品凝乳酶活力下降15%和46%;37℃处理24 h,原核表达重组凝乳酶活力下降26%和53%,商品凝乳酶活力下降32%和44%。在对照实验中,加入PMSF 1 000 μmol/L和5 000 μmol/L均没有观察到对酶活的抑制作用。
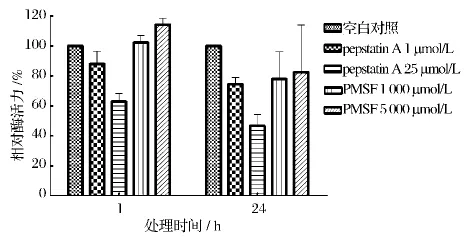
图9 蛋白酶抑制剂对重组凝乳酶的活性抑制作用Fig.9 The inhibition effect of the protease inhibitor on recombinant chymosin activity

图10 蛋白酶抑制剂对商品凝乳酶的活性抑制作用Fig.10 The inhibition effect of the protease inhibitor on commercial chymosin activity
3 讨论
凝乳酶是制作酶凝干酪的关键性酶,凝乳酶品质决定了干酪的出品率与质地。传统来源于小牛皱胃的凝乳酶制剂已经不能满足日益增长干酪制作的需求,需要寻找小牛凝乳酶的替代品。基因重组凝乳酶因其产量高、来源稳定、品质与天然凝乳酶相同、价格低廉而广泛用于干酪制作。虽然已经有许多国家用基因工程的方法生产重组凝乳酶并进行干酪制作,但我国凝乳酶制剂主要依赖进口,这对我国的干酪工业发展极为不利。
通过人工合成原核密码子优化的凝乳酶原基因,在大肠杆菌中获得大量表达,凝乳酶原经酸化/中和处理,凝乳酶活力达600 000 SU/g。但在酸化/中和处理时,当pH值从2.0回调至6.0时,出现大量沉淀,这与张俊瑞[16]等报道的相同,可能原因是由于在体外复性过程中仅部分凝乳酶原能完成正确折叠进而实现自我催化,而未正确折叠的重组蛋白则在酸化/中和的过程中以沉淀形式析出。大肠杆菌表达系统虽然能高效表达重组蛋白,但多以包涵体形式表达,需要溶解与复性过程,因而很多学者致力于提高包涵体的复性率研究。中国科学院微生物所的杨开宇[17]等人,在其发明专利中采用优化的溶解包涵体及再折叠的工艺,可使复性率达到50%左右。唐兵[18]对蛋白质二硫键异构酶(PDI)与GSH/GSSG促进重组凝乳酶原复性进行了比较,发现二硫键的错误配对是影响凝乳酶原多肽链正确折叠的主要原因。以上两种提高包涵体复性率的方法中均使用了GSH/GSSG,本研究在包涵体复性过程中运用逐步降低尿素含量的透析方法,让酶原在缓慢去除尿素的过程中复性,依然得到大量高活性的凝乳酶,为后续凝乳酶的工业化生产提供了一条低成本的纯化选择。
本研究表达的重组凝乳酶最适作用温度为57~62℃,在pH 2~7、35~40℃范围内均比较稳定,酶学特性与商品酶完全相同。金属离子Al3+和Fe3+对酶活有增强作用,与Jiang等[5]人研究结果一致,但是关于Cu2+对酶活的作用效果截然相反。本研究表明Cu2+能够增强酶活,而在Jiang等人结果中,Cu2+对酶活是抑制作用,同时本研究中Cu2+对商品凝乳酶作用后也表现出酶活力的轻微下降。由于离子对酶的影响比较复杂,差异可能与处理条件、离子浓度与蛋白浓度的比例、表达系统及表达的重组凝乳酶修饰差别有关,具体原因需进一步研究。本研究进行酶学特性实验的酶液中混合有his标签融合的酶原释放肽段,该肽段的存在是否影响了酶活力及金属离子对酶活的作用也有待进一步探讨。抑制剂对原核表达的重组酶影响实验中,pepstatin A对酶活具有明显的抑制效果,37℃处理1 h为10%和40%;处理24 h为20%和50%。但抑制效果低于姜媛媛等[14-15]人的结果,推测原因可能是重组凝乳酶的浓度过高,抑制效果不佳。本研究用PMSF作为抑制剂,发现加入PMSF的酶活力比空白对照酶活力还高,可能是因为PMSF抑制了酶液中其它微量的酶,而这些酶可能对于凝乳酶活性有一定影响。总之,原核表达的重组凝乳酶在温度和pH方面的酶学特性与商品重组凝乳酶相似,同时表达获得的重组凝乳酶从酶活力和浓度方面有工业化生产的潜力,可为我国实现凝乳酶的工业化生产提供优良的潜在菌种。
[1] Jacob M,Jaros D,Rohm H.Recent advances in milk clotting enzymes[J].International Journal of Dairy Technology,2011,64(1):14 -33.
[2] Bansal N,Drake M A,Piraino P et al.Suitability of recombinant camel(camelus dromedarius)chymosin as a coagulant for cheddar cheese[J].International Dairy Journal,2009,19(9):510 -517.
[3] Moller K K,Rattray F P,Sorensen J C et al.Comparison of the hydrolysis of bovine κ-casein by camel and bovine chymosin:a kinetic and specificity study[J].Journal of agricultural and food chemistry,2012,60(21):5 454 -5 460.
[4] Jiang X P,Yin M L,Chen P et al.Constitutive expression,purification and characterization of bovine prochymosin inPichia pastorisGS115[J].World Journal of microbiology biotechnology,2012,28(5):2 087 -2 093.
[5] Feng Z,Zhang L W,Han X et al.Codon optimization of the calf prochymosin gene and its expression inKluyveromyces lactis[J].World Journal of Microbiology Biotechnology,2012,26(5):895 -901.
[6] Vallejo J A,Ageitos J M,Poza M et al.cloning and expression of buffalo active chymosin in Pichia pastoris[J].Journal of Agricultural and Food Chemistry,2008,56(22):10 606-10 610.
[7] Eskandari M H,Hosseini A,Zarasvand S A,et al.Cloning,Expression,Purification and Refolding of Caprine Prochymosin[J].Food Biotechnology,2012,26(2):143-153.
[8] Kappeler S R,van den Brink H M,Rahbek-Nielsen H,et al.Characterization of recombinant camel chymosin reveals superior properties for the coagulation of bovine and camel milk[J].Biochemical and Biophysical Research Communications,2006,342(2):647 -654.
[9] 高维东,甘伯中,丁福军,等.微生物凝乳酶的研究进展[J].中国乳品工业,2009,37(5):34 -36.
[10] Rogelj I,Perko B,Francky A et al.Recombinant lamb chymosin as an alternative coagulating enzyme in cheese production[J].Journal of Dairy Science,2001,84(5):1 020-1 026.
[11] 李新苹,刘欢欢,普燕,等.重组凝乳酶在大肠杆菌中的表达及活化研究[J].中国乳品工业,2011,39(9):14-16.
[12] 阮小华,冯玉萍,马忠仁,等.羔羊皱胃酶和微生物凝乳酶部分特性的探讨[J].家畜生态学报,2009,30(3):28-31.
[13] 李玉秋,王景会,李铁柱,等.重组牛凝乳酶的纯化及其酶学性质的研究[J].食品与发酵工业,2010,36(8):50-54.
[14] 姜媛媛,张莉,张健,等.重组凝乳酶的酶学特性研究[J].中国乳品工业,2009,37(10):4-6.
[15] Raposo S,Domingos A.Purification and characterization milk-clotting aspartic proteinases fromCentaurea calcitrapacell suspension cultures[J].Process Biochemistry,2008,43(2):139 -144.
[16] 张俊瑞,马夏吟,张红星,等.牛凝乳酶原基因在大肠杆菌中的高效表达及活性检测[J].中国乳品工业,2012,40(3):4 -6.
[17] 杨开宇,刘年娟,张渝英.提高重组牛凝乳酶原的表达与复性的方法[P].中国,95105337.X.1996-02-07.
[18] 唐兵.影响重组凝乳酶原再折叠的主要原因研究[J].武汉大学学报:自然科学版,1997,43(6):767-770.
