纳他霉素对葡萄采后灰霉病菌的毒力及其防腐保鲜效果*
2013-11-19郭萌萌李志文张平农绍庄刘莉刘翔
郭萌萌,李志文,张平,农绍庄,刘莉,刘翔
1(大连工业大学,食品学院,辽宁 大连,116000)
2(国家农产品保鲜工程技术研究中心(天津),天津市农产品采后生理与贮藏保鲜重点实验室,天津,300384)
3(天津大学,环境科学与工程学院,天津,300072)
灰霉病(gray mold)由灰葡萄孢(Botrytis cinerea)引起,可危害番茄、黄瓜、葡萄等作物,在果蔬贮藏期间可以导致其腐烂,降低品质。该菌在低温条件下(-0.5℃)仍能生长繁殖,而葡萄对其抵抗力较弱,因此必须采取相应防腐措施以免葡萄贮藏过程中受到病菌的侵害[1]。目前生产中常用的葡萄防腐手段主要为冷藏、窖藏及气调等物理方法和二氧化硫熏蒸、化学涂层及防腐剂等化学方法[2],然而广泛使用的SO2熏蒸法在葡萄采后的储藏过程中可造成香气成分减少或不良气味的增加等影响[3]。
纳他霉素作为多烯类大环内酯类抗生素的一种,可通过直接抑制氨基酸和葡萄糖的跨膜运输达到抑制真菌生长的效果[4],在很低的浓度下就具有有效的抑制作用,是一种高效、广谱的真菌抑制剂,且对动物细胞的毒性极低。因此,纳他霉素目前已应用于多类食品的防腐保鲜中,但在葡萄等果蔬的防腐保鲜方面的研究较少,而关于采前纳他霉素处理对果蔬采后防腐保鲜作用的研究更是鲜有报道。本研究以传统食品防腐剂山梨酸钾为对照,测定纳他霉素抑菌液对葡萄采后灰霉菌抑制毒力,分析采前纳他霉素处理对采后葡萄贮藏过程中品质及代谢生理指标的作用效果,从而为葡萄采后生物保鲜提供理论依据。
1 材料与方法
1.1 实验材料
纳他霉素95%原粉,由北京东方瑞德生物技术公司提供。灰霉菌由采后腐烂葡萄上分离纯化得到(本实验室分离得到)。供试葡萄品种为“玫瑰香”,于2012年9月23日在天津汉沽茶淀葡萄园选择无腐烂、无落粒和无机械伤的果实进行采前浸果处理,于9月24日运回国家农产品保鲜工程技术研究中心(天津)进行贮藏试验。
1.2 实验方法
1.2.1 处理方法
1.2.1.1 离体抑菌液处理
(1)不同浓度纳他霉素抑菌液:精确配制质量浓度为1 g/L的纳他霉素0.1%柠檬酸抑菌液,再将其以0.1%的柠檬酸稀释至质量浓度0.5、0.25、0.1、0.05、0.025 g/L。
(2)不同浓度山梨酸钾抑菌液:精确配制质量浓度为10 g/L的山梨酸钾20%乙醇抑菌液,再将其以20%乙醇稀释至质量浓度 5、2.5、1、0.5、0.25 g/L。
(3)对照溶液:CKA:0.1%的柠檬酸溶液;CKB:20%乙醇。
1.2.1.2 采前抑菌液处理
葡萄采收前1天晴天的早上8点开始,选择树势一致、尽量处于树体同一位置及无腐烂无霉变无机械损伤和相同成熟度的果实进行浸果试验,参考纳他霉素和山梨酸钾抑制灰霉菌的EC50值分别选取浓度为0.5 g/L的纳他霉素抑菌液及5 g/L的山梨酸钾抑菌液,并将配制好的抑菌液倒入相同容积的容器中,然后将整串葡萄浸入药剂当中,计时1 min,保证果穗均匀浸药,分别以不同颜色的彩带标记不同浓度处理,以未进行浸果处理的果实作为对照(CK)。
1.2.1.3 贮藏试验
将处理过的果实采收后运回国家农产品保鲜工程技术研究中心,在保鲜库[0±0.5)℃]中预冷24 h,再称取2.5 kg/袋小心放入PE保鲜袋(国家农产品保鲜工程技术研究中心提供)中,然后整齐放入可周转塑料果实包装箱中,每箱放1袋,最后将其放入保鲜库[(0±0.5)℃]中进行贮藏。每20 d各处理取出3箱果实,随机取样调查,进行相关指标测试。
1.2.2 测定项目与方法
1.2.2.1 病原菌的纯化与鉴定
供试菌种于2012年9月23日采自天津汉沽茶淀葡萄园发病的葡萄果实。病果分装于洁净纸质样品袋中,防止污染。取典型症状的病果,经酒精消毒后,于无菌条件下,用消毒解剖刀在果实病斑中部纵切一刀,用接种针挑取一小块病果果肉组织,接种于PDA平板培养基上,28℃恒温培养72 h。待长出菌落后,再挑取目标菌落边沿部分接种到新的PDA平板培养基上,依此接种多次,直至培养出纯化的目标菌落。依据文献鉴定。再将分离的病原菌接种到无病的果实上,能够正常发病,将病斑按以上相同方法分离、纯化,得到相同的病原菌,挑取菌落边缘菌丝及分生孢子进行显微镜观察、照相。具体方法参照文献进行。
1.2.2.2 对灰霉菌菌丝生长的抑制毒力测定
采用菌丝生长速率法[5]测定。将抑菌液取10 mL加入到100 mL PDA培养基中混合均匀,制成带药培养基,然后取已经培养好的表面均匀的菌落以Φ=0.638 cm的打孔器打菌饼,用镊子夹取倒置接种于带药培养基上,每处理重复3次,以不加抑菌液而加入10 mL无菌水于100 mL PDA培养基中为对照,另设不加纳他霉素只加对应溶剂为对照以消除溶剂的影响,于培养第7天,分别测定各处理对灰霉菌菌丝生长的抑制作用,用十字交叉法测定菌落直径,并计算菌丝净生长量和抑制率,经DPS统计软件分析求出毒力回归方程及抑制中浓度(EC50)值。
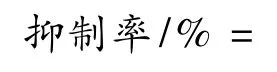

1.2.2.3 葡萄采后贮藏品质的测定

果梗褐变指数[6]:每次随机取20穗果进行分级,并按照公式褐变指数/%=[(各级果穗数×褐变级数)/(总果穗数×最高级数)]×100计算。果梗、穗轴部位均没有褐变为0级,果梗或穗轴褐变面积不超过总面积的1/4为1级,果梗或穗轴褐变面积占总面积的1/4-1/2为2级,果梗或穗轴褐变面积占总面积的1/2-3/4为3级,果梗和穗轴褐变面积超过3/4为4级。
果实硬度采用TA.XT.Plus物性测试仪P/2探头进行穿刺压缩测定,每个引物随机取15个果粒。
1.2.2.4 葡萄内在品质的测定
可溶性固形物(TSS)含量用便携式手持折光仪(pocket refractometer PAL-1)测定,各处理随机取30个果粒,去皮、打浆后取汁测定,每次测定15个数值;
可滴定酸(TA)含量采用酸碱滴定法[5]测定,3次重复;
Vc含量采用钼蓝比色法[7]测定,3次重复。
1.2.2.5 代谢生理指标的测定
呼吸强度的测定参考Dharini(2010)的方法[8]。葡萄出库后,立即从各处理葡萄果穗不同部位剪取小串果穗,精确称重(约500 g)后放置于容积为2 L的密闭干燥罐中,将罐口密封后统一放置于20℃恒温培养箱中4 h。然后以Chcak point型便携式O2/CO2测定仪测定罐内CO2浓度,并计算呼吸强度,单位为mgCO2/(kg·h),3 次重复。
丙二醛(MDA)采用硫代巴比妥酸比色法测定[9],3 次重复。
质膜透性采用外渗电导法[10]测定,3次重复。
1.3 数据处理方法
文中所用数据均采用Excel 2003转化为表格和折线图,采用DPS7.05统计软件进行分析及多重比较。
2 结果与分析
2.1 纳他霉素对葡萄采后灰霉病菌的抑制毒力的作用
经过软件分析,计算出纳他霉素对灰霉菌丝的抑制毒力回归方程为y=81.883x+14.439,山梨酸钾对灰霉菌丝的抑制毒力回归方程为y=6.295 8x+13.752。可以得出,随着纳他霉素和山梨酸钾抑菌溶液浓度的增加,其对灰霉菌菌丝生长的抑制率逐渐增大,浓度为10 g/L的山梨酸钾溶液对菌丝的抑制率为67.31%,而浓度为1 g/L的纳他霉素的抑制率就已达83.04%。根据回归方程计算得出,山梨酸钾EC50值为5 753.65 mg/L,而纳他霉素 EC50值仅为433.96 mg/L,明显低于山梨酸钾处理组,这说明纳他霉素对灰霉菌的抑制毒力要大于山梨酸钾,纳他霉素可以有效抑制灰霉菌的生长。
2.2 不同采前处理对葡萄采后贮藏品质的影响
2.2.1 对葡萄采后霉烂率的影响
随着贮藏时间的延长,山梨酸钾处理组、纳他霉素处理组及对照组的葡萄果实均出现不同程度的霉烂现象(图1),其中山梨酸钾处理组与对照组霉烂率变化趋势较为接近,二者都在贮藏40 d时霉烂率大幅增加,并在贮藏80 d后几乎达到同一水平;而纳他霉素处理组则在贮藏60 d时才出现明显霉烂现象,并且霉烂率增长相对缓慢,贮藏80 d时的腐烂率仅为39.6%,远低于对照组的79.7%,可见对于霉菌的抑制效果,纳他霉素要比山梨酸钾更为明显。
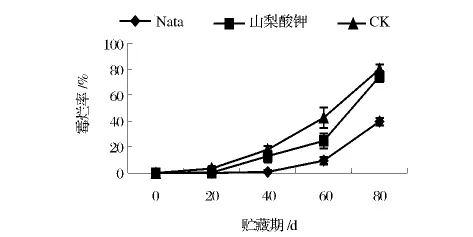
图1 不同处理对葡萄采后霉烂率的影响Fig.1 The impact of different treatments on the rotten rate of grapes postharvest
2.2.2 不同处理对葡萄采后果梗褐变指数的影响
在果梗褐变方面,处理组与对照组的果梗褐变指数均随贮藏时间的延长而增加(图2),山梨酸钾处理组与对照组的变化趋势几乎一致,贮藏80 d时果梗褐变指数已达14%左右,而纳他霉素处理组在各个时期的果梗褐变指数都比另两组低的多,增长幅度缓慢,80 d时也仅为6.9%,可以看出纳他霉素对葡萄果梗的褐变抑制效果较好,而山梨酸钾在抑制褐变方面效果较差。
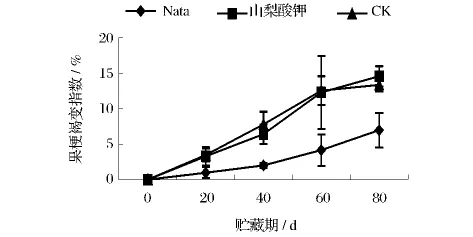
图2 不同处理对葡萄采后果梗褐变指数的影响Fig.2 The impact of different treatments on the stems browning index of grapes postharvest
2.2.3 不同处理对葡萄采后失重率的影响
葡萄果实属于多汁的水果,因此葡萄果实的在贮藏期间易失去水分而失重,致使感官指标有所下降。经过一段时间的贮藏后两种处理的葡萄果实与对照组相比较失重率均有所增加(图3),但增加幅度较对照组缓慢,贮藏至60 d时三者失重率仍然接近,80 d时对照组葡萄的失重率明显升高,达2.09%,并且山梨酸钾处理组的果实失重率(1.01%)略高于纳他霉素处理组(0.81%),可见纳他霉素与山梨酸钾对降低葡萄果实失重率的作用较一致。
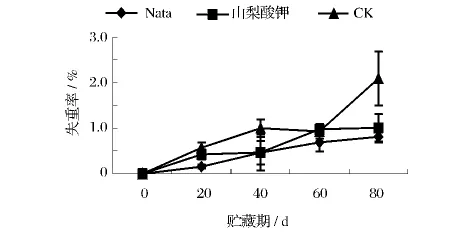
图3 不同处理对葡萄采后失重率的影响Fig.3 The impact of different treatments on the weight loss rate of grapes postharvest
2.2.4 不同处理对葡萄采后硬度的影响
葡萄果实的硬度也是衡量口感和外观的一个重要因素,不论是处理组还是对照组,果实硬度都随贮藏时间的延长而降低(图4),并且三者差距不大。80 d时纳他霉素处理组、山梨酸钾处理组和对照组的果实硬度分别为3.09、2.85及2.18 N,处理组的果实硬度只是在贮藏后期略高于对照组,即纳他霉素与山梨酸钾均未有效改善葡萄果实的硬度。
2.3 不同处理对葡萄采后品质生理指标的影响
2.3.1 不同处理对葡萄采后可溶固形物含量的影响
由图5可溶固形物的结果可以看出,山梨酸钾处理组和对照组的果实可溶固形物含量随时间延长均出现下降现象,纳他霉素处理组的葡萄果实随贮藏时间的延长其含量无明显变化,并始终与采摘初期含量(17.27%)相近。山梨酸钾处理组在贮藏80 d后含量才出现下降(15.5%),对照组则是贮藏60 d时含量明显下降,80 d时低至13.1%。即在较短贮藏期内(0-40 d)不论是否加入防腐剂对葡萄果实中可溶固形物的含量变化都无太大影响。
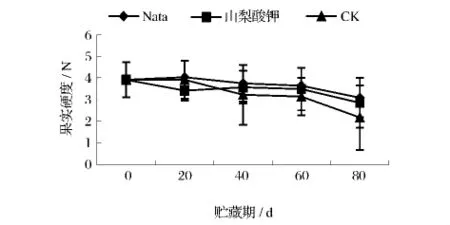
图4 不同处理对葡萄采后硬度的影响Fig.4 The impact of different treatments on the hardness of grapes postharvest
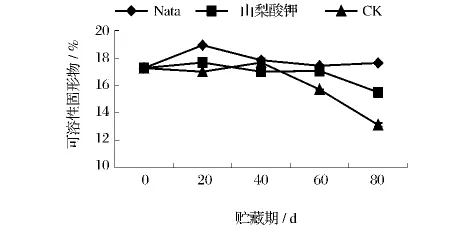
图5 不同处理对葡萄采后可溶固形物含量的影响Fig.5 The impact of different treatments on the content of soluble solids of grapes postharvest
2.3.2 不同处理对葡萄采后可滴定酸含量的影响
可滴定酸与还原糖形成的糖酸比是影响果实风味的重要指标,对可滴定酸的测定中,纳他霉素处理组的含量在贮藏期内无明显变化(图6),而山梨酸钾处理组与对照组总体呈下降趋势。山梨酸钾处理组在贮藏20 d时可滴定酸含量出现短暂上升,达到0.53%,之后同对照组一样迅速下降,至80 d时已无明显差异。可见纳他霉素处理可以明显延缓葡萄果实中可滴定酸含量的降低,而山梨酸钾处理在贮藏初期会致其酸含量升高,但最终对可滴定酸含量的维持无明显效果。
2.3.3 不同处理对葡萄采后Vc含量的影响
葡萄是富含Vc的水果,处理组和对照组中的Vc含量均随贮藏时间的延长而降低(图7),在贮藏40 d时对照组果实的Vc含量出现小幅上升,之后下降。三者Vc含量直至贮藏80 d时才出现较为明显的差异,可见短期贮藏内(0~60 d)纳他霉素和山梨酸钾的加入并未有效保持葡萄中Vc的含量。
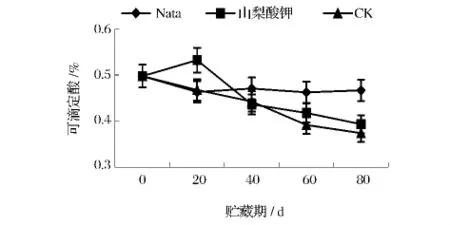
图6 不同处理对葡萄采后可滴定酸含量的影响Fig.6 The impact of different treatments on the content of titratable acid of grapes postharvest
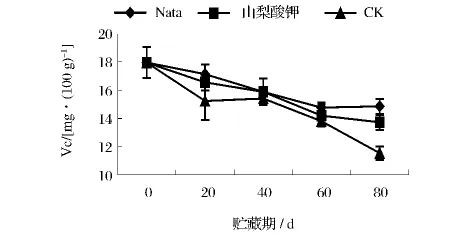
图7 不同处理对葡萄采后Vc含量的影响Fig.7 The impact of different treatments on the Vitamin C content of grapes postharvest
2.4 不同处理对葡萄采后代谢生理指标的影响
2.4.1 不同处理对葡萄采后呼吸强度的影响
呼吸作用随贮藏时间延长而增强。果实贮藏状况与它们的呼吸作用密切相关,降低果实的呼吸作用可以延长保藏期[11]。在生理代谢水平上,纳他霉素处理组的果实呼吸强度在贮藏期间总体呈上升趋势(图8),只是在40 d时出现略微下降[1.46 mgCO2/(kg·h)];而山梨酸钾处理组在贮藏20 d时出现呼吸高峰2.03 mgCO2/(kg·h),之后变化趋势平稳;对照组的呼吸强度变化波动较大,但最终呈上升趋势。
2.4.2 不同处理对葡萄采后果梗和果粒质膜透性的影响
从图9中看出,果梗质膜透性的变化较大,对照组果梗电导率除了在贮藏40 d时明显下降外,其余时期的变化趋势与山梨酸钾处理组相近,最终都呈上升趋势,并在贮藏80 d后接近一致,达到25%左右。纳他霉素处理组的果梗质膜透性则是在贮藏20 d时出现升高而后缓慢下降,到80 d时其电导率仍较低,为9.0%。与果梗不同,三者果粒质膜透性的变化趋势则较为一致,均随贮藏时间延长呈升高趋势,贮藏后期电导率大小顺序依次为CK>山梨酸钾>纳他霉素。可见,纳他霉素对保持葡萄果梗细胞膜的完整性方面明显优于山梨酸钾,但对葡萄果粒细胞膜完整性的保持上作用不大,只是略微好于山梨酸钾。
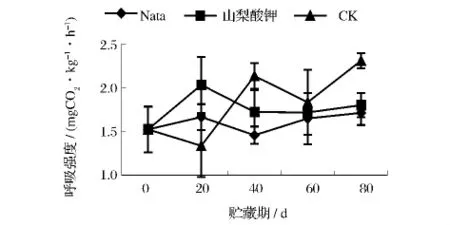
图8 不同处理对葡萄采后呼吸强度的影响Fig.8 The impact of different treatments on the respiratory intensity of grapes postharvest
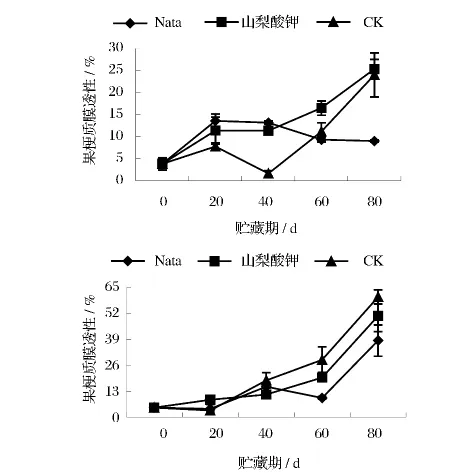
图9 不同处理对葡萄采后果梗及果粒质膜透性的影响Fig.9 The impact of different treatments on the membrane permeability in stems and berry of grapes postharvest
2.4.3 不同处理对葡萄采后MDA含量的影响
丙二醛(MDA)的含量测定结果中,纳他霉素处理组的变化趋势仍然较为平稳(图10),在贮藏后期含量略微降低;山梨酸钾处理组的含量变化则出现缓慢上升;而对照组则在贮藏20 d时明显下降,只有3.57 nmol/g,之后迅速上升,至80 d时已达到16.40 nmol/g,高于山梨酸钾处理组(11.45 nmol/g)和纳他霉素处理组(5.95 nmol/g)。由此可见纳他霉素很好的抑制了葡萄果实中膜脂的过氧化作用。
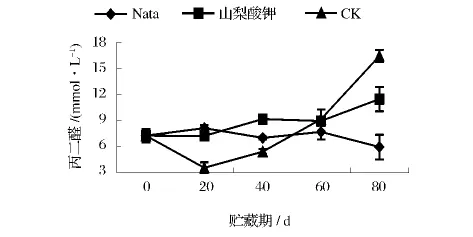
图10 不同处理对葡萄采后MDA含量的影响Fig.10 The impact of different treatments on the MDA content of grapes postharvest
3 讨论
3.1 纳他霉素对葡萄采后灰霉病菌的抑制毒力的作用
纳他霉素作为一种新型高效的天然生物防腐剂,越来越受到人们关注。在本实验中对灰霉菌抑制毒力的研究可知纳他霉素对菌丝生长率的抑制作用要好于山梨酸钾,二者EC50值分别为5 753.65 mg/L和433.96 mg/L,另有研究也表明,纳他霉素对真菌的抑制作用比山梨酸钾强50倍左右[12]。这是由于纳他霉素分子与真菌细胞质膜上的甾醇分子结合,破坏了细胞质膜的渗透性,引起菌内营养物质外渗而死亡,因此纳他霉素对酵母和霉菌等真菌有很好的抑制作用,而对细菌则不起作用[13]。孙远功等[14]采用直接喷雾法将不同浓度的纳他霉素悬浮液作用于柑橘并与未处理的柑橘进行比较,发现温度为18~22℃、湿度为58%~65%的条件下纳他霉素的最佳作用浓度为300~400 mg/L,与本文研究结果类似。Leeuwen等[15]比较了纳他霉素与其他抗真菌剂在质膜透性上的区别及内吞作用的影响,发现纳他霉素的作用方式与其他抗真菌剂不同,它无法透过萌发的孢子,但在一定剂量和时间下会干扰内吞作用,这也证实了纳他霉素对霉菌具有较高的抑制作用。
3.2 纳他霉素对葡萄采后灰霉病菌的贮藏品质及生理指标的影响
本实验研究结果表明,经浓度为0.5 g/L的纳他霉素溶液采前浸泡的葡萄果实可大大降低霉烂率,并使可溶固形物含量及可滴定酸含量维持在稳定水平,同时很好的抑制果梗的褐变,降低Vc的损失,但在减少失重率和维持果实硬度的作用上与山梨酸钾相当,效果不明显。纳他霉素的加入明显地抑制了果梗的衰老,这可能是由于果梗为葡萄果穗的生理活跃部位和物质消耗的主要部位[16],纳他霉素可以抑制其生理活性。山梨酸钾的添加在一定程度上增加了酸味,可能是因为山梨酸钾属酸性防腐剂,它的添加可在短期内提高葡萄果实的含酸量。这两个指标会影响葡萄果实的口感口味,因此纳他霉素可较长时间保持葡萄的酸甜口味。而对于Vc的含量,纳他霉素与山梨酸钾均能较好的降低Vc的损失,这一点与柑橘果实中的研究结果一致[14]。
3.3 纳他霉素对葡萄采后灰霉病菌的代谢生理指标的影响
纳他霉素在代谢生理水平上的保鲜效果较为突出,可使葡萄果实贮藏期间的呼吸强度维持在稳定的水平,并能较好的保持果梗及果粒细胞膜完整性、抑制膜脂的氧化作用。果实呼吸速率的变化规律是葡萄贮藏期间主要生理指标之一,呼吸作用会使得果实有机物质消耗,品质逐渐下降[11],维持较低水平的呼吸速率可延长保质期。本实验中,采前0.5 g/L纳他霉素浸果处理的果实呼吸强度在贮藏20 d时均出现小幅升高,这可能是由于实验使用的纳他霉素保鲜液为柠檬酸配制,偏酸性,在处理初期及入贮时对果实具有一定的刺激作用,使果实呼吸作用在开始时出现升高。纳他霉素的加入对植物组织新陈代谢过程中的细胞膜具有重要作用,细胞膜透性的高低可以代表细胞膜的完整程度和稳定性,一定程度上反映了细胞受伤害的情况,因此电导率值越低,细胞膜完整程度越高,保鲜效果就越好。MDA是膜脂过氧化的最终分解产物,其含量的增加可对膜和细胞造成一定的伤害,其含量的高低可以反映膜脂过氧化程度。研究发现[17],一旦细胞膜完整性被破坏,会引起差别透性丧失,电解质及某些小分子有机物大量渗漏,细胞物质交换平衡破坏,表现在电导率值的增加,生理生化代谢也发生紊乱,从而引起呼吸强度的变化。有研究表明葡萄的质膜透性随SO2处理剂量的增加和时间的延长而增大,果梗和果肉中的MDA含量增加[18],可见SO2对细胞膜完整性可能会造成一定程度的伤害。
综合以上结果可以看出,纳他霉素在延长葡萄果实保鲜期方面具有很好的作用,尤其是对霉菌等真菌的抑制效果突出,在感官指标、内在品质以及代谢生理上也具有较好的防腐保鲜作用。选择合适浓度的纳他霉素溶液可使葡萄保鲜效果达到最佳。纳他霉素本身无毒、高效、安全等特点也使得它具有广泛的应用前景。
[1] 段振华,张慜.葡萄保鲜技术的研究[J].食品发酵与工业,2002,28(1):68-71.
[2] 武杰.葡萄采后生理生化特征及贮藏保鲜的研究进展[J].安徽农业科学,2009,37(23):11183-11185.
[3] Li Zhi-wen,Zhang Ping,Huang Yan-feng et al.Effect of sulfur dioxide injury on aroma components of postharvest red globe[J].Acta Botanica Boreali-Occidentalia Sinica,2011(2):031.
[4] Welscher Y M,Leeuwen M R,Kruijff B,et al.Polyene antibiotic that inhibits membrane transport proteins[J].Proceedings of the National Academy of Sciences of the U-nited States of America,2012,109(28):11 156 -11 159.
[5] 高俊凤.植物生理学实验指导[M].北京:高等教育出版社,2006:210-213,217-219,221-223.
[6] 田金强,张子德,陈志周.红提葡萄贮藏保鲜过程中SO2伤害的防止技术研究[J].食品科学,2006,27(1):250-252.
[7] 李军.钼蓝比色法测定还原型维生素C[J].食品科学,2000,21(8):42-45.
[8] Dharini S,Lise K.Fruit quality and physiological responses of litchi cultivar McLean’s Red to 1-methylcyclopropene pre-treatment and controlled atmosphere storage conditions[J].LWT-Food Science and Technology,2010,43(6):942-948.
[9] 郝再彬.植物生理实验[M].哈尔滨:哈尔滨工业大学出版社,2004:50.
[10] 张华云.葡萄采后保鲜技术及机理研究[D].北京:中国农业大学,2002.
[11] 李桂芬,刘廷松.葡萄贮藏生理研究进展[J].果树科学,2000,17(1):63-69.
[12] Sampayo F.Distribution of fungal genera in cheese and dairies[J]. AchievementfuerLebensmittelhygiene,1995,46(3):62-651.
[13] Resa C.P,Gerschenson L.N et al.Effect of natamycin on physical properties of starch edible films and their effect onSaccharomyces cerevisiaeactivity[J].Food Bioprocess Technol,2012(online).
[14] 孙远功,呼玉侠,冯昕.纳他霉素在柑橘防腐保鲜中的应用[J].食品研究与开发,2006,27(7):190-192.
[15] Leeuwen V,Golovina E.A.,Dijlsterhuis J.The polyene antimycotics nystatin and filipin disrupt the plasma membrane,whereas natamycin inhibits endocytosis in germinating conidia ofPenicillium discolor[J].Journal of Applied Micribiology,2009,106(6):1 908-1 918.
[16] 关文强,阎瑞香.葡萄采后生理研究进展[J].保鲜与加工,2001,1(2):24-26.
[17] 黄锐.热处理对葡萄采后保鲜效果及其机理的研究[D].甘肃:甘肃农业大学,2009.
