纳他霉素对青皮核桃保鲜的影响*
2013-11-19郭园园鲁晓翔李江阔梁冰郭兴月陈绍慧张鹏
郭园园,鲁晓翔,李江阔,梁冰,郭兴月,陈绍慧,张鹏
1(天津商业大学生物技术与食品科学学院,天津市食品生物技术重点实验室,天津,300134)
2(国家农产品保鲜工程技术研究中心,天津市农产品采后生理与贮藏保鲜重点实验室,天津,300384)
3(沈阳农业大学食品学院,辽宁沈阳,110866)
核桃(Juglans regiaL.)又称胡桃、羌桃。核桃种仁富含蛋白质、磷脂、维生素、矿物质及人体必需的不饱和脂肪酸等营养物质,具有滋养脑细胞,增强脑功能,防止动脉硬化,降低胆固醇等作用[1]。近年来,鲜食核桃因其营养丰富、口感良好、相对较低的脂肪含量等,在国内外越来越受到人们的喜爱[2]。但青皮核桃采后呼吸旺盛,贮藏时极易腐烂,影响其市场供应期[3]。因此,青皮核桃的保鲜技术亟待解决。
目前,利用保鲜剂保鲜青皮核桃的研究尚未见报道。纳他霉素是一种天然保鲜剂,安全性高,且具有广谱高效的抗真菌作用[4]。据报道[5-6],纳他霉素在低浓度下就能有效抑制真菌生长,对几乎所有的真菌类都有很强的抑制性,已在香菇、乳制品、肉制品、果汁饮料、葡萄酒保藏上得到应用,效果较好。本实验利用纳他霉素对青皮核桃进行处理,研究其对青皮核桃品质变化的影响,以探讨青皮核桃的贮藏保鲜提供新的技术。
1 材料与方法
1.1 材料与试剂
供试材料:2012年9月2日采自北京平谷县核桃实验园基地,选取大小均匀、无机械损伤、无病虫害的青皮核桃供实验用。
主要试剂:纳他霉素,北京东方瑞德生物技术公司;三氯乙酸(分析纯),天津市江天化工技术有限公司;磷酸氢二钠、磷酸二氢钠(均为分析纯),天津市科威有限公司;邻苯二酚(为分析纯),天津市光复精细化工研究所;PVP、DTT(均为分析纯),天津博美科生物技术有限公司;亚油酸钠、Tri tonX-100(生化试剂),天津博美科生物技术有限公司。
1.2 仪器与设备
冷库:国家农产品保鲜工程技术研究中心(天津)(以下简称保鲜中心),库内温度 -0.5~0.5℃;CW-700d分光测色计,柯尼卡美能达(中国)投资有限公司;TU-1810紫外可见分光光度计,北京普析通用仪器有限责任公司;SIGMA 3-30K高速离心机,德国SIGMA实验室离心机公司;微孔保鲜袋(厚度0.02 mm)由保鲜中心提供。
1.3 实验材料预处理
(1)对照组(CK):将选取的青皮核桃于冷库[(0±0.5)℃]中进行预冷处理,充分预冷24 h后,用微孔袋(厚度0.02 mm)包装后放入纸箱,继续冷藏。
(2)处理组1(SY1):将选取的青皮核桃在质量分数为600 mg∕L的纳他霉素中浸泡3 min,沥干后于冷库[(0±0.5)℃]中预冷24h后,用微孔袋(厚度0.02 mm)包装后放入纸箱,继续冷藏。
(3)处理组2(SY2):将选取的青皮核桃在质量分数为800 mg∕L的纳他霉素中浸泡3 min,余下步骤同SY1处。
(4)处理组3(SY3):将选取的青皮核桃在质量分数为1 000 mg∕L的纳他霉素中浸泡3 min,余下步骤同SY1处。
上述各处理组按10 kg/箱包装,且每隔15d测定一次各项指标,每个处理各进行3次重复测定。
1.4 测定指标和方法
1.4.1 霉腐率
霉腐率/%=(霉烂果个数/处理的总果数)×100
1.4.2 色差的测定
随机取5个青皮核桃用CW-700 d分光测色计测定。测定时在果实对称的位置用记号笔标记,每隔15 d对标记点进行测定,并取平均值。a*为负值,表示绿色。
1.4.3 丙二醛(MDA)含量测定
采用硫代巴比妥酸比色法[7]。
1.4.4 多酚氧化酶(PPO)
采用儿茶酚比色法[8]。
称取核桃仁冻样3 g于预冷的研钵中,加入适量0.05 mol/L pH 7.8磷酸缓冲液(总用量20 mL),冰浴研磨成匀浆,于4℃下15 000 r/min离心10 min,再取上清液于4℃下10 000 r/min离心10 min。取3 mL上清酶液,然后加入3.9 mL pH 7.8磷酸缓冲液,1.0 mL 0.1 mol/L儿茶酚,于37℃水浴保温10 min,迅速放入冰浴中,立即加入2mL体积分数20﹪三氯乙酸终止反应,于420 nm处测其吸光度值,以磷酸缓冲液代替酶液为对照调零。
1.4.5 过氧化氢酶(CAT)采用紫外吸收法[9]
称取核桃仁冻样0.2 g于预冷的研钵中,加入20 mL预冷后的pH 7.5、0.05 mol/L的磷酸缓冲液(内含0.005 mol/L二硫苏糖醇和2%PVP),在冰浴中研磨成匀浆,于4℃下15 000 r/min离心 20 min,取0.05 mL粗酶液,加入3 mL 0.02 mol/L H2O2后,在240 nm处测定2 min内样品的吸光度变化。
1.4.6 脂氧合酶(LOX)参考陈昆松[10]的方法测定
称取核桃仁冻样1.0 g,冰浴研磨,加入0.05mol/L磷酸缓冲液(pH值7.0),并使最终体积为20 mL,于4℃下15 000 r/min离心30 min,上清液为LOX的提取液。加入亚油酸钠25 μL,pH 7.0磷酸缓冲液2.775mL,30℃温育,加 200 μL 酶液后 20 s开始计时,记录234 nm处测定1 min内吸光度,重复3次。
以上酶活性计算公式均为:
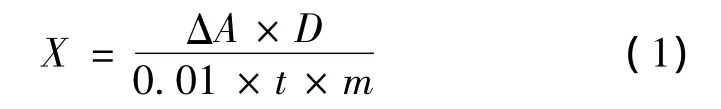
式中:X为酶的比活力(0.01ΔA/[g(FW)min];△A为反应时间内吸光度的变化;D为稀释倍数即提取的总酶液为反应系统内酶液体积的倍数;t为反应时间/min;m为称取果肉质量/g。
1.4.7 数据处理
所有数据采用 Excel 2003软件处理,并采用SPSS16.0软件的新复极差法(Duncan)进行方差分析(P=0.05)和多重比较。
2 结果与分析
2.1 纳他霉素对青皮核桃霉腐率的影响
图1表明,各组核桃的霉腐率随贮藏期的延长而增加。CK到贮藏60 d后霉腐率迅速增加,而各处理组在75d时霉腐率才大幅增加,而此时CK的霉腐率已达到48.18%,果实严重腐烂、发霉,已失去商品价值;而处理组在贮藏75d时的霉腐率依 SY1、SY2、SY3分别为23.69%、9.75%、6.73%。在整个贮藏期,霉腐率大小顺序为CK>SY1>SY2>SY3。从贮藏第15天开始,CK的青皮核桃霉腐率显著(P<0.05)高于处理组;SY3的霉腐率略低于SY2,但极显著(P<0.01)低于SY1。由此可知,纳他霉素处理组有效地抑制了青皮核桃的霉变及腐烂,能更好地保持青皮核桃的品质,其中以SY3的防霉效果最好。
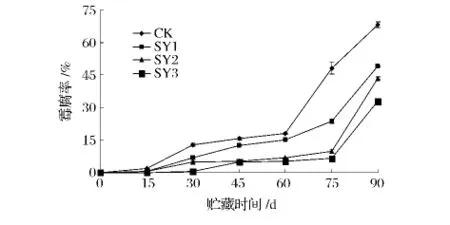
图1 纳他霉素对青皮核桃霉腐率的影响Fig.1 Effect of natamycin on decay rate of green juglans
2.2 纳他霉素对青皮核桃色差的影响
青皮核桃果皮色泽是评价其外观品质的重要指标。通常,青皮核桃的果皮在贮藏开始时为绿色,随着贮藏时间的延长,果皮逐渐变黄,最后变为黑褐色。本试验以色差计对青皮核桃的果皮色泽变化进行跟踪监测,其中a*正值表示偏红,负值表示偏绿。a*值越小则表明颜色越绿。实验结果如图2所示。
由图2可见,各组a*随着贮藏时间的延长均呈上升趋势,但各组青皮核桃的a*在贮藏前期差异并不明显。至贮藏30 d,各组a*开始迅速增大。在贮藏60 d时,CK组的a*值达到4.39,极显著(P<0.01)高于处理组,但各处理组间无显著差异。至贮藏后期,各组青皮核桃的a*变化趋于缓慢。在整个贮藏过程中,各组a*的大小顺序为CK>SY1>SY2>SY3。可知,纳他霉素处理组能够有效抑制a*值的增加,较好保持青皮核桃的色泽,其中以SY3的保色效果最好。

图2 纳他霉素对青皮核桃a*的影响Fig.2 Effect of natamycin on a*of green juglans
2.3 纳他霉素对青皮核桃MDA的影响
丙二醛(MDA)是膜脂过氧化作用的主要产物之一,其含量的增加是膜脂过氧化加强,膜受伤而加剧衰老的表现,它反映了果实在逆境下受伤害的程度[11]。
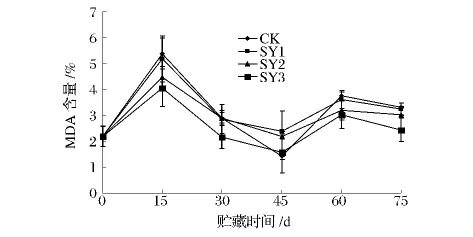
图3 纳他霉素对青皮核桃MDA含量的影响Fig.3 Effect of natamycin on MDA content of green juglans
图3显示,各组的MDA含量的变化均为先增后降的趋势,且有双峰曲线。各组在贮藏15d时均出现第 1 个高峰,CK、SY1、SY2、SY3 的峰值分别为5.39%、5.18%、4.47%、4.06%,可能是因为青皮核桃对低温的应对反应所致;之后由于青皮核桃适应了贮藏温度,而使MDA含量逐渐降低。贮藏60d时出现第2个高峰,则可能是因为贮藏后期青皮核桃衰老的原因所致。在贮藏75d时,CK的MDA含量略高于SY1和SY2,SY3的MDA含量极显著(P<0.01)低于其他各组。可见,处理组能够降低MDA含量,其中,SY3延缓青皮核桃衰老的效果最好。
2.4 纳他霉素对青皮核桃多酚氧化酶(PPO)活性的影响
PPO含量增加能够氧化酚类物质造成酶促褐变,从而降低酚类物质的抗氧化能力[12]。
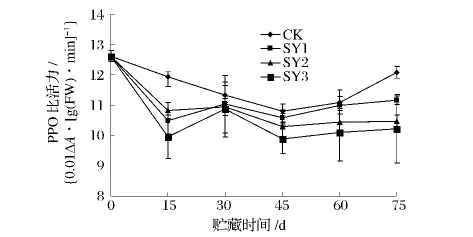
图4 纳他霉素对青皮核桃PPO比活力的影响Fig.4 Effect of natamycin on PPO activity of green juglans
由图4可见,CK的PPO比活力出现先降后升的趋势,处理组则呈波浪式变化。贮藏初期各组青皮核桃的PPO比活力均下降,可能是低温环境降低果实的代谢速率,抑制褐变发生。在贮藏30d,各处理组均出现了峰值,CK的PPO活性略高于处理组,而CK则未出现PPO活性高峰,可能是由于纳他霉素加强了核桃仁应对环境的能力,因而之后的PPO比活力略有下降。在贮藏75d时,CK的PPO比活力迅速增大,各处理组也再次均出现峰值,可能是青皮核桃的品质急剧下降,衰老加速所致,此时CK的PPO比活力为12.067 0.01ΔA/[g(FW)·min],极显著(P<0.01)高于 SY1(11.05 0.01ΔA/[g(FW)·min]、SY2(10.46 0.01ΔA/[g(FW)· min]、SY3(10.22 0.01ΔA/[g(FW)·min]。在整个贮藏期中,CK 的PPO比活力均高于处理组,SY3的PPO比活力均低于SY1、SY2。可见,SY3处理能够有效地降低核桃PPO比活力,延缓其衰老。
2.5 纳他霉素对青皮核桃过氧化氢酶(CAT)活性的影响
CAT能减少果实内的H2O2积累,从而延缓果实衰老。图5结果显示,各组的CAT活性均呈先增后降的趋势,CK呈单峰曲线,在贮藏45d出现CAT活性高峰(7410.98{0.01ΔA/[g(FW)·min]};而处理组呈双峰趋势,在贮藏15d和45d均有高峰,由此看出,纳他霉素处理诱导了CAT活性高峰的出现。在贮藏15d,CK的CAT酶活性仅为4 963.79{0.01ΔA/[g(FW)·min]},极显著(P<0.01)低于各处理组的 CAT 活 性 (6323.53、7187.23、7829.36{0.01ΔA/[g(FW)·min]}。在贮藏45 d 时,SY3 的CAT 酶活性(9 215.61{0.01ΔA/[g(FW)·min]}显著(P<0.05)高于其它组,但其他组之间并无明显差异。在整个贮藏期,CK的CAT比活力低于处理组,SY3的CAT的酶活性均高于SY1、SY2。结果表明,纳他霉素处理组能有效地提高CAT比活力,其中以SY3的效果最佳。
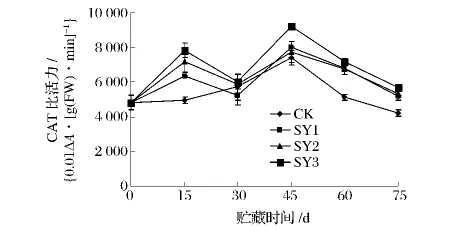
图5 纳他霉素对青皮核桃CAT比活力的影响Fig.5 Effect of natamycin on CAT activity of green juglans
2.6 纳他霉素对青皮核桃脂氧合酶(LOX)活性的影响
LOX以细胞膜释放的游离脂肪酸为底物,催化形成氢过氧化物、自由基和茉莉酸(JA)等促进衰老的物质,故其直接或间接地参与组织的衰老进程[13]。
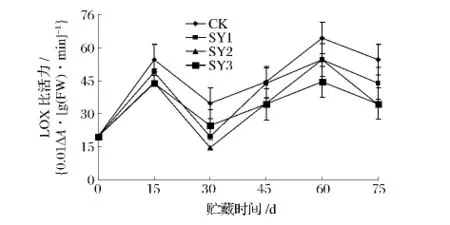
图6 纳他霉素对青皮核桃LOX比活力的影响Fig.6 Effect of natamycin on LOX activity of green juglans
如图6所示,各组的LOX的比活力的变化趋势均为先增后降再增的双峰曲线。在贮藏15d时出现第一个峰值,此时 CK的峰值(54.51{0.01ΔA/[g(FW)·min]}略高于各处理组的峰值。在贮藏60d时,各组均出现第二个高峰,此时CK的LOX比活力(64.48{0.01ΔA/[g(FW)· min]}均高于 SY1(54.48{0.01ΔA/[g(FW)· min]}、SY2(54.53{0.01ΔA/[g(FW)·min]}、SY3(44.53{0.01ΔA/[g(FW)·min]}。这可能是由于青皮核桃的品质急剧下降,衰老加速所致。在整个贮藏期中,CK的LOX活力高于各处理组的LOX活力,而SY3的LOX比活力低于SY1与SY2。说明SY3处理能有效降低LOX活性,延缓衰老。
3 讨论
3.1 纳他霉素对青皮核桃品质的影响
纳他霉素是目前国内外唯一的抗真菌防腐剂,是一种天然、广谱、高效安全的酵母菌及霉菌等丝状真菌抑制剂,它不仅能够抑制真菌,还能防止真菌毒素的产生。有关纳他霉素在青皮核桃的应用目前尚未见报道。Zhou[14]研究发现,对红地球葡萄进行纳他霉素处理,可有效地降低呼吸强度、失重率、腐烂率和落粒率。周翠英[15]研究发现,纳他霉素处理可有效控制草莓果实表面霉菌数量,减慢叶柄叶绿素含量下降的速率,抑制果实有机酸与糖分的下降,较好地维持果实的营养,延长贮藏期。本文实验表明,纳他霉素可以降低青皮核桃的霉腐率与a*值的升高,能够延缓MDA含量的增加,其中以1 000 mg/L纳他霉素处理效果最好。
3.2 纳他霉素处理对青皮核桃PPO、CAT和LOX活性的调控
CAT属于抗氧化酶,能及时清除活性氧,保持膜结构完整,与果实的成熟及衰老有关。有研究表明,当植物受到病原菌侵害时,CAT的活性升高,抗氧化性加强、木质素合成、次生代谢加快,以抵抗病原菌的侵染[16],CAT在木质素生物合成的最后一步反应过程中催化H2O2分解而发挥作用[17],有效延缓了果实衰老。本实验纳他霉素处理促进了CAT活性,从而提升了青皮核桃对病原菌的抵抗能力。
PPO是存在于植物体内与抵抗病原微生物浸染有关的酶[18]。PPO在酶促褐变中起重要作用,PPO含量增加能够氧化酚类物质造成酶促褐变,降低酚类物质的抗氧化能力。本实验中的纳他霉素处理抑制了青皮核桃的PPO活性,从而延缓其衰老。
LOX与果实的成熟衰老密切相关,LOX启动膜脂过氧化作用,使膜磷脂不断水解,产生游离脂肪酸。研究表明,LOX在植物的生长、发育、成熟衰老以及机械伤害、病虫侵染等过程起调节作用[19]。本实验纳他霉素处理抑制了核桃LOX活性,这可能是纳他霉素的抗菌性抑制了核桃LOX的活性。
本实验结果表明,纳他霉素处理能够有效控制青皮核桃霉腐率的增加,较好的保持青皮核桃的原有色泽,延缓MDA含量的增加,提高CAT活性,降低PPO和LOX活性。其中,以1 000 mg/L纳他霉素处理的青皮核桃的保鲜效果最佳。
[1] 马惠玲,宋淑亚,马艳萍,等.自发气调包装对核桃青果的保鲜效应[J].农业工程学报,2012,28(2):262-267.
[2] 黄凯,袁德保,韩忠.鲜食核桃贮藏中生理生化变化的研究[J].安徽农业科学,2008,36(23):9 858-9 860.
[3] 鲁墨森,张倩,杨娟侠.鲜食核桃保鲜和周年供应技术研究[J].山东农业科学,2010(3):81-83.
[4] Tianjia Jianga,Lifang Fenga,Xiaolin Zhenga al.Physicochemical responses and microbial characteristics of shiitake mushroom(Lentinus edodes)to gum arabic coating enriched with natamycin during storage[J].Food Chemistry,2013,138(2/3):1992 -1997.
[5] DSM.Natamycin in fermented sausages and cheese[J].Food Engineering and Ingredients,2002,(9):39.
[6] PedersenJ C.Natamycin as a fungicide internedia[J].Applied and Environmental Microbiology,1992,(58):1 064-1 066.
[7] Rao M V,Paliyath G,Ormrod D P.Ultraviolet-B-andozone-induced biochemieal changes in Antioxidant enzymes of Arabidopsis thaliana[J].Plant Physiol,1996,110:125-136.
[8] 朱广廉,钟诲文,张爱琴,等.植物生理学实验[M].北京:北京大学出版社,1990:37-40.
[9] 李合生,孙群,赵世杰,等.植物生理生化实验原理和技术[M].北京:高等教育出版社,2000:39-43.
[10] 陈昆松,徐昌杰,徐文平,等.猕猴桃和桃果实脂氧合酶活性测定方法的建立[J].果蔬学报,2003,20(6):436-438.
[11] 武菊英,滕文军,王庆海,等.多年生观赏草在北京地区的生长状况与观赏价值评价[J].园艺学报,2006,33(5):1 145-1 148.
[12] 张平,张鹏,刘辉,等.不同低温处理对樱桃冷害发生的影响[J].食品科学,2012,33(12):303-308.
[13] 许文平,陈昆松,徐昌杰,等.猴桃采后果实冷藏与货架期脂氧合酶活性和乙烯生成的变化[J].中国农业学,2003,36(10):1 196-1 201.
[14] Zhou Huiling,Liu Meiying,Ren Xiaolin.Antisepsis and fresh-keeping effects of natamycin coating compounds treatment on red global grape[J].Agricultural Science &Technology,2012,13(9):2 012-2 016,2036.
[15] 周翠英,周建俭,高腾,等.纳他霉素在气调保鲜草莓中的应用研究[J].食品科技,2012,37(3):54-57.
[16] 刘美迎,周会玲,吴主莲,等.纳他霉素复合涂膜剂对葡萄保鲜效果的影响[J].农业工程学报,2012,28(10):259-266.
[17] Mónica Quirogaa,Silvia M.de Forchettia,Edith Taleisnika,et al.Tomato root peroxidase isoenzymes:kinetic studies of the coniferyl alcohol peroxidase activity,immunological properties and role in response to salt stress[J].Journal of Plant Physiology,2001,158(8):1 007-1 013.
[18] Ahl-goy P,Felix G,Metraux J P,et al.Resistance to disease in the hybrid Nicotiana glutinosa×Nicotiana debneyi is associated with high constitutive levels of β-1,3-glucanase,chitinase,peroxidase and polyphenoloxidase[J].Physiol Mol Plant Pathol,1992,(41):11 -21.
[19] 陈昆松,张上隆.脂氧合酶与果实的成熟衰老[J].园艺学报,1998,25(4):338-344.
