高同型半胱氨酸血症对原发性高血压患者冠状动脉内皮功能的影响*
2013-11-16刘佳徐援高霞范慧贾育梅张恒杨新春王广
刘佳,徐援,高霞,范慧,贾育梅,张恒,杨新春,王广
高同型半胱氨酸血症(HHcy)是冠心病的独立危险因素[1,2],具体机制尚不十分清楚,可能与其引起血管内皮功能障碍、氧化应激等有关[3-4]。而原发性高血压与高同型半胱氨酸血症常常同时存在,原发性高血压可通过引起内皮一氧化氮合酶(Endothelial nitric oxide synthase,eNOS)结构和功能异常、黏附分子增加及血管壁炎症等多种因素引起血管内皮损伤[5-7]。研究显示,短时间内大量摄入蛋氨酸引起的急性HHcy可以损伤高血压患者的冠状动脉循环功能[8],但目前对于原发性高血压伴长期慢性高同型半胱氨酸血症(即“H型高血压”)患者的冠状动脉内皮功能状态仍不十分清楚。本研究观察慢性HHcy对原发性高血压患者冠状动脉内皮功能的影响。
1 资料与方法
研究对象:共纳入91例于2012-06至2013-06在北京朝阳医院就诊的门诊及住院患者,其中51例原发性高血压患者为原发性高血压组,40例健康受试者为对照组。原发性高血压的诊断参照《中国高血压防治指南(2005年修订版)》。高同型半胱氨酸血症定义为血Hcy>15 μmol/L。所有参与者均排除急性心肌梗死、冠心病、糖尿病、心功能不全、肝肾功能异常、感染、肿瘤、系统性炎症性疾病及其他严重疾病患者,且所有患者均未服用硝酸酯类及维生素类药物。本研究的受试者均知情同意。
研究方法:所有受试者均由固定专人应用校准的身高标尺和体重秤测量身高(m)和体重(kg),计算体重指数。取清晨空腹静脉血,进行生化指标、血脂指标、同型半胱氨酸、胰岛素等检测。血浆于-70 ℃保存。计算稳态模型胰岛素抵抗指数,胰岛素抵抗指数=[空腹血糖(mmol/L)×空腹胰岛素(μIU/L)]/22. 5[9]。
经胸超声心动图冠状动脉血流显像是研究冠状动脉血流动力学及内皮功能的一项无创性检测手段[10]。所有受试者均行经胸超声心动图冠状动脉血流显像(Vivid 7 Dimension;GE)测量冠状动脉血流储备以评价冠状动脉内皮功能。静息状态和最大充血状态下 [应用腺苷 0. 14 mg/(kg·min)]应用冠状动脉血流显像测量左前降支血流速度峰值,由最大血流速度与基线水平的比值计算出冠状动脉血流储备。
统计学方法:应用SPSS 13.0统计软件包处理数据。计量资料用均数±标准差表示。计量资料组间比较用t检验和方差分析。高密度脂蛋白胆固醇(HDL-C)及空腹胰岛素水平为非正态分布,以中位数及范围表示,经变量转换后,应用t检验和方差分析。计数资料采用χ2分析。相关性分析应用Spearman秩次相关分析和线性回归分析。双侧检验,P<0. 05 表示差异具有统计学意义。
2 结果
2.1 一般资料的比较:原发性高血压组和对照组的基本临床资料见表1。两组在年龄、性别、吸烟、体重指数等方面差异无统计学意义(P>0.05)。
2.2 生化代谢指标的比较:原发性高血压组和对照组在总胆固醇(TC)、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、空腹血糖(FBG)、空腹胰岛素及胰岛素抵抗指数水平均无统计学差异(表1)。原发性高血压组患者血Hcy水 平 高 于 对 照 组 [(15.60±6.58)μmol/L vs(13.08±4.13)μmol/L,P<0.05],而冠状动脉血流储备低于对照组 [(2.88±0.70)vs(3.23±0.54),P<0.05]。

表1 原发性高血压组及对照组基本临床特征及代谢指标
2.3 亚组分析:原发性高血压患者血浆Hcy水平超过15 μmol/L时诊断为“H型高血压”。为了进一步分析慢性HHcy对原发性高血压患者的冠状动脉内皮功能的作用,进行了亚组分析。
根据血Hcy水平是否超过15 μmol/L将原发性高血压组和对照组受试者进一步分成四个亚组:未合并HHcy的原发性高血压亚组、合并HHcy的原发性高血压亚组、未合并HHcy的对照亚组及合并HHcy的对照亚组。四组在年龄、性别、吸烟、体重指数、TC、LDL-C、HDL-C及FBG等方面差异无统计学意义(表2)。
合并HHcy的原发性高血压亚组的空腹胰岛素水平 [(16.11±7.94) μIU/ml] 高于未合并 HHcy的原发性高血压亚组 [(10.98±6.05)μIU/ml],见图1A。合并HHcy的原发性高血压亚组的胰岛素抵抗指数水平高于未合并HHcy的原发性高血压亚组[(3.92±2.16)vs (2.72±1.50),图1B]。未合并HHcy的对照亚组及合并HHcy的对照亚组的血浆空腹胰岛素及胰岛素抵抗指数水平未见明显差异(图 1)。
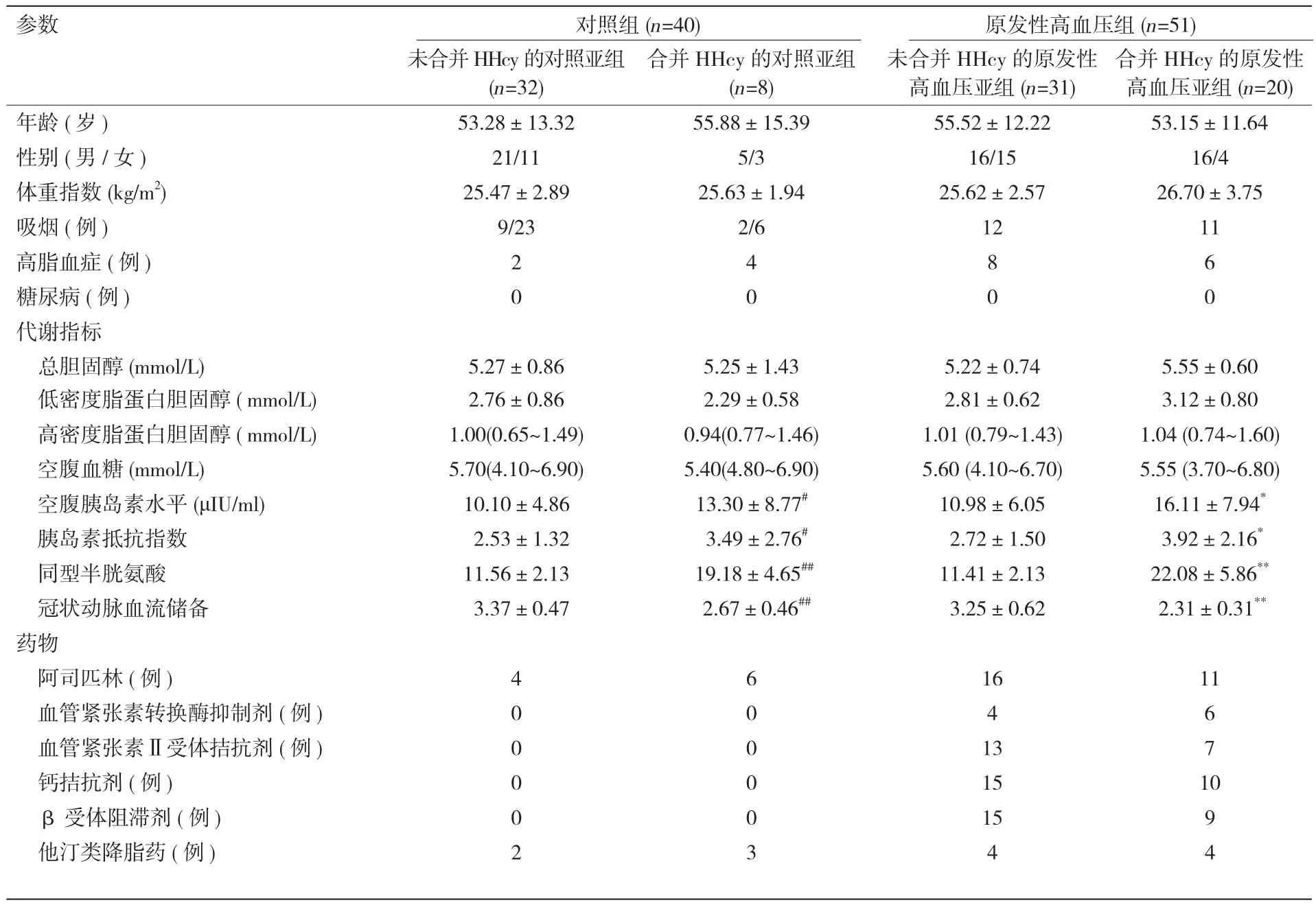
表2 原发性高血压组及对照组分别依据是否合并同型半胱氨酸血症分组后的基本临床特征及代谢指标

图1 四个亚组的空腹胰岛素水平、稳态模型胰岛素抵抗指数及冠状动脉血液流储备情况
合并HHcy的原发性高血压亚组的冠状动脉血流储备低于未合并HHcy的原发性高血压亚组[(2.31±0.31) vs (3.25±0.62),P<0.01;图1C]。而合并HHcy的对照亚组的冠状动脉血流储备水平低于 未 合 并 HHcy的 对 照 亚 组 [(2.67±0.46)vs(3.37±0.47),P< 0.01;图 2A]。更重要的是,合并HHcy的原发性高血压亚组患者的冠状动脉血流储备低于合并HHcy的对照亚组[(2.31±0.31) vs(2.67±0.46),P<0.01;图 1C]。
鉴于有些研究以血浆Hcy > 10 μmol/L作为HHcy的诊断切点,进一步将对照组及原发性高血压组根据血浆Hcy浓度分成三个亚组:<10 μmol/L 亚组、10~15 μmol/L亚组和>15 μmol/L亚组。无论是在对照组还是原发性高血压组,血 Hcy< 10 μmol/L 亚组及 10~15 μmol/L 亚组的均无明显差异,但 Hcy>15 μmol/L 亚组的冠状动脉血流储备低于前两者,差异有统计学意义(图2)。

图2 各组冠状动脉的血流储备情况
2.4 同型半胱氨酸与冠状动脉血流储备的相关性:为了进一步明确Hcy 与冠状动脉内皮功能的关系,将全部参与者血浆Hcy与冠状动脉血流储备水平进行总体的相关性分析,结果显示血浆Hcy水平与冠状动脉血流储备呈负相关(r= -0.578,P<0.01,95%CI:-0.085~-0.046;图 3)。
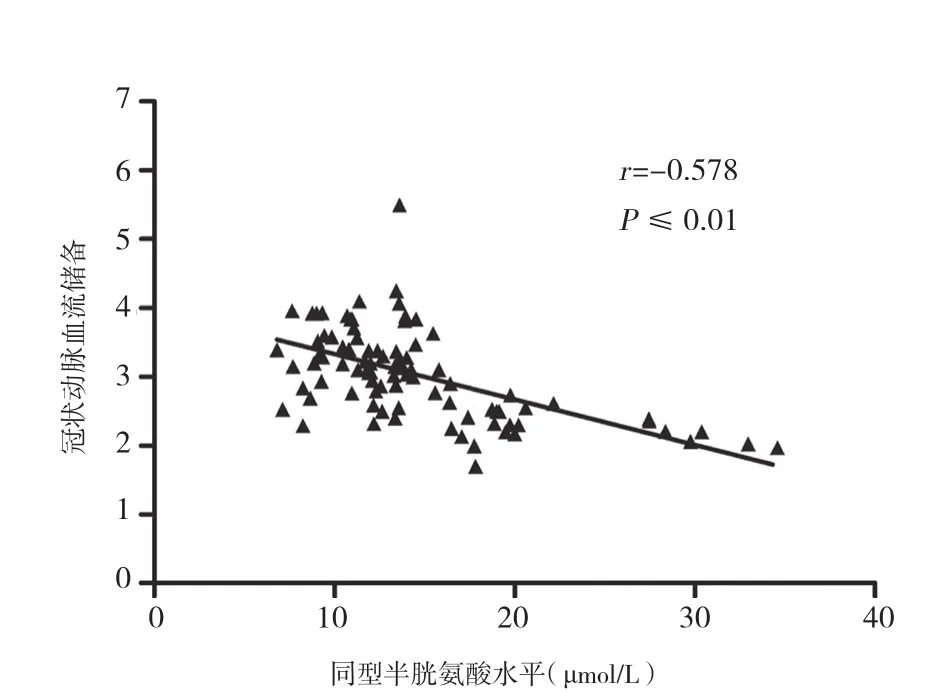
图3 同型半胱氨酸水平与冠状动脉血流储备的相关性
3 讨论
原发性高血压作为心血管疾病的危险因素,其中最重要的途径是引起血管内皮损伤。经胸超声心动图冠状动脉血流显像测定冠状动脉血流储备是一项无创性评价冠状动脉内皮功能的方法[10]。本研究显示原发性高血压患者冠状动脉血流储备水平明显降低,提示其冠状动脉内皮功能异常。多项研究显示原发性高血压可通过引起内皮eNOS结构和功能异常、一氧化氮(NO)产生减少、黏附分子产生增加及促进血管壁炎症反应等多种因素引起血管内皮损伤[6,7]。
同型半胱氨酸是由蛋氨酸脱甲基生成的一种含硫氨基酸,在本研究显示,无论是正常对照者还是原发性高血压患者,其血Hcy水平与冠状动脉血流储备均呈负相关,提示血Hcy水平越高,冠状动脉内皮功能损伤越严重。本课题组既往研究显示,同型半胱氨酸可抑制内皮一氧化氮合酶表达与磷酸化而损害患者冠状动脉内皮功能,还可增加氧化应激、炎症反应及单核细胞对内皮的粘附,促进动脉粥样硬化和胰岛素抵抗的发生发展[11-13]。其他相关研究也显示同型半胱氨酸可通过促进血管性血友病因子、单核细胞趋化蛋白-1及黏附分子表达等引起血管内皮损伤[14,15],还可诱导脂蛋白同型半胱氨酸化,导致脂蛋白向促动脉粥样硬化表型转化[16],进而引发心脑血管疾病。
长期的高同型半胱氨酸血症可以引起患者冠状动脉内皮功能损伤[12,17]。中国原发性高血压患者中约有75%合并HHcy,然而HHcy能否进一步损害高血压患者的冠状动脉内皮功能,还缺乏相关深入研究。本研究显示,相对于Hcy水平正常的原发性高血压患者,H型高血压患者的冠状动脉内皮功能损伤更为严重。
2型糖尿病患者常伴有Hcy水平升高[18],在HHcy大鼠,其空腹血糖、空腹胰岛素及胰岛素抵抗指数明显增加[19],但有些研究却未发现HHcy与胰岛素抵抗的相关性[20,21]。课题组前期动物实验显示,Hcy可诱发内质网应激、上调脂肪组织抵抗素表达,进而干扰胰岛素作用信号通路而导致胰岛素抵抗[13]。其他相关研究也显示,Hcy还可影响肝糖原合成、抑制胰岛素受体及磷脂酰肌醇-3-激酶(Phosphatidylinositol 3-kinase,PI3K)酪氨酸激酶磷酸化[22,23]。但目前对于人群中HHcy与胰岛素抵抗的关系的研究仍较少。本研究发现H型高血压患者表现出明显的胰岛素抵抗,高同型半胱氨酸血症损害高血压患者的冠状动脉内皮功能,可能与促进胰岛素抵抗等机制有关。
总之,HHcy可导致冠状动脉内皮损伤及胰岛素抵抗,当合并原发性高血压时,此种作用最为明显。高同型半胱氨酸血症损害高血压患者的冠状动脉内皮功能可能与促进胰岛素抵抗有关,因此在临床上应该重视高血压患者的同型半胱氨酸水平,并积极治疗高同型半胱氨酸血症,以期带来更多的临床获益。
[1] Clarke R, Daly L, Robinson K, et al. Hyperhomocysteinemia: an independent risk factor for vascular disease. N Engl J Med, 1991, 324:1149-1155.
[2] Wang D, Wang H, Luo P, et al. Effects of ghrelin on homocysteineinduced dysfunction and inflammatory response in rat cardiac microvascular endothelial cells. Cell Biol Int, 2012, 36: 511-517.
[3] Edirimanne VE, Woo CW, Siow YL, et al. Homocysteine stimulates NADPH oxidase-mediated superoxide production leading to endothelial dysfunction in rats. Can J Physiol Pharmacol, 2007, 85:1236-1247.
[4] Shimbo D, Muntner P, Mann D, et al. Endothelial dysfunction and the risk of hypertension: the multi-ethnic study of atherosclerosis.Hypertension, 2010, 55: 1210-1216.
[5] Gupta V, Sachdeva S, Khan AS, et al. Endothelial dysfunction and inflammation in different stages of essential hypertension. Saudi J Kidney Dis Transpl. 2011, 22: 97-103.
[6] Tousoulis D, Bouras G, Antoniades C, et al. Methionine-induced homocysteinemia impairs endothelial function in hypertensives: the role of asymmetrical dimethylarginine and antioxidant vitamins. Am J Hypertens, 2011, 24: 936-942.
[7] Matthews DR, Hosker JP, Rudenski AS, et al. Homeostasis model assessment: insulin resistance and beta-cell function from fasting plasma glucose and insulin concentrations in man. Diabetologia, 1985,28: 412-419.
[8] Yang Y, Bartel T, Li Z, et al. Assessment of coronary flow velocity reserve by noninvasive transthoracic Doppler echocardiography in patients with angiographically normal coronary arteries. J Huazhong Univ Sci Technolog Med Sci, 2005, 25: 590-593.
[9] Wang G, Dai J, Mao J, et al. Folic acid reverses hyper-responsiveness of LPS-induced chemokine secretion from monocytes in patients with hyperhomocysteinemia. Atherosclerosis, 2005, 179: 395-402.
[10] He L, Zeng H, Li F, et al. Homocysteine impairs coronary artery endothelial function by inhibiting tetrahydrobiopterin in patients with hyperhomocysteinemia. Am J Physiol Endocrinol Metab, 2010, 299:E1061-1065.
[11] Li Y, Zhang H, Jiang C, et al. Hyperhomocysteinemia promotes insulin resistance by inducing endoplasmic reticulum stress in adipose tissue.J Biol Chem, 2013, 288: 9583-9592.
[12] 薛冠华 , 张纪蔚 , 张柏根 , 等 . 同型半胱氨酸对内皮细胞分泌组织型纤溶酶原激活物及其抑制剂 -1的影响 . 中国循环杂志 , 2001, 2:144-146.
[13] Chiang JK, Sung ML, Yu HR, et al. Homocysteine induces smooth muscle cell proliferation through differential regulation of cyclins A and D1 expression. J Cell Physiol, 2011, 226: 1017-1026.
[14] Suematsu N, Ojaimi C, Kinugawa S, et al. Hyperhomocysteinemia alters cardiac substrate metabolism by impairing nitric oxide bioavailability through oxidative stress. Circulation, 2007, 115: 255-262.
[15] Vignini A, Nanetti L, Bacchetti T, et al. Modification induced by homocysteine and low-density lipoprotein on human aortic endothelial cells: an in vitro study. J Clin Endocrinol Metab, 2004, 89: 4558-4561.
[16] Emoto M, Kanda H, Shoji T, et al. Impact of insulin resistance and nephropathy on homocysteine in type 2 diabetes. Diabetes Care, 2001,24: 533-538.
[17] 薛莉, 陈树兰, 张建荣. 高同型半胱氨酸血症对急性冠状动脉综合征患病的作用及其机制探讨 . 中国循环杂志 , 2002, 3: 24-26.
[18] EmotoM, Kanda H, Shoji T, et al. Impact of insulin resistance and nephropathy onhomocysteine in type 2 diabetes. Diabetes Care. 2001,24: 533-538.
[19] Golbahar J, Aminzadeh MA, Kassab SE, et al. Hyperhomocysteinemia induces insulin resistance in male Sprague-Dawley rats. Diabetes Res Clin Pract, 2007, 76: 1-5.
[20] Godsland IF, Rosankiewicz JR, Proudler AJ, et al. Plasma total homocysteine concentrations are unrelated to insulin sensitivity and components of the metabolic syndrome in healthy men. J Clin Endocrinol Metab, 2001, 86: 719-723.
[21] Tanrikulu-Kilic F, Bekpinar S, Unlucerci Y, et al. Insulin resistance is not related to plasma homocysteine concentration in healthy premenapausal women. Physiol Res, 2006, 55: 285-290.
[22] Li Y, Jiang C, Xu G, et al. Homocysteine upregulates resistin production from adipocytes in vivo and in vitro. Diabetes, 2008, 57:817-827.
[23] Najib S, Sanchez-Margalet V. Homocysteine thiolactone inhibits insulin signaling,and glutathione has a protective effect. J Mol Endocrinol, 2001, 27: 85-91.
