糖尿病裸鼠胰腺癌神经浸润模型建立及其评价
2013-11-15李军辉马双余马清涌西安交通大学医学院第二附属医院普通外科西安70004西安交通大学医学院第一附属医院肝胆外科通讯作者mailljh99049yahoocomcn
李军辉,马双余,刘 晗,马清涌(西安交通大学医学院第二附属医院普通外科,西安 70004;西安交通大学医学院第一附属医院肝胆外科;通讯作者,E-mail:ljh99049@yahoo.com.cn)
胰腺癌是一种病死率极高的消化系统肿瘤,其发病率与死亡率几乎相等[1]。神经浸润是胰腺癌的常见现象[2],是局部复发和疼痛的重要原因,关于神经浸润的机制研究目前存在三种学说,即低阻力通道学说、癌细胞-神经相互作用学说以及神经重塑与再生学说[3],任何一种学说都不能完全解释神经浸润的发病机制。我们前期研究表明,高血糖可在体外通过对癌细胞和神经节产生不同的影响,使得癌细胞-神经之间作用加强,低阻力通道形成,从而诱发胰腺癌神经浸润的发生发展。而高血糖在体内如何诱导神经浸润的发生发展及其相应机制,目前尚不清楚。本研究通过构建糖尿病裸鼠胰腺癌坐骨神经浸润模型,阐述高血糖在体内如何诱导胰腺癌神经浸润的发生,并探讨其相关机制。
1 材料与方法
1.1 裸鼠糖尿病模型的建立
应用链脲佐菌素(STZ)按175 mg/kg剂量腹腔单次注射法构建裸小鼠糖尿病模型,造模前,先对裸鼠禁食处理12 h,不禁水,后造模。裸小鼠腹部皮肤用安尔碘消毒两次,按照每只裸鼠175 mg/kg计算用药剂量,需要STZ公式如下:所需剂量(mg)=裸鼠体重(g)×175 mg/100,按1%浓度稀释,腹腔注射。至少两次非空腹血糖≥22.2 mmol/L,即为造模成功。
1.2 裸鼠神经浸润模型的建立
选择3-5周大小去胸腺裸鼠,糖尿病和血糖正常裸鼠各6只,吸入甲氧氟烷麻醉,暴露左侧坐骨神经深达股二头肌。应用显微注射法将BXPC-3细胞注入坐骨神经的神经束膜,远端直达胫神经和腓总神经分叉处。细胞浓度为1×105/μl,应用10 μl显微注射器2 min内缓慢注入3 μl癌细胞悬液,建立坐骨神经浸润模型。左后肢同样方式注射相等量的生理盐水作为对照。每周观察裸鼠坐骨神经功能变化,第6周处死裸鼠,进行组织病理学检测。
1.3 神经功能测定
按照文献方法[4]测定坐骨神经功能,坐骨神经支配后肢掌肌群,对发生神经浸润的功能测定包括:①粗略行为:观察运动无力和反复咬后肢的表现,每周监测10 min;②肢体功能(肌力):按照观察后肢爪子对人工牵拉肢体的反应,分为4(正常)-0级(完全瘫痪);③坐骨神经功能指数:计算裸鼠第1趾和第5趾之间的伸展长度。
1.4 HE染色及免疫组化
癌细胞注射6周后,所有裸鼠麻醉后,糖尿病组和血糖正常组(各6只)两侧坐骨神经和肿瘤组织被切除用以组织病理学分析。标本分成2份,把切片放入二甲苯脱蜡3次,每次10 min;依次放入无水乙醇Ⅰ、无水乙醇Ⅱ、95%乙醇、80%乙醇中水化,每次5 min;PBS洗涤3次,每次5 min;1份用于HE染色,将切片入Harris苏木素液中1-2 min;蒸馏水冲洗5 min;1%盐酸酒精分化液分化10 s;蒸馏水冲洗5 min将切片入伊红溶液中3 s;依次酒精梯度脱水干燥(80%乙醇×1次,95%乙醇×1次,100%乙醇×2次,每次10 min)。二甲苯透明两次,每次10 min;中性树胶封片;显微镜下观察。另一份用于免疫组化染色,按试剂盒说明步骤进行NF-200免疫组化染色。
1.5 统计学方法
实验结果应用SPSS17.0统计软件包进行分析。数据应用±s进行描述,统计分析应用多个样本均数间多重比较的方差分析ANOVA进行,率的比较采用χ2检验,P<0.05为差异有统计学意义。
2 结果
2.1 糖尿病在体内诱发裸鼠坐骨神经障碍
各组裸鼠在注射后的1-2 d左右后肢均出现一定程度的活动障碍、肌力有所下降,但是1周内均恢复正常。在糖尿病组,裸鼠右侧肢体在癌细胞注射后1周开始出现肢体功能障碍,5周4只(4/6)出现完全瘫痪。而在血糖正常组,癌细胞注射2周后开始出现肢体功能障碍,5周1只(1/6)出现完全瘫痪,而左侧对照组均没有出现完全瘫痪,只是糖尿病组有轻度的活动障碍。进一步动态观察坐骨神经指数的变化以反映坐骨神经功能的受损程度,结果发现,在观察期间,糖尿病+肿瘤组最先开始出现肌力下降,且在观察终末期,更多裸鼠出现瘫痪,提示神经功能受损严重。4组坐骨神经评分(肌力)在观察第6周出现以下变化:高糖肿瘤组1.17±0.75;正常血糖肿瘤组 2.00±0.63;高糖对照组 3.67±0.52;正常血糖对照组 4.0±0.00。四组之间两两相比有明显统计学差异(图1)。
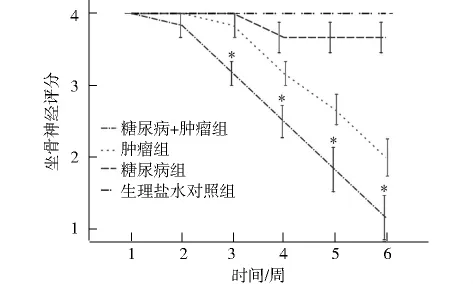
图1 不同组之间坐骨神经指数时间变化图Fig 1 Changes of sciatic nerve index after injecting the tumor cells
测量各组两侧后肢第一到第五趾之间的距离也可反映坐骨神经受损害的程度。在糖尿病组中,右侧肢体两趾之间的距离在观察过程中逐渐下降,到第6周时已明显下降,与注射后第1周比,差异有统计学意义(图2A,P<0.05),而左侧两只之间距离在6周时虽有所下降,但与注射后第1周比,差异没有明显统计学意义(图2C)。在血糖正常组,右侧肢体两趾之间的距离在观察过程中逐渐下降,到第6周时已明显下降,与注射后第1周比,有统计学差异(图2B,P<0.05),而左侧两只之间距离与第1周比基本相同,没有明显统计学意义(图2D)。绝对值进行比较发现,糖尿病右足两趾之间的距离小于血糖正常组,说明糖尿病组神经受损最为严重。在接种第6周,糖尿病+肿瘤组和血糖正常肿瘤组,均有坐骨神经指数下降,但在糖尿病+肿瘤组表现更为明显,其余两组差异无明显统计学意义。
2.2 糖尿病对肿瘤生长的影响
可见肿瘤组织大体形态呈圆形,位于坐骨神经周围,但与坐骨神经不可分离。在糖尿病组,注射部位的肿瘤直径平均为(3.75±0.93)mm,而血糖正常组平均直径为(2.75±0.50)mm,两组之间差异有明显统计学意义(P<0.05)。而在两组左下肢对照组神经结构正常,未见异物包块及粘连形成。
2.3 糖尿病使坐骨神经结构发生改变
对切除组织进行HE染色发现,两组中肿瘤组织与神经关系密切,在肿瘤部位明显膨大,癌细胞分布密集,核大不均匀(图3)。

图3 裸鼠坐骨神经肿瘤浸润组织学观察 (HE染色)Fig 3 Histology of sciatic neural invasion tissues in two groups (HE staining)
应用NF-200对切除组织进行神经纤维特异性染色,发现在肿块周边可见明显的棕黄色神经组织染色,并呈现条索状规则排列。而在肿块内部,也可见棕黄色神经组织染色,但神经已失去原有的条索状结构,而且排列紊乱,周围布满癌细胞。进一步发现癌细胞并不单纯是膨胀性生长,而是穿入神经组织中,与神经纤维交错生长(图4),说明癌细胞已进入神经组织内部,并对神经产生一定的破坏作用。
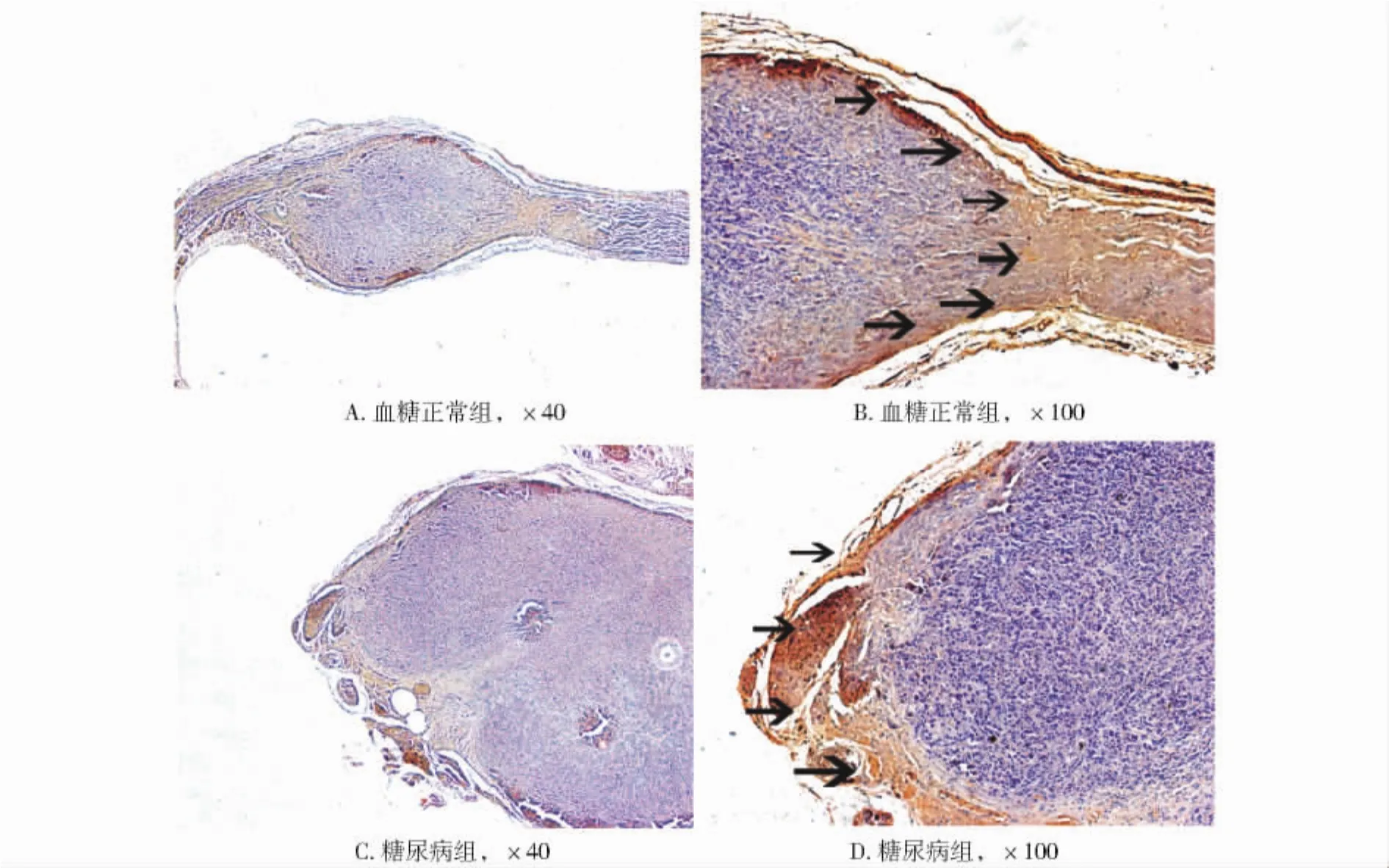
图4 裸鼠坐骨神经肿瘤浸润免疫病理学观察 (HE染色)Fig 4 Pathology of sciatic neural invasion tissues in two groups (HE staining)
3 讨论
胰腺是富含神经支配的器官。交感神经、副交感神经以及感觉神经进出胰腺支配其发挥正常的功能。在胰腺癌组织中,癌细胞与神经的关系非常密切。癌细胞可释放生物活性物质刺激胰腺内部的神经。胰腺癌有嗜神经的特性,其向神经扩散,进而黏附和侵犯神经。神经束膜是神经的保护性屏障结构,而胰腺癌可以直接破坏神经束膜[5]。有关神经浸润的发病机制存在3个学说:低阻力通道、嗜神经性以及癌细胞与神经之间的相互作用信号、神经重塑学说以及瘤神经生成学说等[6-9,3]。三种学说均参与了神经浸润的发生发展过程,可联合解释神经浸润的发病机制。
胰腺癌神经浸润模型的成功构建为胰腺癌神经浸润的研究提供了很好的方法。Poul等构建了叙利亚仓鼠诱导和原位移植胰腺癌模型[10],两种肿瘤神经浸润的发生率均达到90%。而且,肿瘤通过神经不但可以侵犯胰腺外神经丛,还可以通过神经周隙发生远处转移,如淋巴结转移。Eibl等构建了另外一种动物模型,在裸鼠胰腺原位种植肿瘤4周、6周和8周后,切除移植瘤,观察肿瘤复发情况[11]。移植6周后的胰腺癌,80%发生腹膜后神经浸润,而移植4周的胰腺癌,则没有明显复发,表明腹膜后神经转移可能发生于肿瘤晚期。这种模型对研究肿瘤的早期复发可提供有效的方法。其他研究神经浸润的动物模型包括Wistar大鼠的化学诱导前列腺癌模型,表明神经浸润发生率很高。裸鼠原位注射头颈部鳞状细胞癌神经浸润发生率可达100%[12,13]。但是,原位癌模型存在操作困难,创伤大,死亡率高的风险。

图2 各组后肢第1与第5趾之间距离比较 (n=6)Fig 2 Comparison of the distance from the first to the fifth hind limb toe (n=6)
Gil等[4]应用显微注射法将胰腺癌细胞注射到裸鼠坐骨神经束膜中,建立裸鼠坐骨神经浸润模型,观察溶瘤病毒对神经浸润的治疗情况以及神经功能的变化情况。为了进一步证明高糖的肿瘤微环境对神经的低阻力通道的影响,进而观察其在神经浸润发生发展中的作用,我们建立裸鼠糖尿病坐骨神经神经浸润模型。大体组织学结构观察发现,肿瘤对神经产生浸润性生长,而并非单纯的膨胀性生长,癌细胞深入神经内部,并与神经交错生长,而神经则排列紊乱。实验证明,将过氧化物酶注入神经内的间隙中,其可沿着神经纤维迅速扩散,并且被包绕在神经束膜中,所以,神经周隙是一种重要的间隙,其内有一个相对低阻力的通道,有利于细胞沿其迁移扩散[14]。加之神经束膜上存在有3个天然的缺损结构,即神经末梢附近、血管出入神经处以及网状纤维进入神经处。在这些缺损处,神经束膜内外的完整性被破坏,使得癌细胞沿这些缺损进入神经束膜,进而进入低阻力的神经周隙内,癌细胞在此处迁移将更加便利[15]。
再生增加的轴索则定向性地向癌细胞簇生长延伸,并与其接触,癌细胞簇则沿着轴索提供的桥梁向神经节中心迁移生长,两者之间关系紧密。这些结构对于神经浸润的发生发展是有利的。当神经浸润发生时,癌细胞并不是局限在神经周围,它可侵入神经束膜并且和轴索以及施万细胞相互作用。随着神经浸润的进一步发展,导致受累神经的进行性功能障碍,早期可表现为疼痛,晚期可发生麻痹性改变致神经功能完全丧失[4,16]。持续存在的糖尿病可使胰腺癌术后的存活率降低[17]。本研究发现,糖尿病组肿瘤生长体积更大,且很快出现神经功能障碍,导致神经功能降低,提示糖尿病科促使神经浸润的进展。
综上所述,本研究所构建的糖尿病裸鼠胰腺癌坐骨神经浸润模型,可模拟神经浸润发生的病理过程,动态观察高血糖对癌细胞及神经的影响,能够应用于胰腺癌神经浸润的体内研究,为胰腺癌神经浸润的体内研究提供新的实验载体。
[1] Jemal A,Bray F,Center MM,et al.Global cancer statistics[J].CA Cancer J Clin,2011,61:69-90.
[2] Swanson BJ,McDermott KM,Singh PK,et al.MUC1 is a counterreceptor for myelin-associated glycoprotein(Siglec-4a)and their interaction contributes to adhesion in pancreatic cancer perineural invasion[J].Cancer Res,2007,67:10222-10229.
[3] Liebig C,Ayala G,Wilks JA,et al.Perineural invasion in cancer:a review of the literature[J].Cancer,2009,115:3379-3391.
[4] Gil Z,Rein A,Brader P,et al.Nerve-sparing therapy with oncolytic herpes virus for cancers with neural invasion[J].Clin Cancer Res,2007,13:6479-6485.
[5] Bockman DE.Nerves in the pancreas:what are they for[J]?Am J Surg,2007,144:s61-64.
[6] Ceyhan GO,Bergmann F,Kadihasanoglu M,et al.Pancreatic neuropathy and neuropathic pain--a comprehensive pathomorphological study of 546 cases[J].Gastroenterology,2009,136(1):177-186.
[7] Demir IE,Ceyhan GO,Rauch U,et al.The microenvironment in chronic pancreatitis and pancreatic cancer induces neuronal plasticity[J].Neurogastroenterol Motil,2010,22(4):480-490.
[8] Ayala GE,Dai H,Powell M,et al.Cancer-related axonogenesis and neurogenesis in prostate cancer[J].Clin Cancer Res,2008,14(23):7593-7603.
[9] Entschladen F,Palm D,Niggemann B,et al.The cancer's nervous tooth:Considering the neuronal crosstalk within tumors[J].Semin Cancer Biol,2008,18(3):171-175.
[10] Pour PM,Egami H,Takiyama Y.Patterns of growth and metastases of induced pancreatic cancer in relation to the prognosis and its clinical implications[J].Gastroenterology,1991,100:529-536.
[11] Eibl G,Reber HA.A xenograft nude mouse model for perineural invasion and recurrence in pancreatic cancer[J].Pancreas,2005,31:258-262.
[12] Cabanillas R,Secades P,Rodrigo JP,et al.Orthotopic murine model of head and neck squamous cell carcinoma[in Spanish][J].Acta Otorrinolaringol Esp,2005,56:89-95.
[13] Bosland MC,Prinsen MK,Dirksen TJ,et al.Characterization of adenocarcinomas of the dorsolateral prostate induced in Wistar rats by N-methyl-N-nitrosourea,7,12-dimethylbenz(a)anthracene,and 3,20-dimethyl-4-aminobiphenyl,following sequential treatment with cyproterone acetate and testosterone propionate[J].Cancer Res,1990,50:700-709.
[14] Bock P,Hanak H.The distribution of exogenous peroxidase with the endoneural space[J].Histochemie,1971,25:361-371.
[15] Nagakawa T,Kayahara M,Ueno K,et al.Clinicopathological study on neural invasion to the extrapancreatic nerve plexus in pancreatic cancer[J].Hepatogastroenterology,1992,39:51-55.
[16] Bockman DE,Büchler M,Beger HG.Interaction of pancreatic ductal carcinoma with nerves leads to nerve damage[J].Gastroenterology,1994,107:219-230.
[17] Coughlin SS,Calle EE,Teras LR,et al.Diabetes mellitus as a predictor of cancer mortality in a large cohort of US adults[J].Am J Epidemiol,2004,159:1160-1167.
