五味子配伍对吴茱萸主成分肠吸收的影响及可能机制研究*
2013-11-13严子玲于洋何金莲候远鑫广州中医药大学中药学院广州510006
★ 严子玲 于洋* 何金莲 候远鑫 (广州中医药大学中药学院 广州510006)
中药配伍研究是方剂学研究的重点。五味子是中医临床的一味常用药,在大多方剂中作“佐”药配伍应用,即通过某种途径,增强方中其他药物的治疗作用,具有规律性。五味子散首载于宋·许叔微《普济本事方》,又名溏泄散,由五味子二两,吴茱萸半两组成[1],主治肾泄。吴茱萸为芸香科吴茱萸属植物吴茱萸(Evodia rutaecarpa(Juss.)Benth.)干燥近成熟的果实[2],所含化学成分类型较多,其中生物碱类为其主要有效成分[3]。如吴茱萸碱和吴茱萸次碱具有抗菌、抗癌、抗炎、镇痛、抗血小板聚集、抗血栓形成、体温调节和保护心脏等药理作用[4-5]。
五味子与吴茱萸的配伍研究目前少有报道,本文以吴茱萸为模型药物,以主要活性成分吴茱萸碱、吴茱萸次碱为研究对象,建立适用于吴茱萸生物碱吸收研究的大鼠原位灌注模型,研究吴茱萸生物碱在五味子提取物以及在P-pg抑制剂作用下的吸收差异。从肠吸收动力学角度揭示方剂配伍的科学本质。
1 实验材料
1.1 仪器
BT01-DG2蠕动泵(天津市协达伟业电子有限公司);Shimadzu LC-20AT高效液相色谱仪;SPDM20A二极阵列管检测器;恒温水浴锅(上海医疗器械五厂);RE-2000旋转蒸发仪(上海亚荣生化仪器厂);TG1650-WS离心机(上海卢湘仪)。
1.2 药品及试剂
吴茱萸药材(广州和翔制药有限公司,批号:121001,产地:贵州);吴茱萸碱标准品(中国药品生物制品检定所,批号:110802-200606);吴茱萸次碱标准品(中国药品生物制品检定所,批号:110801-201006);五味子提取物(实验室自制,木质素含量);维拉帕米(VP,广州市齐云生物技术有限公司);酚红(天津市福晨化学试剂厂);十二烷基硫酸钠(SDS,天津市福晨化学试剂厂);牛血清白蛋白(BSA,Genbase Bioscience Co.);乌来糖(上海润捷化学试剂有限公司)。乙腈为色谱纯,其余试剂均为分析醇。
1.3 动物
健康SD大鼠,♂,体重(250±30)g,由广州中医药大学实验动物中心提供[实验动物卫生许可证号:SCXK(粤)2008-0020]。
2 方法与结果
2.1 吴茱萸提取物的制备
精密称取吴茱萸药材100g,用10倍量80%的乙醇加热回流三次,每次3小时。合并提取液,静置过滤,减压浓缩至无醇味,离心取沉淀,真空干燥后备用。
2.2 试液配制
2.2.1 Krebs- Ringer,s(K - R) 称取 NaCl 7.8g,KCl 0.35g,CaCl20.37g,NaHCO31.37g,NaH3PO40.32g,MgCl20.02g,葡萄糖1.4g,蒸馏水定容至1L,即得到PH7.4的K-R液。
含BSA的 K-R液:精密称取 BSA 4g,置于100mL容量瓶中,加K-R液溶解,稀释定容至刻度,摇匀,得到含4%BSA的K-R液。
酚红K-R液:精密称取酚红20mg,置1 000mL容量瓶中,加K-R液溶解,稀释定容至刻度,摇匀,得到浓度为20μg/mL的酚红K-R液。
含BSA的酚红K-R液:精密称取BSA 4g,置于100mL容量瓶中,加酚红K-R液溶解,稀释定容至刻度,摇匀,得到含4%BSA的酚红K-R液。
2.2.2 肠循环液 精密称取吴茱萸醇提物100mg,置于100mL容量瓶中,加入1mLDMSO超声溶解后,称取BSA 4g加入其中,然后加入酚红K-R液,超声溶解,并室温稀释定容到刻度,摇匀,使吴茱萸醇提物的浓度为1mg/mL。
2.2.3 加五味子提取物的肠循环液 分别称取吴茱萸醇提物100mg于3支100mL容量瓶中,各加入50,100,200mg的五味子提取物,分别加入1mL DMSO超声溶解后,各称取BSA 4g加入其中,然后加入酚红K-R液,超声溶解,并室温稀释定容到刻度,摇匀即得。
2.2.4 加P-gp抑制剂的肠循环液 称取吴茱萸醇提物100mg于100mL容量瓶中,加1mL DMSO超声溶解后,称取4g BSA加入其中,然后加入酚红K-R液,超声溶解,再加入维拉帕米(0.1mg·mL-1),超声溶解后用酚红K-R液室温定容到刻度,摇匀即得。
2.3 肠循环灌流液中药物浓度的测定
2.3.1 色谱条件 色谱柱:Kromasil C18色谱柱(250mm ×4.6mm);Phenomenex C18预柱;流动相:乙腈 - 水(49∶51);流速:1.0mL/分,检测波长:吴茱萸碱225nm,吴茱萸次碱 345nm;进样量:20μL,柱温:25℃。
2.3.2 对照品溶液的制备 分别精密称取吴茱萸碱、吴茱萸次碱标准品 2.16,2.62mg,置于 50mL 容量瓶中,加入甲醇超声溶解,放置室温后用甲醇定容摇匀,为母液1。取0.5mL母液1置于2mL容量瓶中,加入含BSA的酚红K-R液0.5mL后,加甲醇至刻度摇匀,然后涡旋1分钟,沉淀过夜,次日取出6 000r离心20分钟,取上清即得吴茱萸混合对照品母液。
2.3.3 标准曲线的制备 精密吸取吴茱萸碱、吴茱萸次碱混合对照品母液适量,按数倍稀释法,用KR溶液∶甲醇(1∶3,V/V)溶液稀释,得到一系列标准工作液。在上述色谱条件下进样测定,记录色谱数据,以浓度(X)为横坐标,峰面积(Y)为纵坐标,绘制标准曲线。得回归方程:吴茱萸碱Y=7.9×10-6X -0.0045,r=0.9999,线性范围为2.1μg/mL ~10.8μg/mL;吴茱萸次碱 Y=1.7 ×10 -5X+0.0491,r=0.9999,线性范围为 2.6μg/mL ~13.1μg/mL。吴茱萸碱、吴茱萸次碱的平均回收率分别为100.52%、99.38%,RSD 分别为 2.12%、1.98%。以上结果表明,吴茱萸碱和吴茱萸次碱在各自浓度范围内呈良好线性关系并具较好的回收率。
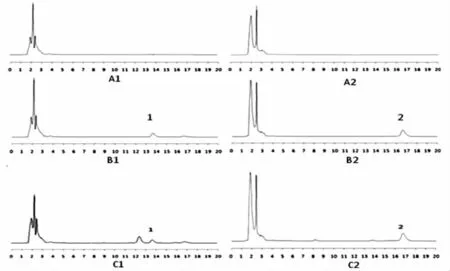
图1 HPLC图谱
2.3.4 样品的处理 精密吸取肠灌流液0.5mL,加1.5mL甲醇,涡旋混合1分钟,放置冰箱沉淀过夜,次日6 000r/分钟离心20分钟,取上清液过0.45μm微孔滤膜。在上述色谱条件下进行分析。
2.3.5 精密度实验 精密吸取对照品母液5μL,连续进样6次,测定吴茱萸两碱的峰面积值,其RSD为0.18%(n=6),表明仪器精密度良好。
2.3.6 稳定性试验 用空白肠循环液配1mg/mL的吴茱萸醇提物溶液,置37℃水浴锅中,并于0,2,4,6h测定溶液中的吴茱萸两碱含量,其RSD值为0.52%(n=7),显示吴茱萸醇提物中2种有效成分在空白肠循环液中具有较好的稳定性。
2.4 大鼠原位肠循环实验
2.4.1 大鼠原位肠循环实验方法[6]
取实验前禁食12h(自由饮水)的SD大鼠,腹腔注射乌拉坦0.6mL/100g,麻醉后固定。沿腹中线打开腹腔(约2.5cm),结扎胆总管,在实验肠管两端各切一小口,在上端小口处插入直径为0.3cm的玻璃管,并用线扎紧。用注射器将37±0.5℃的生理盐水缓缓注入肠管,洗去肠管内容物至净。然后在实验肠管下端小口处插入玻璃管,并用线扎紧。将肠管两端的玻璃管与蠕动泵的胶管连接,形成回路,开动蠕动泵。以5mL/分流速循环10分钟后,将流速调节为2.5mL/分,立即自装有灌注液的锥形瓶中取样lmL,作为测定零时间药物浓度和酚红浓度的样品,另向锥形瓶中补加酚红K-R液lmL,其后每隔20分钟亦按同法取样并补加酚红K-R液,循环3小时后,中止实验。
2.4.2 原位肠灌流实验法中参数计算[7]
以小肠内剩余药量的对数(lnX)对取样时间t作图,由直线斜率求出吸收速率常数Ka(h-1)∶Ka=(InX0-InX)/t。剩余药量 X=CV(C为测得的药物浓度,V为相应时间的循环液体积)。表现渗透系数Papp:药物透过胃肠道粘膜的表观渗透系数Papp,单位为 cm/s。A为小肠吸收面积(cm2)。Papp=Ka/A/3600。
2.4.3 灌流液中酚红浓度的测定
由于肠灌流的过程中不但有水的吸收,还有水的分泌,导致循液的体积发生变化,通过对酚红浓度的测定来校正水的吸收。用空白肠灌流液加入酚红配制一系列标准液,取上述不同浓度的酚红溶液各0.5mL,加入 4.5mL,1.0mol/L 的 NaOH 溶液显色,于400~800nm波长范围内进行扫描在558nm处酚红有最大吸收,因此于558nm处测定酚红的吸光度。以吸光度A为纵坐标(Y)、酚红浓度(μg/mL)为横坐标(X),绘制标准曲线。得回归方程:Y=4.4596X -0.0396,r=0.9988,线性范围为 8.88μg/mL ~31.08μg/mL,RSD 为2.31,平均回收率为100.56%。
2.5 实验结果
2.5.1 P-gp抑制剂对吴茱萸总生物碱肠吸收的影响
按照“2.2.2”配制浓度为 1mg/mL 吴茱萸醇提物作为对照组溶液,另取1mg/mL吴茱萸醇提物溶液加入维拉帕米(0.1mg/mL)作为维拉帕米组溶液。取SD大鼠10只,按照“2.4.1”的实验步骤进行原位肠循环灌注,定时取样,测定各时间点的吴茱萸碱、吴茱萸次碱的浓度,然后按照“2.4.2”计算其Ka、Papp,结果见表 1。
表1 P-gp抑制剂对吴茱萸生物碱肠吸收动力学参数(±s,n=5)
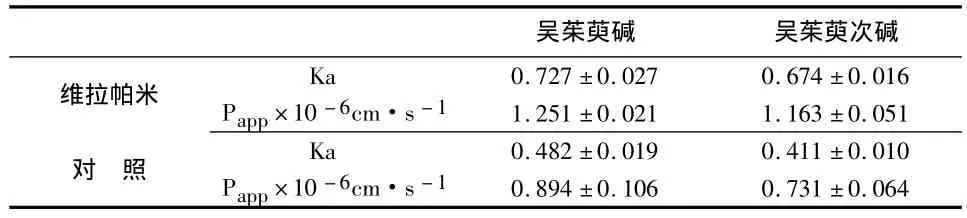
表1 P-gp抑制剂对吴茱萸生物碱肠吸收动力学参数(±s,n=5)
吴茱萸碱 吴茱萸次碱维拉帕米 Ka 0.727 ±0.027 0.674 ±0.016 Papp×10-6cm·s-11.251 ±0.021 1.163 ±0.051对 照Ka 0.482 ±0.019 0.411 ±0.010 Papp×10-6cm·s-10.894 ±0.106 0.731 ±0.064
2.5.2 不同浓度五味子提取物对吴茱萸生物碱肠吸收研究
按照“2.2.3”分别配制加高、中、低浓度五味子提取物的肠流液作为供试品溶液。取SD大鼠15只,随机分成三组,按照“2.4.1”的实验步骤进行原位肠循环灌注,定时取样,测定各时间点的吴茱萸碱、吴茱萸次碱的浓度,然后按照“2.4.2”计算其Ka、Papp,结果见表 2。
表2 不同浓度五味子提取物对吴茱萸生物碱肠吸收动力学参数(±s,n=5)
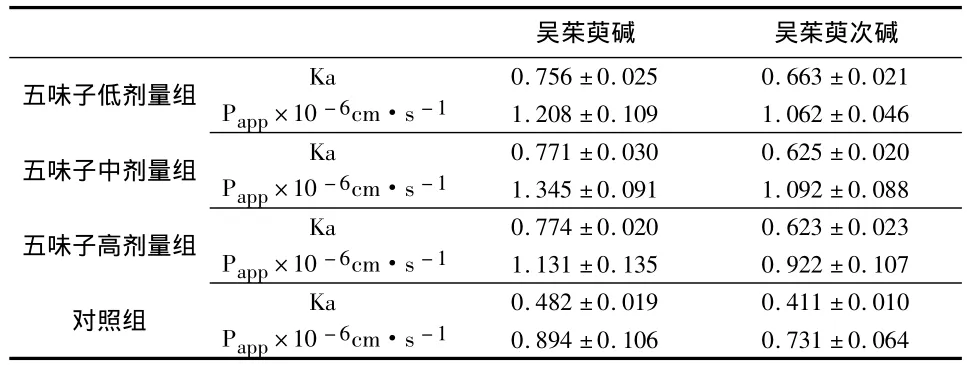
表2 不同浓度五味子提取物对吴茱萸生物碱肠吸收动力学参数(±s,n=5)
吴茱萸碱 吴茱萸次碱五味子低剂量组 Ka 0.756 ±0.025 0.663 ±0.021 Papp×10-6cm·s-11.208 ±0.109 1.062 ±0.046五味子中剂量组Ka 0.771 ±0.030 0.625 ±0.020 Papp×10 -6cm·s-1 1.345±0.091 1.092±0.088五味子高剂量组Ka 0.774 ±0.020 0.623 ±0.023 Papp×10 -6cm·s-1 1.131±0.135 0.922±0.107对照组Ka 0.482 ±0.019 0.411 ±0.010 Papp×10-6cm·s-10.894 ±0.106 0.731 ±0.064
由以上各表可知,加入P-gp抑制剂维拉帕米(VP)与正常组相比,吴茱萸碱和吴茱萸次碱的吸收速率常数(Ka)和表观渗透系数(Papp)都显著增加(P<0.05)。这种吸收促进作用是通过抑制P-gp外排而起作用的,提示吴茱萸碱、吴茱萸次碱可能是P-gp底物。加入五味子提取物与正常组相比,吴茱萸碱和吴茱萸次碱的吸收速率常数(Ka)和表观渗透系数(Papp)都显著增加(P<0.05);但在考察的五味子浓度范围以内,高中低浓度组组间对比,吸收速率常数(Ka)和表观渗透系数(Papp)却没有显著差异(P >0.05)。
3 讨论
小肠是口服药物的主要吸收部位,药物的肠吸收在一定程度上能够反映口服后的整体吸收情况。大鼠原位肠灌流模型能够反映肠道的真实环境,排除肝脏的首过效应和药物在肠壁组织中的代谢等生物转化,与人体实验相关性良好[8-9],并且具有良好的可操控性,简便,快速,准确,在国内外药物研究中已得到广泛应用。但该法也有局限性,药物必须以水溶液状态存在。吴茱萸中的Evo和Rut水溶性均不好,因此考虑加入BSA,起到助溶作用。
目前关于五味子和吴茱萸的相互作用机制方面的研究不是很多,有文献报道[10-11]吴茱萸某些成分可能为P-gp底物。通过本实验结果初步推测五味子有效成分[12]和吴茱萸两碱可能都为P-gp底物,在大鼠小肠,五味子提取物竞争性作用于P-gp,从而抑制了P-gp对吴茱萸两碱的外排作用。加入P-gp抑制剂组吴茱萸两碱的吸收有所增加,与文献报道的结果不相符[13],可能是由于所用模型不一样所致。大鼠原位肠灌流实验操作虽然简单,但随机因素太多,还需用细胞吸收模型进一步确证。
[1]李冀,杜雅薇,邹大威,等.五味子散与四神丸对脾虚泄泻作用的配伍比较研究[J].陕西中医,2007,28(7):915.
[2]中华人民共和国卫生部药典委员会.中华人民共和国药典.一部[S].北京:人民卫生出版社,2010:160.
[3]龚慕辛,王智民,张启伟,等.吴茱萸有效成分的药理研究进展[J].中药新药与临床药理,2009,20(2):183.
[4]袁少锋.吴茱萸研究概况[J].时珍国医国药,2000,11(3):281.
[5]龚慕辛,宋亚芳,王智民,等.吴茱萸化学成分的研究[J].中国中药杂志,2009,34(6):792.
[6]LUB.Experiments of Pharmaceutics[M],Beijing:People’s Medical Publishing House,1994:131 -135.
[7]李珂佳,蒋学华.大鼠原位灌注模型研究靛玉红吸收机制[J].中国药学杂志,2007,42(17):1 306.
[8]Fagerholm U,Johansson M,Lennnernas H.Comparison between permeability coefficients in rat and human jejunum [J].Pharm Res,1996,13(9):1 336.
[9]Zakeri- Milani P,Valizadch H,Tajerzadeh H,et al.Predicting human intestinal permeability using single-pass intestinal perfusion in rat[J].J Pharm Pharm Sci,2007,10:368.
[10]邹丽娟,陈颖,杨庆,等.吴茱萸对黄连生物碱在大鼠肠道吸收中的影响研究[J].中国实验方剂学杂志,2012,18(8):147-151.
[11]黄雪君.黄连吴茱萸药对在药物吸收模型上的生物表达研究[D].广州:广州中医药大学,2011:60.
[12]贝煜,于洋,黎同明.大鼠在体肠灌注研究五味子有效成分肠吸收[J].亚太传统医药,2011,7(12):35.
[13]董宇,张英丰,杨庆,等.制吴茱萸提取物在肠外翻中的吸收研究及与P-gp的关系[J].世界科学技术——中医药现代化思路与方法,2008,10(2):63 -68.
