MRI常规序列结合DWI在直肠癌术前分期中的价值
2013-11-13商增全
商增全
(山东省广饶县人民医院,山东 广饶 257300)
直肠癌是我国常见的一种消化道恶性肿瘤。MRI对直肠癌的分期判断最为准确,其判断肠壁浸润程度的能力和直肠内超声接近,优于CT[1]。DWI有利于病变的检出、定性,可早期评价直肠癌术前放化疗疗效。现对23例直肠癌患者行MRI常规扫描和DWI检查,旨在评估1.5TMR常规序列结合DWI在直肠癌诊断中的价值。
1 资料与方法
1.1 一般资料 收集2011年11月~2013年1月我院直肠癌患者23例,其中男15例,女8例;年龄42~77岁,平均(57.4±10.3)岁。所有患者均于MRI检查前行结肠镜活检并经组织病理学证实,最终结果经手术及术后病理证实。其中12例为高分化腺癌,9例中分化腺癌,2例低分化腺癌。
1.2 MRI检查 所有患者行 MRI扫描前10~15min均肌注山莨菪碱20mg,未作清洁肠道准备。应用GE SIGNA 1.5TMR仪,4通道体部相控阵线圈,行全盆腔扫描。常规序列包括:轴位FSE T2WI,轴位 SE T1WI,矢状位FSE T2WI,冠状位FSE T2WI。T1WI及T2WI均为非抑脂序列,小视野成像。
1.3 DWI成像 采用轴位成像,应用单次激发SE-EPI,并采用 ASSET技术,b值=800s/mm2。
2 结果
23例中低位直肠癌12例,中位6例,高位5例。T1~2期6例,肿瘤局限于直肠壁内;T3期肿瘤11例,其中环周切缘(circumferential resection margin,CRM)阴性5例,表现为肿瘤位于直肠筋膜内,且与筋膜距离大于1mm(见图1~3),CRM阳性6例,表现为肿瘤与筋膜距离小于1mm(见图4~6);T4期肿瘤6例,表现为肿瘤累及周围结构,盆壁、阴道、精囊腺、前列腺等。N0期5例,盆腔内未见淋巴结转移;N1期8例,表现为直肠周围1~3个淋巴结转移(见图3);N2期7例,表现为直肠周围4个或4个以上淋巴结转移(见图6);N3期3例,表现为髂血管周围多发淋巴结。以上部分淋巴结短径<5mm。21例T2WI显示直肠壁不均匀增厚,其中17例局部肿块,T2WI呈稍高信号,DWI呈明显高信号;2例T2WI示直肠壁未见明显增厚或异常信号,DWI呈稍高信号。T3期肿瘤且CRM阳性及T4期肿瘤12例中,DWI呈明显高信号,8例ADC值低于1.00×10-3mm2/s,放化疗效果明显;4例ADC值高于1.00×10-3mm2/s,放化疗效果差。
3 讨论
3.1 检查前准备工作 ①无需清洁肠道。②检查前肌注山莨菪碱20mg或静脉注射胰高血糖素1mg,抑制胃肠蠕动和降低肠壁张力,最大限度减少肠道运动产生的伪影[2]。③肠镜或其他肠道检查后,避免立即行直肠MRI。④直肠MRI检查通常无需肠道对比剂。Brown等[3]主张无需行肠道准备,也无需注气或注水,仅行T1WI和T2WI薄层扫描即可较好显示肿瘤外侵情况。
3.2 MRI扫描序列的选择 ①常规小视野非抑脂FSE T2WI,SE T1WI序列。直肠周围富含脂肪,因此脂肪是直肠区域天然的对比剂。抑脂序列降低了对比,不利于解剖细节的观察和分期的判断,淋巴结内部信号对比度差。②首先扫描矢状位,在矢状位上制定轴位扫描计划,轴位垂直于肿瘤所在位置的直肠壁,冠状位垂直于轴位。③轴位DWI。
3.3 MRI对直肠癌的T、N分期 ①直肠癌T分期:T1、T2期肿瘤局限于直肠壁内;T3期肿瘤位于直肠筋膜内或与筋膜距离大于1mm;T4期肿瘤累及周围器官和结构。饶圣祥等[4]认为高分辨力MRI判断直肠癌T分期总的诊断符合率为85.1%。MRI不能区分黏膜下肿瘤与累及肌层的肿瘤,因此,MRI不能区分T1、T2期肿瘤,而且也不必区分,因为大多数情况下T1~2期肿瘤行全直肠系膜切除术(total mesorectal excision,TME)治疗。少数患者T1期可以局部切除。这些浅表肿瘤直肠内超声可以准确分期。②直肠癌N分期:N0,无淋巴结转移;N1,直肠周围1~3个淋巴结转移;N2,4个或4个以上淋巴结转移;N3,转移性淋巴结沿血管树分布。淋巴结分期在肿瘤局部复发判断中具有重要作用。MRI对淋巴结转移的敏感性和特异性较差,当淋巴结短径>5mm,边缘模糊、呈毛刺状,信号不均匀时,高度提示淋巴结转移,但并不是所有转移性淋巴结都具有这一特性。
3.4 MRI对直肠癌CRM的评价 从肿瘤部位或转移淋巴结到直肠盆筋膜脏层的最短距离称为CRM,这是局部复发最有力的检测信号。MRI可以非常准确地判断CRM。
3.5 直肠癌MRI术前分期的临床意义 目前直肠癌的MRI研究主要集中于术前分期[5-8]。直肠癌患者直接行TME还是需术前放化疗主要根据直肠系膜受累情况来决定。直肠系膜是指包绕直肠周围的所有脏层和壁层腹膜之间的脂肪结缔组织、血管、神经和淋巴组织[9]。TME切除范围包括受累直肠、周围系膜脂肪、淋巴结及直肠系膜筋膜,是直肠癌患者最好的术式,特别是中下部直肠癌患者,可以降低局部复发率至10%以下[10],降低死亡率至9%~16%[11]。TME最大限度地减少了肿瘤残留。通过直肠癌MRI术前分期评估患者是直接行TME还是需术前行新辅助放化疗,对降低术后局部复发率具有重要意义。MRI对直肠癌分期的判断最为准确。Brown等[12]认为,高分辨力 MRI可以对肿瘤本身、肠壁外的浸润、淋巴结转移、直肠系膜筋膜受累和血管浸润等多个预后危险因素进行准确评估。
3.6 DWI在直肠癌检查中的意义 DWI作为功能成像方法,利用对水分子微观运动成像反映组织内部结构和病理生理学的变化,提高了对病变的检出敏感性以及提供机体功能改变的信息。DWI可以从分子水平获取组织超微结构,因此可区分各种组织[13],在急性脑梗死的诊断中具有重要的临床应用价值[14]。但是由于腹盆腔器官的生理性运动易产生运动伪影、较低的图像分辨力和低SNR等原因,限制了DWI在腹盆腔成像的应用。并行采集ASSET技术的发展,降低了磁敏感伪影和化学伪影,提高了图像的SNR,改善了图像质量[15]。Hosonuma等[16]及Ichikawa等[17]均报道了高 b值DWI对直肠肿瘤的诊断具有较高的敏感性和特异性。DWI有别于CT和常规MRI的主要优势之一是它能够突出病变,抑制无意义的组织信号,提高了病变的检出率,更容易发现直肠系膜中的淋巴结,特别是直径小于5mm的转移性淋巴结,表现为DWI高信号。大多数直肠癌转移的淋巴结直径小于5mm[18],不容易被发现,容易漏诊及过低分期。DWI通过显示肿瘤组织内水分子弥散运动的改变,可以区分存活及坏死的肿瘤组织,有助于早期评价治疗的疗效和优化治疗方案。有效的抗肿瘤治疗会导致肿瘤细胞坏死、数目减少,细胞间隙增大,细胞膜破裂,细胞内细胞器碎裂、溶解,导致水分子弥散能力增强,ADC值升高;而肿瘤残存或复发使肿瘤细胞增多,细胞间隙变小,限制了水分子的运动,ADC值降低,表现为DWI升高,这种变化通常在1周内即能检测到。此外,治疗前ADC值较高的肿瘤治疗效果往往不如治疗前ADC值较低的肿瘤理想。本研究显示,术前病灶 ADC值低于1.0×10-3mm2/s时,放化疗效果明显,表现为体积缩小,病灶ADC值升高;术前病灶ADC值大于1.0×10-3mm2/s时,放化疗效果差,表现为病灶形态、大小及ADC值无明显改变。
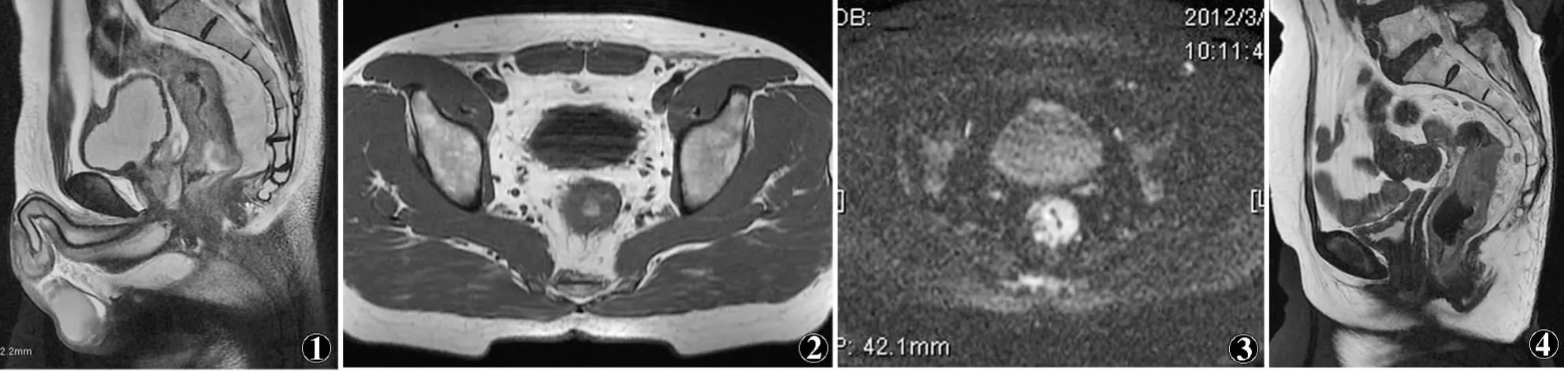
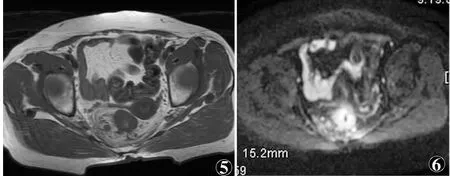
图1~3 同一患者,高中位直肠癌,肿瘤分期T3N1期,环周切缘(CRM)阴性图1 矢状位FSE T2WI示肿瘤环壁浸润,肠腔狭窄图2 轴位SE T1WI示肿瘤右前壁直肠系膜内浸润,表现为条索状低信号 图3 轴位DWI肿瘤及左侧直肠系膜内2个淋巴结呈高信号,环周切缘大于1mm 图4~6 同一患者,中位直肠癌,肿瘤分期T3N2期,CRM阳性 图4 矢状位FSE T2WI示肿瘤位于后壁,局部软组织肿块,直肠系膜内淋巴结肿大 图5 轴位SE T1WI示肿瘤右侧直肠系膜内浸润,并见肿大淋巴结,环周切缘小于1mm 图6 轴位DWI示肿瘤及周围淋巴结DWI高信号,直肠系膜内淋巴结大于4枚
综上所述,MRI常规序列是直肠癌诊断及T、N分期的主要方法,DWI具有疗效评估、辅助诊断的重要作用,是常规序列的必要补充。本研究例数少,随访时间短,还需扩充例数,进一步观察研究。
[1]Hadfield MB,Nicholson AA,MacDonald AW,et al.Preoperative staging of rectal carcinoma by magnetic resonance imaging with a pelvic phased-array coil[J].Br J Surg,1997,84:529-531.
[2]施展,陈腾,韩峰,等 .结直肠肿瘤MRI的临床价值[J].同济大学学报:医学版,2006,27(2):41-45.
[3]Brown G,Richards CJ,Newcombe RG,et al.Rectal carcinoma:thinsection MR imaging for staging in 28patients[J].Radiology,1999,211:215-222.
[4]饶圣祥,曾蒙苏,陈财忠,等 .直肠癌T分期高分辨MRI技术应用及其病理对照研究[J].放射学实践,2007,22(2):124-127.
[5]Iafrate F,Laghi A,Paolantonio P,et al.Preoperative staging of rectal cancer with MR Imaging:correlation with surgical and histopathologic findings[J].Radiographics,2006,26:701-714.
[6]Kim SH,Lee JM,Lee MW,et al.Diagnostic accuracy of 3.0-Tesla rectal magnetic resonance imaging in preoperative local staging of primary rectal cancer[J].Invest Radiol,2008,43:587-593.
[7]翟鸣春,靳二虎.MRI在直肠癌诊断及术前分期中的价值探讨[J].中国CT和 MRI杂志,2009,7(3):55-57.
[8]顾乐锋,李建策,翁晓海,等.DWI和常规序列结合在直肠癌诊断和分期中的价值[J].医学影像学杂志,2013,23(5):738-741.
[9]黄勇波,张卓军,陈恩碧,等 .应用染色法行全直肠系膜切除根治直肠癌[J].右江医学,2004,32(4):341-342.
[10]Kapiteijn E,Marijnen CA,Nagtegaal ID,et al.Preoperative radiotherapy combined with total mesorectal excision for resect-able rectal cancer[J].N Engl J Med,2001,345:638-646.
[11]Goh V,Halligan S,Bartram CI.Local radiological staging of rectal cancer[J].Clin Radiol,2004,59:215-226.
[12]Brown G,Radcliffe AG,Newcombe RG,et al.Preoperative assessment of prognostic factors in rectal cancer using high-resolution magnetic resonance imaging[J].Br J Surg,2003,90:355-364.
[13]Le Bihan D.Molecular diffusion,tissue microdynamics and microstructure[J].NMR Biomed,1995,8:375-386.
[14]Rovira A,Rovira-Gols A,Pedraza S,et al.Diffusion-weighted MR imaging in the acute phase of transient ischemic attacks[J].AJNR Am J Neuroradiol,2002,23:77-83.
[15]Kurihara Y,Yakushiji YK,Tani I,et al.Coil sensitivity encoding in MR imaging:advantages and disadvantages in clinical practice[J].AJR Am J Roentgenol,2002,178:1087-1091.
[16]Hosonuma T,Tozaki M,Ichiba N,et al.Clinical usefulness of diffusion-weighted imaging using low and high b-values to detect rectal cancer[J].Magn Reson Med Sci,2006,5:173-177.
[17]Ichikawa T,Erturk SM,Motosugi U,et al.High-B-value diffusion-weighted MRI in colorectal cancer[J].AJR Am J Roentgenol,2006,187:181-184.
[18]Monig SP,Baldus SE,Zirbes TK,et al.Lymph node size and metastatic infiltration in colon cancer[J].Ann Surg Oncol,1999,6:579-581.
