45 ℃ Na2SO4-MgSO4-H2O三元水盐体系相平衡研究
2013-11-12刘宝树宋梦燕史轩轩
刘宝树,何 岩,孙 华,宋梦燕,史轩轩
(1.河北科技大学化学与制药工程学院,河北石家庄 050018;2.河北省药物化工工程技术研究中心,河北石家庄 050018)

文献[6]已经报道0,10,25,30,35,50,75,100 ℃时该体系的溶解度数据,尚未见报道45 ℃时该体系的溶解度数据。因此,笔者利用湿固相法[7],测定了Na2SO4-MgSO4-H2O三元水盐体系在45 ℃时的固液相平衡关系,测出该体系的溶解度数据,并绘制了相图,为系统研究提供理论依据。
1 实验部分
1.1 试剂和仪器
试剂:七水硫酸镁,硫酸钠,三乙醇胺,氨-氯化铵缓冲溶液(pH值约为10),铬黑T,甲基红指示液,EDTA标准溶液(0.0213 8 mol/L),2 mol/L的盐酸,氯化钡,以上试剂均为分析纯。
仪器:SHZ-82A水浴恒温振荡器,金坛市恒丰仪器厂提供;FA2004B型分析天平,岛津仪器有限公司提供;101-2AB型电热鼓风干燥箱,天津市泰斯特仪器有限公司提供;SHB-Ⅲ型循环水式多用真空泵,郑州长城科工贸有限公司提供;YP1201N型电子天平,上海精密科学仪器有限公司提供。
1.2 实验过程
1.2.1 确定体系达到相平衡所需要的时间[8]
每隔1天,取液相分析其中的Mg2+含量组成,当前后连续2次的含量相差不大于0.5%时即认为体系达到了平衡[9]。该体系达到平衡的时间是7 d。
1.2.2 配样
用分析天平精确称量硫酸钠、七水硫酸镁和水,按不同的比例配制不同组成的硫酸钠、七水硫酸镁和水的混合物,放入各个试剂瓶中,然后将其放入恒温水浴振荡器中振荡以达平衡[5]。恒温水浴振荡器温度波动小于±0.1 ℃。
1.2.3 取样[10-13]

1.3 分析方法
1.3.1 Mg2+测定方法:EDTA滴定法[14]
原理:用NH3-NH4Cl的缓冲溶液调节pH值,使溶液呈碱性,加入铬黑T,铬黑T能与Mg2+形成配位化合物并溶解在溶液中。滴加EDTA时,EDTA也能和Mg2+形成化合物,且稳定性大于铬黑T和Mg2+形成的化合物。因此,EDTA能抢夺铬黑T络合的Mg2+,使铬黑T离子游离出来,溶液由酒红色变为蓝色。
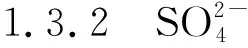

1.3.3 Na+测定方法:差减法

2 结果与讨论
2.1 Na2SO4-MgSO4-H2O三元水盐体系的固液平衡数据
利用等温法测定45 ℃时Na2SO4-MgSO4-H2O三元水盐体系的溶解度,应用湿固相法确定固相的组成,结果见表1。

表1 三元体系Na2SO4-MgSO4-H2O 45 ℃时固液平衡数据
注:M7为MgSO4·7H2O;Ast为Na2SO4-MgSO4-4H2O。
2.2 Na2SO4-MgSO4-H2O三元水盐体系相图的绘制与分析
根据固液平衡数据,利用直角等腰三角形表示法,绘制45 ℃时Na2SO4-MgSO4-H2O三元水盐体系相图,见图1。
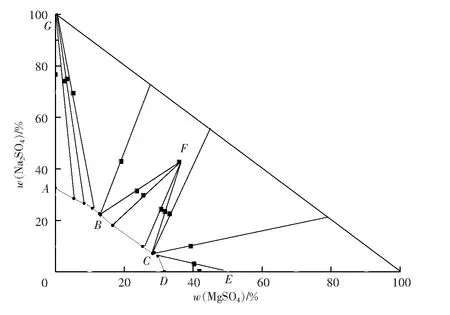
图1 Na2SO4-MgSO4-H2O三元水盐体系相图Fig.1 Phase diagram of Na2SO4-MgSO4-H2O ternary system
由图1可知,45 ℃时该三元体系Na2SO4-MgSO4-H2O属于复杂体系,溶解度等温图中含有复盐Na2SO4·MgSO4·4H2O,属于生成同成分复盐相图;存在纯Na2SO4的结晶,还存在Na2SO4和复盐Na2SO4·MgSO4·4H2O的混晶、复盐Na2SO4·MgSO4·4H2O的结晶、复盐Na2SO4·MgSO4·4H2O和MgSO4·7H2O的混晶以及MgSO4·7H2O的结晶。其等温图中,由3条饱和溶解度曲线组成,分别是曲线AB为Na2SO4的饱和溶解度曲线,曲线BC为Na2SO4·MgSO4·4H2O的饱和溶解度曲线,曲线CD为MgSO4的饱和溶解度曲线。所对应的3个结晶区分别为Na2SO4结晶区、Na2SO4·MgSO4·4H2O结晶区和MgSO4·7H2O结晶区。
该体系的相图中有2个共饱和点,B点为相称共饱和点,其液相组成中MgSO4的质量分数为13.15%,Na2SO4的质量分数为21.96%,所对应的平衡固相为Na2SO4·MgSO4·4H2O+Na2SO4;C点亦为相称共饱和点,其液相组成中MgSO4的质量分数为28.24%,Na2SO4质量分数为7.07%,所对应的平衡固相为Na2SO4·MgSO4·4H2O+MgSO4·7H2O。相图中,Na2SO4对MgSO4有明显的盐析作用。D点MgSO4的浓度(质量分数)为31.66 %,而共饱和点B处MgSO4的浓度(质量分数)为13.15%。
从图1可以看出,相图分为5个区域,ABG为纯Na2SO4的结晶区,BFG为Na2SO4和复盐Na2SO4·MgSO4·4H2O的结晶区,BCF为复盐Na2SO4·MgSO4·4H2O的结晶区,CEF为复盐Na2SO4·MgSO4·4H2O和MgSO4·7H2O的结晶区,CDE为MgSO4·7H2O的结晶区。
3 结 语
1)利用等温法测定了45 ℃时Na2SO4-MgSO4-H2O三元水盐体系的溶解度数据,应用湿固相法确定固相的组成,此三元水盐体系属于复杂体系相平衡,既存在纯物质的结晶,又有复盐Na2SO4·MgSO4·4H2O产生。
2)根据溶解度数据绘制了相图,相图分为5个结晶区域,包括纯Na2SO4的结晶区、Na2SO4和复盐Na2SO4·MgSO4·4H2O的结晶区、复盐Na2SO4·MgSO4·4H2O的结晶区、复盐Na2SO4·MgSO4·4H2O和MgSO4·7H2O的结晶区以及MgSO4·7H2O的结晶区。
参考文献/References:
[1] 狄平宽,单忠健.煤矿废水的环境污染及其控制方法[J].环境工程,1989,7(1):14-17.
DI Pingkuan, SHAN Zhongjian. Environmental pollution and its control method of coal mine waste water[J]. Environmental Engineering, 1989, 7(1):14-17.
[2] 刘志勇,陈建中.酸性矿山废水的处理研究[J].云南环境科学,2004,23(sup):152-156.
LIU Zhiyong, CHEN Jianzhong. The processing research of acid mine drainage [J]. Yunnan of Environmental Sciences, 2004, 23(sup):152-156.
[3] 邹知华.加强矿山环境保护 促进矿山持续发展[J].中国矿业,1994(2):9-13.
ZOU Zhihua. Promote the continued development of the mines to strengthen environmental protection in mining[J]. China Mining, 1994(2):9-13.
[4] 赫佐格·D J.如何评价矿山废弃物对地下水和地表水的潜在影响[J].国外金属矿山,1997(2):57-60.
HEZUOGE D J. How to evaluate the potential impact of the mine waste to groundwater and surface water[J]. Metal Mines Abroad, 1997(2):57-60.
[5] 金 涌,董丽华,赵凤云.循环经济与科学技术[J].河北科技大学学报,2004,25(4):1-6.
JIN Yong, DONG Lihua, ZHAO Fengyun.Science and technology in circular economy[J]. Journal of Hebei University of Science and Technology, 2004, 25(4):1-6.
[6] 牛自得, 程芳琴, 李宝存. 水盐体系相图及其应用[M].天津: 天津大学出版社, 2002.
NIU Zide, CHENG Fangqin, LI Baocun. The Salt-Water System Phase Diagram and Its Application[M]. Tinjin: Tianjin University Press, 2002.
[7] 王 伟,赵焕祺.苛化联产草酸生产中有关体系溶解度数据的研究[J].河北轻化工学院学报,1991,12(1):74-76.
WANG Wei, ZHAO Huanqi. The system solubility data causticizing associated oxalic acid production[J]. Journal of Hebei University of Light Chemical Engineering, 1991,12(1):74-76.
[8] 王卫东,左 芳.298 K 时NaCl- (NH4)2SO4-H2O三元水盐体系相平衡研究[J].无机盐工业,2009,41(1):15-17.
WANG Weidong, ZUO Fang. Study on phase equilibrium of NaCl-(NH4)2SO4-H2O ternary system at 298 K[J]. Inorganic Chemicals Industry, 2009, 41(1):15-17.
[9] 翁延博,王静康.五元体系Na+,K+,Mg2+// Cl-,Br--H2O 313 K相平衡研究[D].天津:天津大学,2008.
WENG Yanbo, WANG Jingkang. Study on phase equilibria of the quinary system Na+, K+, Mg2+//Cl-, Br--H2O at 313 K[D]. Tianjin:Tianjin University,2008.
[10] 任宝山,李志广.25 ℃ KCl-NH4Cl-H2O三元体系相平衡的研究[J].河北工业大学学报,2000,29(6):1-3.
REN Baoshan, LI Zhiguang. The study on ternary system phase equilibrium of KCl-NH4Cl-H2O 25 ℃[J]. Journal of Hebei University of Technology, 2000, 29(6):1-3.
[11] 吕早生,丁芳芳,唐 佳,等.50 ℃时(NH4)2SO4-NH4NO3-H2O三元体系相图研究[J].化学与生物工程,2010,27(1):41- 43.
LUV Zaosheng, DING Fangfang, Tang Jia, et al. Study of phase diagram of ternary system (NH4)2SO4-NH4NO3-H2O at 50 ℃[J]. Chemistry and Bioengineering, 2010, 27(1):41-43.
[12] 李入林,叶红勇.25 ℃ NaNO3-H3BO3-H2O三元体系相平衡研究[J].无机盐工业,2012,44(6):31-33.
LI Rulin, YE Hongyong. Phase equilibrium of NaNO3-H3BO3-H2O ternary system at 25 ℃[J]. Inorganic Chemicals Industry, 2012, 44(6):31-33.
[13] 桑世华,殷辉安,唐明林.K2CO3-Na2CO3-H2O三元体系288 K相平衡研究[J].无机盐工业,2003,35(1):23-25.
SANG Shihua, YIN Huian, TANG Minglin. Experimental study on the phase equilibrium of the ternary system K2CO3-Na2CO3-H2O at 288 K[J]. Inorganic Chemicals Industry, 2003, 35(1):23-25.
[14] HG/T 2573—94,工业氧化镁[S].
HG/T 2573—94,Industrial Magnesia[S].
[15] GB/T 13025.8-91,制盐工业通用试验方法硫酸根离子的测定[S].
GB/T 13025.8-91,Common Test Methods Determination of Sulfate Ions in the Salt Industry[S].
