四逆散冻干粉改善睡眠作用的药效物质基础
2013-11-12李越峰苏云明严兴科李廷利
李越峰,苏云明,严兴科,李廷利
(1.甘肃中医学院药学系,甘肃兰州 730000;黑龙江中医药大学2.博士后流动站,3.药学院,黑龙江哈尔滨 150040)
四逆散为东汉张仲景《伤寒论》首载,由柴胡、白芍、枳实和甘草4味中药组成,是和解少阳、调和肝脾的基础方剂,具有解郁透热、疏肝理脾和宣散气血郁滞之功。研究中药复方发挥药效作用的物质基础有助于阐明其药理作用机制。中药指纹图谱技术如色谱法和光谱法为研究中药复方化学成分提供了技术手段[1-4]。本研究团队发现,四逆散冻干粉具有改善睡眠和提高睡眠质量的作用[5-6]。本研究采用反相HPLC法[7]获得四逆散冻干粉指纹图谱,通过四逆散冻干粉血中移行成分分析、脑脊液中移行成分分析并观察四逆散冻干粉对戊巴比妥钠所致小鼠睡眠时间的影响,初步探讨四逆散改善睡眠作用的物质基础,为阐明其改善睡眠的作用机制提供依据。
1 材料与方法
1.1 实验动物
Wistar大鼠,雄性,体质量200~220 g;昆明种小鼠,雄性,体质量18~22 g;黑龙江中医药大学实验动物中心提供,许可证号:黑动字第P00101006。
1.2 药物
柴胡为伞形科植物柴胡(Bupleurum chinense DC.)(北柴胡),购于河北省安国市康信义药材行;白芍为毛茛科植物芍药(Paeonia lactiflora Pall.)的干燥根,枳实(炙)为芸香科常绿小乔木植物酸橙(Citrus aurantium L.)的干燥幼果,甘草(炙)为豆科植物甘草(Glycyrrhiza uralensis Fisch.)、胀果甘草(Glycyrrhiza inflata Bat.)或光果甘草(Glycyrrhiza glabra L.)的干燥根,均购自哈尔滨市世一堂中药饮片厂;以上药材均经本单位生药学教研室都晓伟教授鉴定。
1.3 主要试剂和仪器
戊巴比妥钠,中国医药集团上海化学试剂公司;甘草酸单铵盐、柴胡皂苷C和昔奈福林(HPLC测定纯度均>98%),成都思科华生物技术有限公司;高氯酸(分析纯),天津市东方化工厂;胰蛋白酶,上海伯奥生物科技有限公司;三羟甲基氨基甲烷(Tris,分析纯),上海山浦化工有限公司;甲醇(HPLC级)和乙腈(HPLC级),美国迪马试剂公司;甘草次酸、芍药苷、柚皮苷和橙皮苷,中国药品生物制品检定所,HPLC测定其纯度均>98%。SHIMADZU岛津2010-A高效液相色谱仪、Kromasil色谱柱和 C18(4.6 mm ×250 mm,5 μm)保护柱,购自大连依利特分析仪器有限公司;微孔纯水制备系统和超级恒温器,重庆实验设备厂;KDC-40低速离心机,科大创新股份有限公司中佳分公司;SK-1型快速混匀器,江苏医疗仪器厂;B3200S-T超声震荡仪,必能信超声上海有限公司;翻正反射测定仪自制。
1.4 四逆散冻干粉的制备
精密称取药材适量,加入10倍体积水,煎煮2次,每次1 h,过滤,合并滤液,减压浓缩至稠膏状,并于 70℃水浴浓缩至 0.8 kg(生药)·L-1,采用先煎煮后冷冻干燥的工艺制备四逆散冻干粉。工艺如下:-40℃制冷,-20℃保冻 2 h,-10℃保冻16 h,20℃干燥5 h,35℃二次干燥2 h。此工艺条件下,获得的四逆散冻干粉冻型饱满,复水性好,呈淡黄色,网状疏松,水分<1%。采用HPLC法测定其中芍药苷≥2.74%,柴胡皂苷A≥2.32%,柚皮苷≥3.31%,甘草次酸≥2.70%。精密称取四逆散冻干粉0.5 g置容量瓶中,精密加入70%甲醇20 ml,超声提取40 min,冷却,摇匀,滤过,再用 0.45 μm 滤膜过滤,HPLC 分析,进样量 10 μl。
1.5 四逆散冻干粉给药后大鼠血清样品的制备
称取四逆散冻干粉 20 g,加水溶解配成500 g·L-1溶液,ig 给予大鼠,剂量为 5.0 g·kg-1,每天1次,连续7 d。于末次给药后5 h ip给予大鼠1%戊巴比妥钠溶液4 m·lkg-1麻醉,5 min后肝门静脉取血,每只5 ml,999×g离心10 min,取血清2.0 ml。随机将2只大鼠血清合并,加入甲醇10 ml快速混匀,密闭超声提取10 min,999×g离心10 min,取上清液在40℃恒温条件下减压回收至干,残渣以甲醇1 ml溶解,0.45 μm 滤膜过滤,进样10 μl进行移行成分分析。
1.6 四逆散冻干粉及其主要血清移行成分昔奈福林、芍药苷、柴胡皂苷C和甘草次酸给药后大鼠脑脊液样品的制备
取Wistar大鼠70只,平均分为7组,分别为正常对照组、四逆散冻干粉12 g·kg-1组、血清移行成分昔奈福林38 mg·kg-1、芍药苷87 mg·kg-1、柴胡皂苷 C 42 mg·kg-1和甘草次酸39 mg·kg-1组及其配伍(昔奈福林∶芍药苷∶柴胡皂苷C∶甘草次酸=8.5∶1∶1.5∶6.5)(各成分在血清移行成分中的质量比)206 mg·kg-1组。称取冻干粉20 g,加水溶解配成500 g·L-1溶液,ig给药,正常对照组给予等体积蒸馏水。每天1次,连续7 d。于末次给药后5 h ip给予大鼠1%戊巴比妥钠溶液4 ml·kg-1麻醉,5 min后用1 ml注射器于枕骨大孔抽取脑脊液,并将10只大鼠脑脊液合并,加入甲醇5 ml快速混匀,密闭超声提取10 min,999×g离心10 min,取上清液在40℃恒温条件下减压回收至干,残渣以甲醇1 ml溶解,0.45 μm 滤膜过滤,取 10 μl进样进行移行成分分析。
1.7 大鼠血清和脑脊液中移行成分分析
取10 μl上述制备的血清和脑脊液样品用HPLC法进行移行成分分析。色谱柱:Kromasil C18柱(4.6 mm ×250 mm,5 μm);流动相:乙腈-0.05%磷酸水溶液,梯度见表 1;检测波长:210 nm,240 nm;流速:1.0 m·lmin-1;柱温:30℃。
1.8 戊巴比妥钠所致小鼠睡眠时间的测定
取小鼠140只,置实验室1周,使之适应环境。实验分组同1.6,每组20只。每天给药1次,连续7 d。于末次给药前8 h禁食,给药60 min后ip给予戊巴比妥钠50 mg·kg-1,室内温度保持在20℃,湿度40%。用翻正反射测定仪测定小鼠睡眠时间,以翻正反射消失达1 min以上者即为入睡,观察并记录翻正反射消失和恢复时间。翻正反射消失至恢复时间为睡眠时间。
1.9 统计学分析
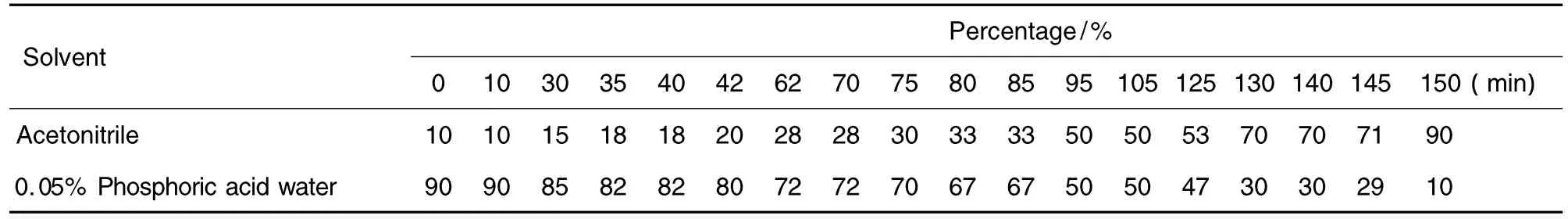
Tab.1 Gradient program of HPLC for analysis of constituents in serum and cerebrospinal fluid of rats
2 结果
2.1 大鼠血清中四逆散冻干粉移行成分
HPLC法测定结果(图1)表明,四逆散冻干粉每天1次,连续给药7 d后大鼠血清样品中有14种移行成分,经来源认定研究认为,其中2号峰为昔奈福林,4号为芍药苷,12号为柴胡皂苷C,14号为甘草次酸。
2.2 大鼠脑脊液中四逆散冻干粉移行成分
经过综合分析,脑脊液中除戊巴比妥钠成分外,并无四逆散冻干粉血清移行成分。如图2所示,正常脑脊液和给药组脑脊液中的*号成分保留时间及紫外吸收光谱一致为同一物质,表明是内源性物质。分析各峰面积比值(图3),四逆散冻干粉、芍药苷、甘草次酸、昔奈福林和柴胡皂苷C均可以使脑脊液中内源性物质峰面积增加,其中四逆散冻干粉组是正常脑脊液峰面积的12.5倍;血清移行成分配伍组脑脊液中内源性物质峰面积高于四逆散冻干粉组,是四逆散冻干粉组的3.2倍。
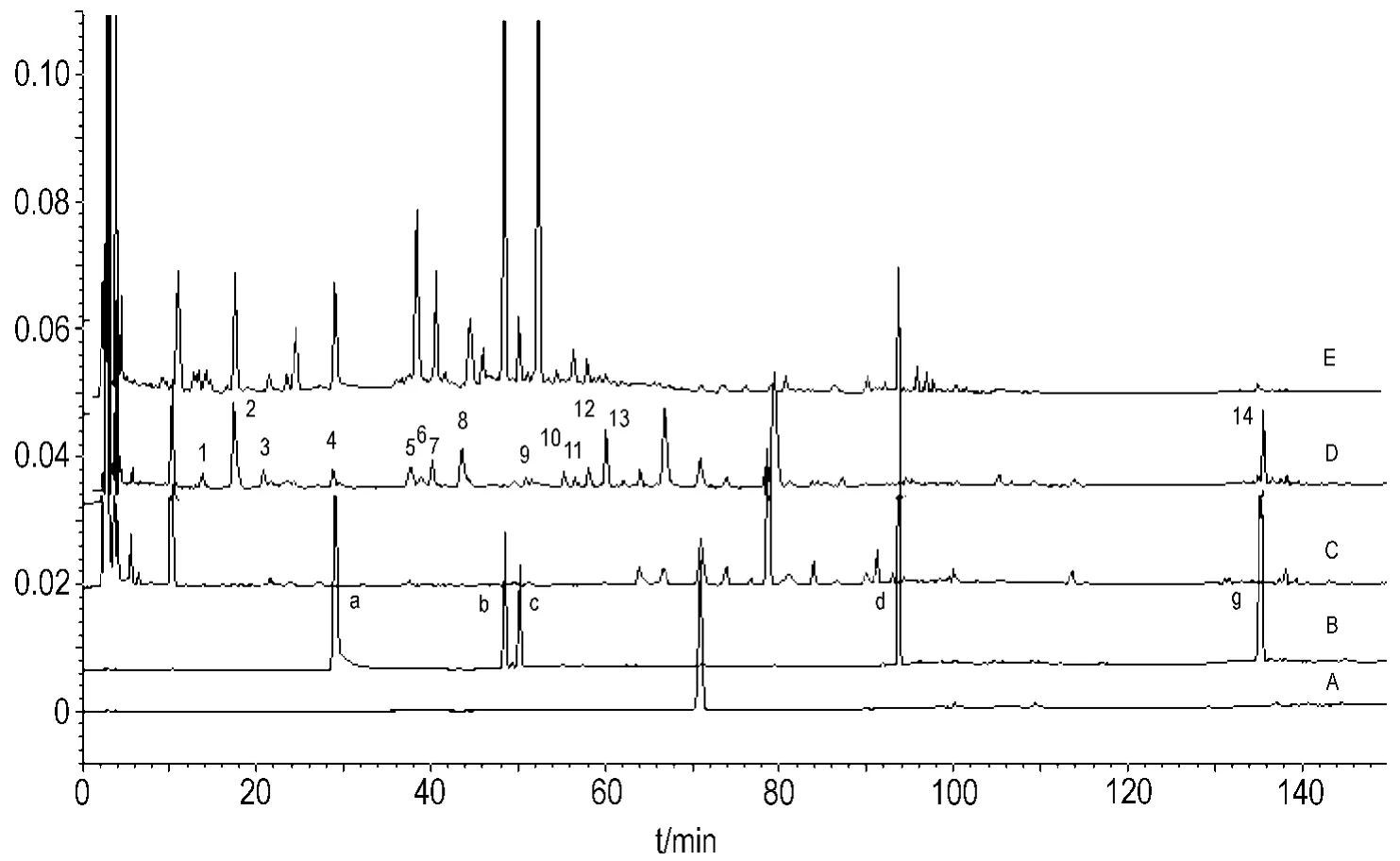
Fig.1 Analysis of transitional composition in blood serum of freeze-dried Sini powder(SP).The rats were ig given SP once a day consecutively for seven days.The serum was prepared 5 h after the last drug administration.Transitional ingredients of SP in blood were analyzed by using HPLC method.A:pentobarbital;B:mixed reference substances(a:paeoniflorin;b:naringin;c:hesperidin;d:monopotassium glycyrrhizinate;g:glycyrrhetinic acid);C:normal serum;D:serum in SP given rats;E:SP.
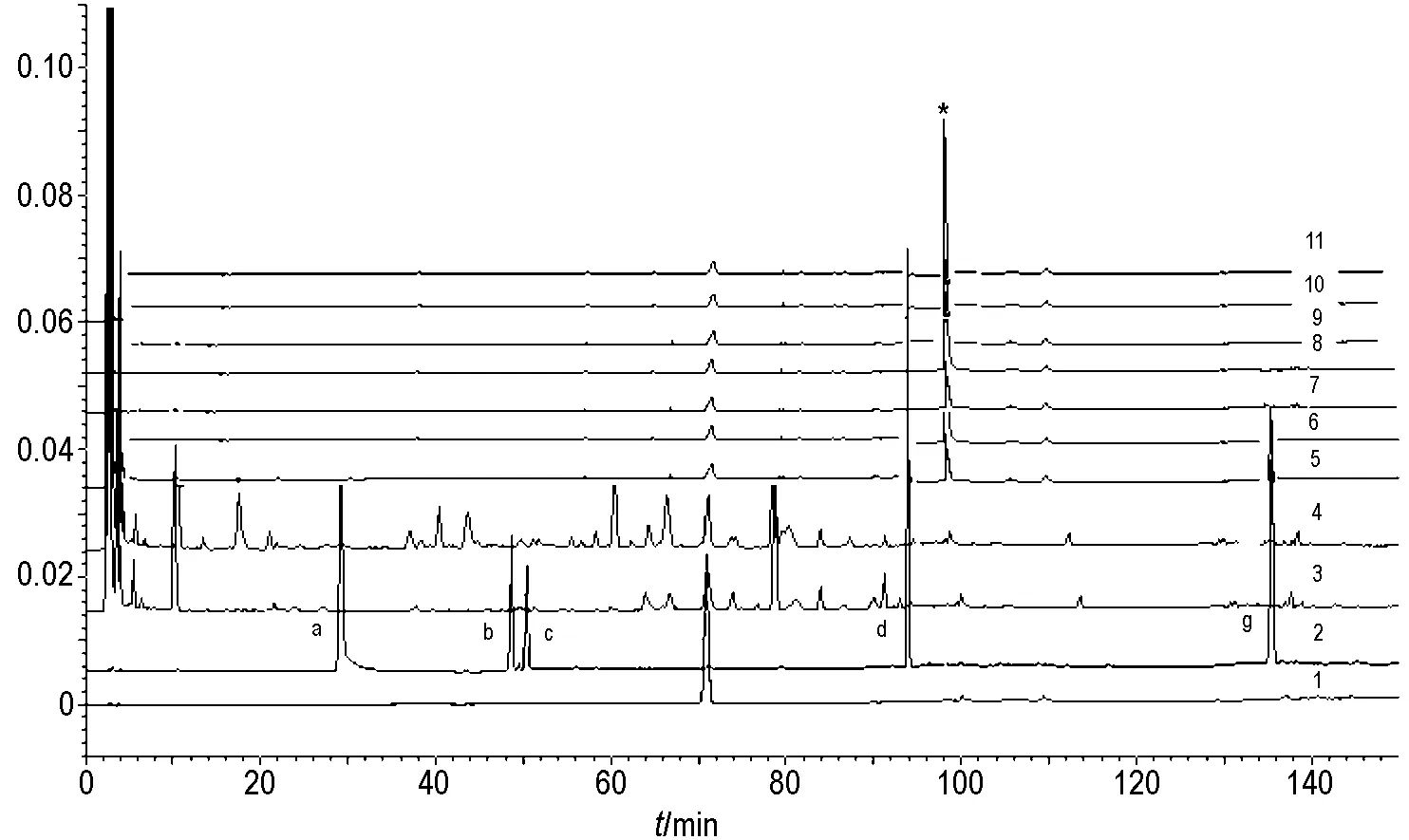
Fig.2 Contrast analysis on transitional constituents in serum and cerebrospinal fluid of SP.The rats were ig given the corresponding drug once a day consecutively for seven days.The blood and cerebrospinal fluid were prepared 5 h after the last drug administration.The transitional ingredients of SP in blood and cerebrospinal fluid were analyzed by using HPLC method.1:pentobarbital;2:mixed reference substances(a:paeoniflorin;b:naringin;c:hesperidin;d:monopotassium glycyrrhizinate;g:glycyrrhetinic acid);3:normal serum;4:serum in SP 12 g·kg -1given rats;5 -11:cerebrospinal fluid,in which 5:normal;6:SP 12 g·kg -1;7:paeoniflorin 87 mg·kg -1;8:synephrine 38 mg·kg -1;9:saikosaponin C 42 mg·kg -1;10:glycyrrhetinic acid 39 mg·kg -1;11:prescription of SP serum transitional ingredients(PSTI)(synephrine∶paeoniflorin∶saikosaponin C∶glycyrrhetinic acid=8.5∶1∶1.5∶6.5)(mass ratio)206 mg·kg -1.*:endogenous substance.

Fig.3 Chromatograms of constituents in cerebrospinal fluid after rats were ig given SP and its four serum transitional components.A:normal;B:SP 12 g·kg-1;C:paeoniflorin 87 mg·kg -1;D:synephrine 38 mg·kg -1;E:saikosaponin C 42 mg·kg-1;F:glycyrrhetinic acid 39 mg·kg-1;G:PSTI 206 mg·kg-1.*:endogenous substance.
2.3 四逆散冻干粉及其血清移行成分改善睡眠作用
四逆散冻干粉、昔奈福林、芍药苷、柴胡皂苷C、甘草次酸及其配伍改善睡眠作用的比较结果见表2。与正常对照组比较,芍药苷、甘草次酸、昔奈福林和柴胡皂苷C对阈剂量戊巴比妥钠所致小鼠睡眠时间无明显影响,四逆散冻干粉和血清移行成分配伍均可明显延长小鼠睡眠时间(P<0.01),血清移行成分配伍组优于四逆散冻干粉整方组(P<0.01)。
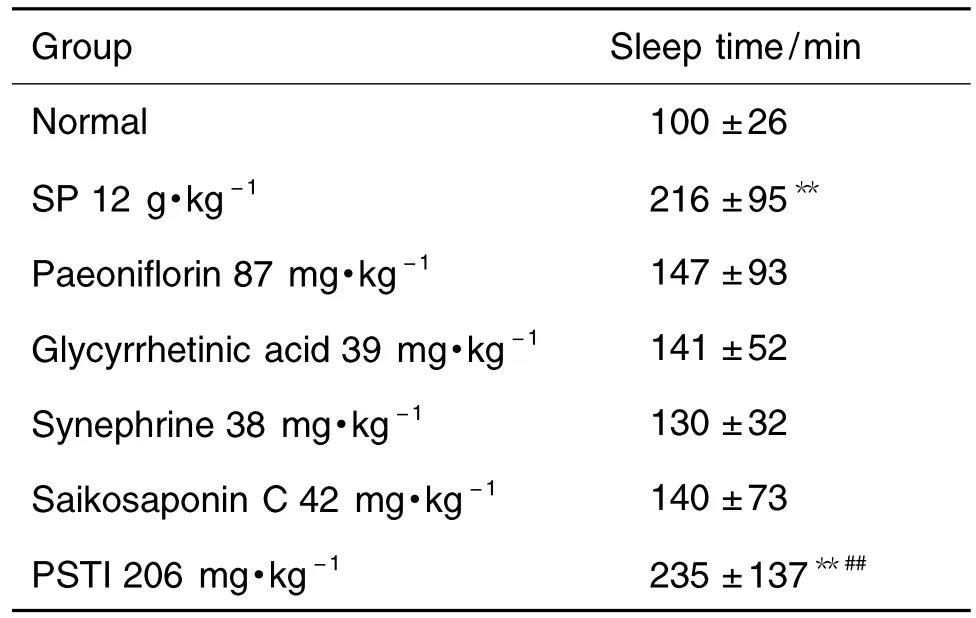
Tab.2 Effect of SP and PSTI on rat sleep time induced by pentobarbital sodium
3 讨论
通过四逆散冻干粉血清中移行成分分析,四逆散冻干粉连续给药7 d后血清样品中有14种移行成分,经来源认定研究认为,其中2号成分为昔奈福林,4号成分为芍药苷,12号成分为柴胡皂苷C,14号成分峰为甘草次酸。
经过综合分析,脑脊液中除戊巴比妥钠成分外,并无血中移行成分的进入,正常脑脊液和给药组脑脊液中的*号成分保留时间及紫外吸收光谱一致为同一物质,说明是内源性物质。从峰面积比值来看,给予四逆散冻干粉后脑脊液中内源性物质峰面积约是正常脑脊液峰面积的12.5倍。血清中四逆散冻干粉的移行成分昔奈福林、芍药苷、柴胡皂苷C和甘草次酸均可以使脑脊液中该内源性物质峰面积高于正常脑脊液峰面积,但不及四逆散冻干粉整方作用,且血清移行成分配伍组脑脊液中内源性物质峰面积是四逆散冻干粉组的3.2倍。综上所述,血清移行成分昔奈福林、芍药苷、柴胡皂苷C和甘草次酸可能是四逆散冻干粉改善睡眠作用的药效物质基础。
给药后脑脊液中的成分含量明显高于正常脑脊液含量,说明连续给药后大鼠脑脊液中的内源性物质增多,至于该成分为何种物质有待进一步研究。在对脑脊液成分分析的研究中发现,四逆散冻干粉发挥改善睡眠作用时表现出一种内部调控作用,这在某种程度上解释了四逆散冻干粉在改善睡眠作用方面所具有的独特的药理作用,与化学合成药物相比具有较大的优势[8]。另外,本研究结果表明,昔奈福林、芍药苷、柴胡皂苷C和甘草次酸4种成分及其配伍、四逆散冻干粉整方均能使脑脊液中内源性物质峰面积增高,血清移行成分配伍作用最强。以血清移行成分作为目标成分,结合药效学研究,确认四逆散冻干粉改善睡眠作用的主要药效物质基础,为四逆散冻干粉改善睡眠的作用机制研究奠定了基础。
本研究观察了四逆散冻干粉及其血清移行成分对戊巴比妥钠所致小鼠睡眠时间的影响。实验结果表明,与正常组比较,四逆散冻干粉可明显延长戊巴比妥钠所致小鼠睡眠时间,血清移行成分配伍组优于四逆散冻干粉组,芍药苷、甘草次酸、昔奈福林和柴胡皂苷C单用具有延长小鼠睡眠时间的趋势,但无统计学意义。
本研究通过对四逆散冻干粉血中移行成分分析、脑脊液中移行成分分析及四逆散冻干粉对戊巴比妥钠所致小鼠睡眠时间影响的药效研究,初步确认四逆散冻干粉的主要药效物质基础可能是其血清中移行成分昔奈福林、芍药苷、柴胡皂苷C及甘草次酸。
[1]Shao JQ.Advances in studies on fingerprints of Chinese materia medica[J].Chin Tradit Herb Drugs(中草药),2009,40(6):994-998.
[2]Jiang Y,He XH,Liu HJ.Construction and analysis of fingerprints of Chinese materia medica[J].Chin Tradit Pat Med(中成药),2004,26(4):262-265.
[3]Yang GF,Wang P.Establishment method and role of fingerprint of traditional Chinese medicine[J].Mater Med(时珍国医国药),2004,l5(l):21.
[4]Zhang P,Kong WJ,Yan D,ed.Epimedium herbs differences in the quality evaluation based on the the icariin determination and HPLC fingerprint analysis[J].Chin Herbal Med(中草药),2010,41(11):1901-1904.
[5]Song K,Mao YQ.Application of finger-print chromatogram on prescriptions of Chinese medicine[J].Mater Med(时珍国医国药),2002,13(11):699-700.
[6]Li YF,Yan XK,Li TL,Huang YX.Studies on chemical components of lyophilized powder of Sinisan[J].Chin Tradit Herb Drugs(中草药),2010,41(6):854-859.
[7]Cao JJ,Liang ZS,Yang DF,Liu YH,Duan Q.End point determination by HPLC chromatographic fingerprint in processing prepared Rehmannia[J].China J Chin Mater Med(中国中药杂志),2010,135(19):2556-2560.
[8]Dugovic C.Role of serotonin in sleep mechanisms[J].Rev Neurol(Paris),2001,157(11 Pt 2):S16-S19.
