高谷氨酸环境下肌肽对星形胶质细胞谷氨酸转运体-1表达及活性的正调节作用
2013-11-12田月洋吕建新
沈 耀,李 娟,田月洋,吕建新
(温州医科大学检验医学院与生命科学学院 检验医学教育部重点实验室,浙江 温州 325035)
谷氨酸是哺乳类动物中枢神经系统最重要的兴奋性神经递质,对缺血性脑损伤至关重要[1]。随着多靶点神经保护策略的提出,以及星形胶质细胞在谷氨酸信号传递过程中的多样化作用的被发现,星形胶质细胞已成为脑缺血神经保护研究的焦点[2-3]。由于缺少细胞外谷氨酸代谢途径,突触释放的谷氨酸必须通过星形胶质细胞谷氨酸转运体(gl utamate transporter,GLT),包括 GLT-1和谷氨酸-天冬氨酸转运体(gl uta mate-aspartate transporter,GLAST)从突触间隙转运到细胞内代谢清除[4-5]。因此,调节GLT-1/GLAST的表达和(或)活性可能是预防或治疗缺血性脑损伤等疾病的潜在策略。然而,除了β-内酰胺类抗生素外[6],目前尚未见报道其他药物具有调节GLT-1/GLAST表达和(或)活性的作用。因此,寻找并研究具有调节GLT-1和(或)GLAST表达及功能的药物具有重大意义。
肌肽是一种自然存在的水溶性二肽化合物[7],广泛分布于动物和人类的大脑;外源性肌肽可通过血脑屏障上的肌肽转运体进入中枢神经系统[8]。本实验室前期研究发现,在小鼠局灶性脑缺血模型上,肌肽能通过降低谷氨酸的兴奋性毒性损伤而发挥神经保护作用[9]。因此,本研究采用原代培养的皮质星形胶质细胞为细胞模型,并采用高浓度谷氨酸攻击损伤模型模拟脑缺血过程中产生的高浓度谷氨酸,研究肌肽对星形胶质细胞介导的谷氨酸信号的调节作用,为缺血性脑损伤等疾病的防治提供新的思路。
1 材料与方法
1.1 试剂
肌肽,谷氨酸,噻唑蓝(MTT),D-多聚赖氨酸、Hoechst33342,碘化丙啶(pr opidiu m iodide,PI)均购自美国Sigma公司。青霉素、链霉素、L-谷氨酰胺、胰酶、高糖DMEM、胎牛血清均购自美国Gibco公司。o-苯二醛(o-pht haladehyde,OPA)、巯基乙醇购自美国Pickering公司。兔抗大鼠胶质原纤维酸性蛋白抗体、豚鼠抗GLT-1多克隆抗体、豚鼠抗GLAST多克隆抗体、罗丹明标记的抗豚鼠Ig GF(ab′)2二抗购自美国 Millipore公司。
1.2 原代星形胶质细胞的培养和鉴定
参照文献[10]的方法,无菌条件下取出24 h龄新生SD大鼠全脑,分离左右半脑,剔除嗅球、纹状体、海马和基底脑组织,将皮质组织移入另一只含有冰冷解剖液的培养皿中,小心剔除软脑膜和血管。用手术刀片将皮质组织捣碎,并用37℃预热的0.25%胰蛋白酶消化20 min。然后加入适量培养液,吹打成细胞悬液,接种到经0.1%多聚赖氨酸包被的细胞培养瓶中,培养液为含10%胎牛血清、谷氨酰胺2 mmol·L-1、青霉素100 k U·L-1、链霉素100 mg·L-1的高糖DMEM,并在24 h后更换新培养液,每2~3 d更换1次培养液。培养10~11 d细胞铺满瓶底后,以240 r·min-1的速度振摇过夜。采用星形胶质细胞特异性标志物GFAP免疫染色鉴定星形胶质细胞纯度,GFAP阳性率>95%可以用于后续实验。
1.3 MTT法检测细胞存活率
星形胶质细胞胰酶消化后以2.5×104c m-2接种于96孔培养板中,待细胞贴壁后用终浓度为10 mmol·L-1谷氨酸分别培养24,48和72 h,以未用谷氨酸处理的星形胶质细胞作为正常对照组。药物处理完毕后,加入10μl MTT (5 g·L-1溶于PBS),37℃,5%CO2孵箱中继续孵育2 h后吸去培养液,每孔加入100μl DMSO,待结晶完全溶解后在酶标仪上测定波长570 nm处吸光度值(A570nm),细胞存活率(%)=处理组A570nm/对照组A570nm×100%。
1.4 Hoechst33342和PI核荧光双染法检测细胞凋亡和坏死
星形胶质细胞以2.5×104c m-2接种于6孔板细胞玻片上,细胞贴壁后用终浓度为10 mmol·L-1谷氨酸分别处理24,48和72 h后,以未用谷氨酸处理的星形胶质细胞为正常对照组。作用完毕后,加入Hoechst33342溶液并使其终浓度为10 mg·L-1,37℃下孵育10 min;而后再加入PI染液,使其终浓度为10 mg·L-1,4℃下孵育10 min。用PBS洗涤1次,4%多聚甲醛固定。荧光显微镜下每张玻片随机选取5个及以上独立视野进行观察拍照,并进行凋亡、坏死细胞及总细胞计数,每张玻片细胞计数不少于2000个。细胞凋亡率(%)=凋亡细胞数/细胞总数×100%。
1.5 细胞免疫组织化学染色检测GLT-1和GLAST的表达
星形胶质细胞以2.5×104c m-2接种于细胞玻片上,待其贴壁。按照处理细胞分为正常对照组、谷氨酸10 mmol·L-1组、肌肽5 mmol·L-1(先给30 min)+谷氨酸10 mmol·L-1组,药物作用24 h。处理完毕后,取出种植有星形胶质细胞的玻片,用PBS 0.01 mol·L-1漂洗,4℃下4%甲醛固定,空气干燥。用PBS清洗后加入5%BSA室温封闭2 h;加入抗胶质原纤维酸性蛋白单克隆抗体(1∶400)或,豚鼠抗GLAST多克隆抗体(1∶2000)、豚鼠抗 GLT-1多克隆抗体(1∶2000),4℃反应过夜。用PBS清洗后加入异硫氰酸荧光素(FITC)标记的羊抗兔Ig G(1∶100)或加入TRITC(罗丹明)标记的F(ab′)2片段(1∶200),室温反应2 h。阴性对照操作完全平行,仅用5%BSA代替一抗。反应结束后PBS清洗,用含抗荧光衰减封片剂进行封片,荧光显微镜下每张玻片随机选取5个及以上独立视野进行观察拍照,采用Image J软件测定荧光强度(fluorescent intensity,FI),表示 GLT-1和GLAST蛋白的相对表达。
1.6 实时定量PCR检测GLT-1和GLAST mRNA的表达量
按照处理细胞分为正常对照组、谷氨酸10 mmol·L-1组、肌肽5 mmol·L-1(先给30 min)+谷氨酸10 mmol·L-1组,药物作用24 h;同时设肌肽5 mmol·L-1处理星形胶质细胞1,2,3,4,5 d。细胞样本加入Trizol后冰上匀浆,参照总RNA提取试剂盒说明方法提取总RNA。随后测定A260/280及总RNA浓度,并校正各样本总RNA浓度为200 g·L-1。行常规逆转录方法后进行实时定量PCR。反应体系为:去 RNA 酶水6.0μl,SYBR Green 10μl,上下游引物各0.8μl,模板2.0μl。反应条件:预变性95℃20 s,变性95℃15 s,退火65℃45 s,共 40 个 循 环。GLT-1 上 游 引 物:GGAGCCAAAGCACCGAAACC和下游引物:GAAGCAGCCCGCCACATACT;GLAST上游引物:GGGTCTGTGAATGGGGTCAAT和下游引物:AAGAAGAGGATGCCCAGAGGT;β肌动蛋白上游引物:GGCTGATTCCCCTCCATCG和下游引物:CCAGTTGGTAACAATGCCATGT。参考文献[11]用2-ΔΔCt计算 GLT-1和 GLAST mRNA的相对表达水平。
1.7 高效液相色谱法检测谷氨酸含量
参照文献使用高效液相色谱法检测细胞上清液谷氨酸浓度以分析星形胶质细胞各转运体对谷氨酸的转运能力[12-13]。p H 7.2的平衡盐溶液孵育细胞20 min后,按照处理细胞分为谷氨酸1 mmol·L-1组和肌肽 5 mmol·L-1(先给30 min)+ 谷氨酸1 mmol·L-1组,作用30 min后收集细胞上清,高氯酸0.4 mol·L-1脱蛋白,0.22μm 的聚二氟乙烯膜过滤。
采用电化学高效液相色谱仪系统(ESA,美国)检测样本谷氨酸含量。色谱柱为反相C18柱(3μm,3 mm×50 mm Capcell Pak MG C18柱,Shiseido,Tokyo,日本)。OPA柱前衍生化。采用二元梯度洗脱,流动相 A,Na2HPO4100 mmol·L-1,13%乙腈和 22% 甲醇,p H 6.8;流动 相 B,Na2HPO4100 mmol·L-1,5.6%乙腈和9.4%甲醇,p H 6.8。梯度变化为:0~3.5 min,恒定100%B;3.5~20 min,线性减少到0%B;20~22 min,恒定0%B;22~23 min,线性增加到100%B;23~30 min,恒定100%B。流速0.75 ml·min-1,柱温38℃。电势+250 mV和+550 mV。
2 结果
2.1 星形胶质细胞的鉴定
如图1所示,荧光显微镜下见绿色细胞即为GFAP免疫反应阳性的星形胶质细胞,占细胞总数的95%以上。

Fig.1 Glial fibrillary acidic protein(GFAP)positive cells in primarily cultured cortical astrocytes.The astr ocytes were prepared from newborn SD rats.The cells stained green were GFAP positive astrocytic cells.
2.2 谷氨酸对星形胶质细胞存活的影响
MTT结果(图2)显示,与正常对照组相比,谷氨酸10 mmol·L-1攻击24和48 h对星形胶质细胞存活率无明显影响,而攻击时间延长至72 h时,存活率明显降低(P<0.01),从正常对照组的100%降低到82.0%。
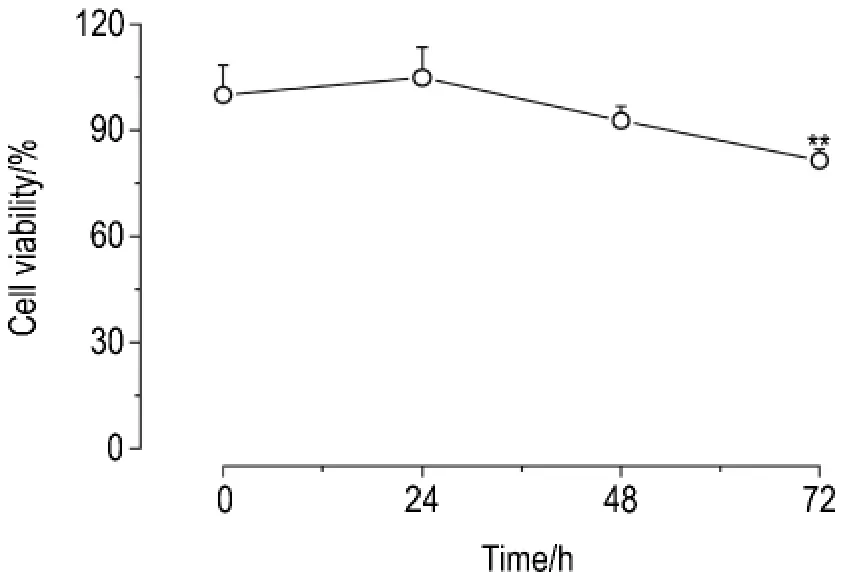
Fig.2 Effect of glutamate 10 mmol·L-1 on cultured cortical astr ocytes viability.±s,n=5.**P<0.01,compared with normal control group.
2.3 谷氨酸对星形胶质细胞凋亡和坏死的影响
如图3 Hoechst33342和PI核荧光双染结果显示,谷氨酸10 mmol·L-1攻击星形胶质细胞24 h不引起细胞凋亡或坏死(图3B),攻击72 h星形胶质细胞开始死亡,并且主要以凋亡为主(图3C),凋亡率从正常对照组的(3.70±0.58)% 增加到(24.75±6.76)%(图3D,P<0.01)。

Fig.3 Effect of carnosine 10 mmol·L-1 on glutamate-induced apoptosis in cultured cortical astrocytes measured by Hoechst33342/PI staining.A:control;B:after 24 h attack;C:after 72 h attack,respectively.D was the semiquantitative result of A-C.±s,n=5.**P<0.01,compared with nor mal control group.
2.4 肌肽对高谷氨酸环境下星形胶质细胞GLT-1和GLAST表达的影响
免疫组化结果显示,谷氨酸10 mmol·L-1攻击星形胶质细胞24 h,GLT-1(图4 A2)和 GLAST(图4C2)均有轻微的表达上调,但是没有统计学差异(图4B,4D)。给予肌肽5 mmol·L-1预处理30 min再进行谷氨酸攻击,星形胶质细胞GLT-1的表达显著上调(图4 A3,4B),比谷氨酸组上升24.08%(P<0.05);GLAST的表达则没有发生明显变化(图4C3,4D)。
2.5 肌肽对高谷氨酸环境下星形胶质细胞GLT-1 mRNA和GLAST mRNA转录的影响
实时定量PCR结果显示,肌肽处理后能上调高谷氨酸环境下星形胶质细胞GLT-1 mRNA表达(与正常对照组相比上调81.5%,图5 A),但对GLAST mRNA表达无影响(图5B)。给予肌肽5 mmol·L-1分别单独处理正常培养状态下的星形胶质细胞1~5 d,对 GLT-1 mRNA 和 GLAST mRNA表达均无显著影响(图5C,D)。
2.6 肌肽对谷氨酸攻击后星形胶质细胞谷氨酸摄取能力的影响
HPLC检测结果显示,经过肌肽5 mmol·L-1预处理30 min后,星形胶质细胞胞外谷氨酸含量为(0.60±0.08)mmol·L-1,明显低于谷氨酸组(0.81±0.10)mmol·L-1(P<0.01),提示肌肽预处理能显著提高星形胶质细胞对胞外谷氨酸的摄取能力。

Fig.4 Effect of carnosine on expression of glutamate transporter-1(GLT-1)(A and B)and glutamate aspartate transporter(GLAST)(C and D)in cultured cortical astrocytes injured by glutamate by immunohistochemistry assay.Astrocytes were pre-treated with carnosine 5 mmol·L-1 for 30 min and then exposed to glutamate 10 mmol·L-1 for 24 h attack.A1 and C1:nor mal control;A2 and C2:glutamate 10 mmol·L-1 for 24 h attack group;A3 and C3:carnosine 5 mmol·L-1+glutamate 10 mmol·L-1 group.B was the semi-quantitative result of A1-A3;D was the semiquantitative result of C1-C3.±s,n=6-9.*P<0.05,compared with glutamate treat ment group.
3 讨论
有研究报道脑缺血、脑外伤等情况下产生的脑内高浓度谷氨酸可能对星形胶质细胞产生损伤作用。如Chen等[14]发现,谷氨酸10 mmol·L-1攻击星形胶质细胞24 h导致细胞严重损伤。然而,也有研究发现,谷氨酸0~50 mmol·L-1攻击72 h以内都不引起星形胶质细胞的损伤[15]。因此,本研究首先采用10 mmol·L-1谷氨酸分别攻击皮质星形胶质细胞1~3 d,发现48 h内不引起细胞发生明显的死亡和代谢损伤;但随着谷氨酸攻击时间的延长星形胶质细胞则发生以凋亡为主的死亡,提示不同的细胞培养条件或不同的培养液成分可能会影响谷氨酸对星形胶质细胞的损伤作用。
在哺乳动物的脑内,肌肽由少突胶质细胞合成,当受到外界刺激时少突胶质细胞又可再释放出肌肽,而释放出来的肌肽可被星形胶质细胞通过能量依赖的二肽转运系统所摄取。研究发现,胶质细胞肌肽的释放受谷氨酸受体调节[7,16-17]。因此,推测在中枢神经系统内,肌肽、谷氨酸信号以及星形胶质细胞之间可能存在密切相关性。本研究结果显示,单独谷氨酸攻击星形胶质细胞24 h不引起GLT-1和GLAST表达的显著性改变;而给予肌肽预处理则能显著上调GLT-1的表达。但对于肌肽处理后为什么只选择性地作用于GLT-1,而对GLAST的表达不起作用,目前尚未得到相关实验数据可以解释其理由。在小鼠永久性局灶性大脑中动脉阻塞(per manent middle cerebral arter y occl usion,p MCAO)模型上也发现,肌肽可逆转p MCAO导致的GLT-1表达下调,而对GLAST表达不起作用,推测可能与GLT-1和GLAST在脑内的分布特点相关[9]。通过实时PCR结果可以得出,肌肽对GLT-1表达的调节作用只发生于细胞外高谷氨酸环境下,而对于低谷氨酸条件下不起作用,表明面对突然升高的胞外谷氨酸,星形胶质细胞可能通过上调GLT-1的表达以达到加速清除胞外谷氨酸的目的。
此外,本研究结果显示,肌肽能够促使星形胶质细胞快速摄取胞外谷氨酸。根据以往文献报道,谷氨酸转运体表达上调或这些转运体重新由胞质内分配组装到细胞膜上均可上调星形胶质细胞对胞外谷氨酸的摄取能力[12]。但是由于肌肽和谷氨酸处理的时间非常短,没有足够的时间供新的谷氨酸转运体从头合成。因此,推测肌肽可能通过调节谷氨酸转运体在细胞胞质内和细胞膜上的重新分布从而促使星形胶质细胞快速提高摄取胞外谷氨酸的能力。然而,现有的实验数据尚不能证明以上的推测。肌肽是否能够促使星形胶质细胞谷氨酸转运体在细胞内的重新分布将是下一步研究的重点。
总之,本研究结果显示,肌肽在高谷氨酸环境下能调节星形胶质细胞谷氨酸信号传递,提示在脑缺血、脑外伤等疾病过程中肌肽可能通过调节星形胶质细胞GLT-1介导的谷氨酸转运能力而达到减轻脑损伤的作用,表明肌肽可能是一种潜在的防治谷氨酸兴奋性损伤的药物。
[1]Rossi DJ,Brady JD,Mohr C.Astr ocyte metabolis m and signaling during brain ische mia[J].Nat Neur osci,2007,10(11):1377-1386.
[2]Barreto G, White RE, Ouyang Y, Xu L,Giffar d RG.Astr ocytes:targets for neuroprotection in stroke[J].Cent Nerv Syst Agents Med Chem,2011,11(2):164-173.
[3]Sidor yk-Wegrzyno wicz M,Wegrzynowicz M,Lee E,Bowman AB,Aschner M.Role of astrocytes in brain f unction and disease[J].Toxicol Pat hol,2011,39(1):115-123.
[4]Sheldon AL,Robinson MB.The r ole of gluta mate transporters in neurodegenerative diseases and potential opportunities f or inter vention[J].Neur ochem Int,2007,51(6-7):333-355.
[5]Ouyang YB,Voloboueva LA,Xu LJ,Giffard RG.Selective dysf unction of hippoca mpal CA1 astrocytes contributes to delayed neuronal da mage after transient f orebrain ischemia[J].J Neur osci,2007,27(16):4253-4260.
[6]Rot hstein JD,Patel S,Regan MR,Haenggeli C,Huang YH,Bergles DE,et al.Beta-lactam antibiotics offer neuroprotection by increasing gl uta mate transporter expression[J].Nature,2005,433(7021):73-77.
[7]Bakar djiev A,Bauer K.Biosynt hesis,release,and uptake of car nosine in pri mary cult ures[J].Biochemistry (Mosc),2000,65(7):779-782.
[8]Cr ush KG.Car nosine and related substances in ani mal tissues[J].Comp Biochem Physiol,1970,34(1):3-30.
[9]Shen Y,He P,Fan YY,Zhang JX,Yan HJ,Hu WW,et al.Car nosine protects against per manent cerebral ischemia in histidine decarboxylase knockout mice by reducing gl utamate excitotoxicity[J].Free Radic Biol Med,2010,48(5):727-735.
[10]Ki m HJ,MagranéJ.Isolation and culture of neurons and astr ocytes fro m t he mouse brain cortex[J].Met hods Mol Biol,2011,793:63-75.
[11]Livak KJ, Sch mittgen TD. Analysis of relative gene expression data using real-ti me quantitative PCR and t he 2〔-delta delta C(T)〕method[J].Methods,2001,25(4):402-408.
[12]Duan S,Anderson CM,Stein BA,Swanson RA.Gl utamate induces rapid upregulation of astr ocyte gl uta mate transport and cell-surface expression of GL AST[J].J Neur osci,1999,19(23):10193-10200.
[13]Jin CL,Yang LX,Wu XH,Li Q,Ding MP,Fan YY,et al.Effects of car nosine on amygdaloid-kindled seizures in Sprague-Dawley rats[J].Neuroscience,2005,135(3):939-947.
[14]Chen CJ,Liao SL,Kuo JS.Gliotoxic action of gl utamate on cultured astr ocytes[J].J Neurochem,2000,75(4):1557-1565.
[15]Leh mann C,Bette S,Engele J.High extracell ular gluta mate modulates expression of gluta mate transporters and glutamine synt hetase in cultured astr ocytes[J].Brain Res,2009,1297:1-8.
[16]Dieck ST,Heuer H,Ehrchen J,Otto C,Bauer K.The peptide transporter Pep T2 is expressed in rat brain and mediates t he accu mulation of the fl uorescent dipeptide derivative beta-Ala-Lys-Nepsilon-A MCA in astrocytes[J].Glia,1999,25(1):10-20.
[17]Hoff mann A M,Bakar djiev A,Bauer K.Car nosine-synt hesis in cultures of rat glial cells is restricted to oligodendr ocytes and car nosine uptake to astrocytes[J].Neurosci Lett,1996,215(1):29-32.
