双黄连注射剂导致类过敏反应的特点
2013-11-12仇士东刘兆华刘兆平
仇士东,刘兆华,刘兆平
(1.山东省医疗器械产品质量检验中心 山东省医疗器械生物学评价重点实验室,山东 济南 250101;2.山东大学新药评价中心,山东 济南 250012)
随着中药注射剂在临床的广泛应用,其不良反应,尤其是严重速发型超敏反应逐年增多,严重制约了现有品种的临床应用。中药注射剂的速发型超敏反应已成为当前药物毒理学研究领域的重要课题。速发型超敏反应包括Ⅰ型超敏反应和类过敏反应(anaphylactoid reaction)[1],其中类过敏反应的研究相对较少。同Ⅰ型超敏反应相似,类过敏反应也是通过激活组织内的肥大细胞或循环中的嗜碱性粒细胞脱颗粒释放过敏介质,作用于平滑肌细胞和血管内皮细胞等效应细胞,引发局部或系统性过敏症状。但两者激活肥大细胞和嗜碱性粒细胞的机制和发病特征具有明显不同[1],最主要区别在于类过敏反应首次给药即发生反应,且具有剂量依赖性[2],在临床上容易被误诊为Ⅰ型超敏反应。据国外统计,77%的临床过敏反应为类过敏反应[1]。据国内统计,双黄连注射剂的不良反应居中药注射剂之首,大多为首次给药即发生过敏反应。因此推测,双黄连注射剂可能引起类过敏反应。双黄连注射剂类过敏反应机制研究对中药注射剂的发展具有重要意义。本研究采用大鼠、犬和小鼠等动物模型研究双黄连注射剂类过敏反应的特点,为其他中药注射剂的类过敏反应研究提供参考。
1 材料与方法
1.1 实验动物
BN大鼠,体质量170~200 g,雌性,SPF级,北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2006-0009。比格犬,体质量10~12 kg,雌性,购于上海市新冈实验动物中心,动物生产许可证号:SCXK(沪)2007-0009。C57BL/6小鼠,体质量18~22 g,雌性,SPF级,北京维通利华实验动物技术有限公司提供,动物生产许可证号:SCXK(京)2006-0009。
1.2 试剂和仪器
注射用双黄连,哈药集团中药二厂,批号:1012236;Co mpound 48/80,批号:021 M4011 V;伊文思蓝,批号:MKBH2094 V,美国Sig ma公司;大鼠和犬组胺及补体SC5b-9,C4d和Bb ELISA试剂盒,美国Rapid Bio公司。Infinite 200多功能酶标仪,瑞士TECAN公司;MP150多导生理记录仪,美国Biopac公司。
1.3 BN大鼠分组及血压、血清Ig E、组胺以及补体SC5b-9、C4d和Bb的测定
取BN大鼠25只,平均分为5组,分别为生理盐水,Compound 48/80 0.34 mg·kg-1以及双黄连注射剂187.5,375和750 mg·kg-1组,采用微量注射泵恒速120 ml·h-1静脉推注给予生理盐水、Co mpound 48/80和双黄连注射剂。根据《中国药典》2010版一部关于双黄连注射剂质量标准,其临床拟用量为60 mg·kg-1,根据体质量折算,大鼠用量375 mg·kg-1相当于临床用量。
ip给予3%戊巴比妥钠1.5 ml·kg-1麻醉大鼠,束缚于固定板。大鼠颈部剃毛,消毒,剪开颈部皮肤,用眼科镊分离一侧颈动脉,结扎远心端,动脉夹夹住近心端,在动脉夹和远心端结扎处,小心剪取一小口插入充满肝素钠溶液的动脉插管并结扎,打开动脉夹,记录血压。分离对侧颈静脉,做静脉插管,连接注射器,管内充满肝素钠溶液。给药前10 min,给药后0,2,10,30和60 min记录大鼠动脉血压,血压采用Biopac Acknowledge 4.1软件采集数据并进行数值统计比较,以药前平均动脉压(mean artery pressure,MAP)为基准,降压幅度≥2.66 k Pa时,认为药物具有明显的降压作用。同时在给药前10 min,给药后0,2,10,30和60 min分别取颈动脉血,每次约0.6 ml,同时补充相同体积的肝素钠溶液以保持血容量不变。血液静置30 min后,1000×g离心10 min取上清,置-80℃冻存。大鼠血清中Ig E、组胺及补体SC5b-9、C4d和Bb均采用ELISA试剂盒检测。每只大鼠每个指标均设2个平行样。
1.4 比格犬的分组及血压、血清IgE、组胺以及补体SC5b-9、C4d和Bb的测定
取比格犬20只,分为5组,每组4只,分别为生理盐水,Compound 48/80 0.1 mg·kg-1及双黄连注射剂56.4、112.8和225.6 mg·kg-1组,分别给予生理盐水、Compound 48/80和双黄连注射剂。根据《中国药典》2010版一部关于双黄连注射剂质量标准,依据体质量折算,犬用量为112.8 mg·kg-1。
比格犬前肢静脉注射3%戊巴比妥钠1 ml·kg-1麻醉,固定于保温手术台上。腹股沟处消毒,分离股静脉,做静脉插管,以备注射药物。分离同侧股动脉,做动脉插管,连接压力传感记录血压信号。血压稳定后,采用微量注射泵恒速120 ml·h-1给药,全程记录血压。采用Biopac Acknowledge 4.1软件采集数据并进行数值统计比较,以药前MAP为基准,降压幅度≥2.66 k Pa时,认为药物具有明显的降压作用。同时股动脉定点采血,每次2 ml,采血后补足相同体积的肝素钠溶液以保持血容量不变。于药前20 min,药后2,10,30,60和120 min采血。血液静置30 min后,1000×g离心10 min取上清,置-80℃冻存。犬血清中Ig E、组胺及补体SC5b-9、C4d和Bb均采用ELISA试剂盒检测,每只犬每个指标均设2个平行样。
1.5 小鼠的分组及皮肤血管渗透性的测定
取C57BL/6小鼠20只,拉丁方分组法分成5组,每组5只,分为生理盐水,Co mpound 48/80 0.1 mg·kg-1及双黄连270,540和1080 mg·kg-1组,分别给予生理盐水,Co mpound 48/80和双黄连注射剂。根据《中国药典》2010版一部关于双黄连注射剂质量标准,小鼠用量为540 mg·kg-1。
小鼠ip给予1.5%戊巴比妥钠5 ml·kg-1麻醉后,剃去背部毛发。尾静脉注射50μl 0.5%伊文思蓝溶液,15 min后分别在每只小鼠背部左右侧sc给予双黄连注射剂,60 min后处死小鼠,取背部皮肤,剪碎后组织浸出液(丙酮∶生理盐水=7∶3)(V/V)10 ml浸泡48 h,并测量其610 n m处吸光度值,计算伊文思蓝含量(μg·c m-2)。
1.6 统计学分析
2 结果
2.1 双黄连注射剂致大鼠平均动脉压降低
大鼠给予双黄连注射剂后,全程监测血压的变化。如图1所示,Compound 48/80组在0~2 min MAP由14.7 k Pa降至8.0 k Pa,在2 min后出现了MAP的剧烈变化,且在60 min以内未见MAP的恢复。与生理盐水组比较,双黄连注射剂375和750 mg·kg-1组给药后2~10 min MAP显著降低(P<0.05),而187.5 mg·kg-1组 MAP未见明显变化。

Fig.1 Effect of Shuanghuanglian injection(SHLI)on mean artery pressure(MAP)of r ats.The MAP of rats was detected 10 min bef ore ad ministration(-10 min)and 0,2,10,30 and 60 min after ad ministration.±s,n=5.*P<0.05,**P<0.01,compared with nor mal saline group.
2.2 双黄连注射剂致大鼠血清组胺和补体SC5b-9含量升高
由表1和表2可见,大鼠给药后2~10 min,与给药前(-10 min)比较,双黄连注射剂375和750 mg·kg-1组组胺升高(P<0.05,P<0.01),Ig E水平未见明显变化。Co mpound 48/80组与给药前比较组胺升高(P<0.01),Ig E水平不变,为典型的类过敏反应特点。由表3可见,与生理盐水组比较,双黄连注射剂375和750 mg·kg-1组给药后2~10 min SC5b-9含量升高(P<0.05)。由图2可见,大鼠给予双黄连注射剂后,与生理盐水组比较,补体C4d和Bb浓度未见明显变化。由此初步判断,双黄连注射剂可导致类过敏反应,但不能完全确定是否激活了大鼠的补体途径而引发类过敏反应。
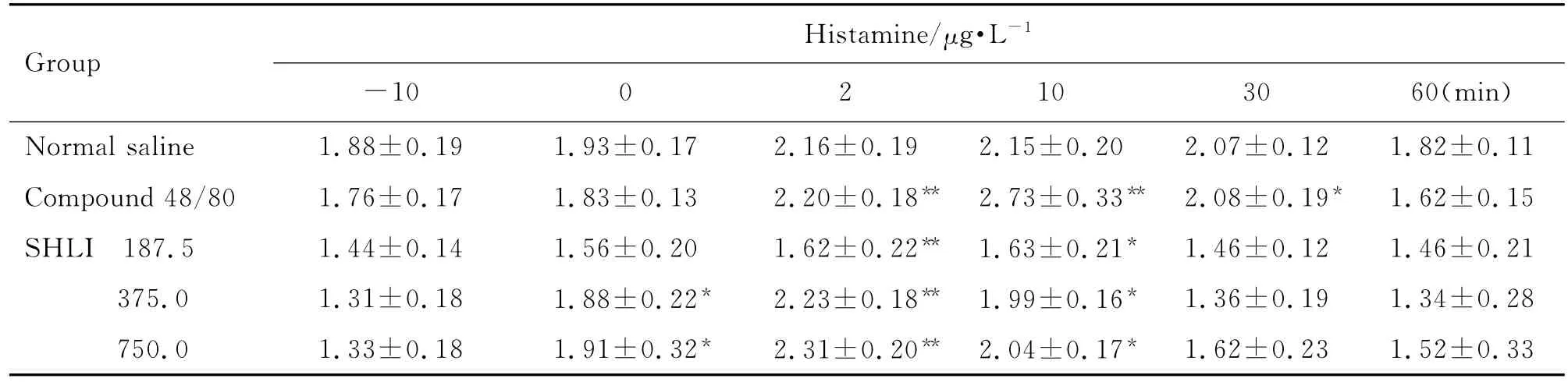
Tab.1 Effect of SHLI on serum histamine level of rats

Tab.2 Effect of SHLI on ser um IgE level of rats
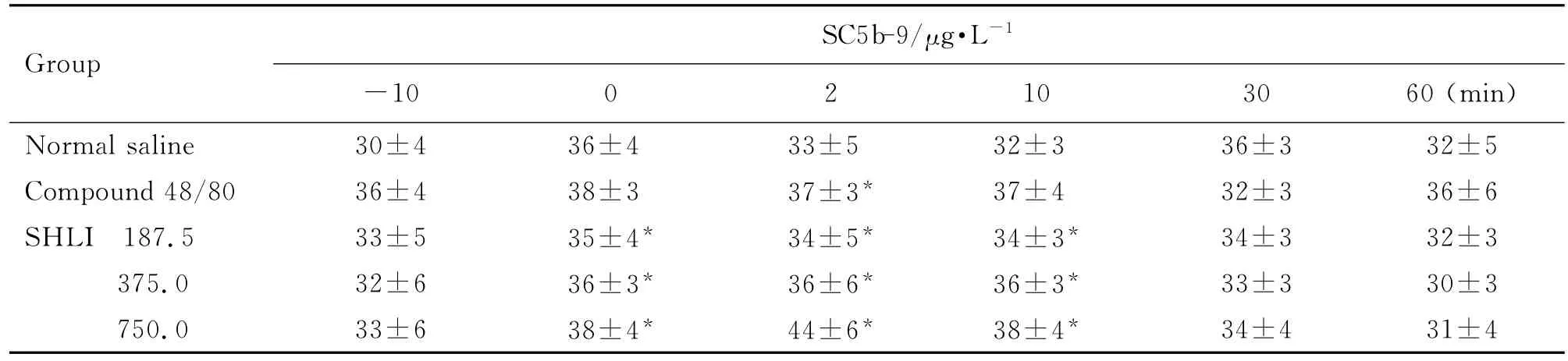
Tab.3 Effect of SHLI on ser um SC5b-9 level of rats

Fig.2 Effect of SHLI on complements Bb and C4d levels in rat seru m.See Fig.1 for t he rat treat ment.±s,n=5.
2.3 双黄连注射剂致比格犬平均动脉压降低
双黄连注射剂按比格犬正常给药浓度(26.7 g·L-1),以不同的静脉给药速度给予比格犬,全程记录MAP的变化。如图3所示,双黄连注射剂在300 ml·h-1时引起 MAP的剧烈变化(图3 A),同时出现呼吸窘迫症状。降低给药速度至120 ml·h-1,MAP未见明显降低(图3B),呼吸亦恢复正常。因此,本研究采用120 ml·h-1速度静脉给药。

Fig.3 Effect of feed rate of SHLI 26.7 g·L-1 on MAP of Beagle dogs.A:SHLI 300 ml·h-1;B:SHLI 120 ml·h-1;C:normal saline 300 ml·h-1.
2.4 双黄连注射剂致比格犬血清组胺和SC5b-9含量升高
由表4可见,与生理盐水组比较,双黄连注射剂56.4,112.8和225.6 mg·kg-1组在比格犬给药后2~10 min组胺含量升高(P<0.05,P<0.01)。由表5可见,双黄连注射剂56.4,112.8和225.6 mg·kg-1组Ig E未见明显变化。由表6可见,双黄连注射剂56.4,112.8和225.6 mg·kg-1组给药后2~30 min犬血清中SC5b-9升高(P<0.05,P<0.01)。Co mpound 48/80组组胺升高,Ig E 不变,且SC5b-9不变,其为典型的非补体介导的类过敏反应。由图4可看出,双黄连注射剂56.4,112.8和225.6 mg·kg-1组补体Bb均未发生明显变化,C4d均升高(P<0.01)。据此可初步判断,双黄连注射剂可导致比格犬类过敏反应,且可能属于补体介导的类过敏反应。

Tab.4 Effect of SHLI on ser um histamine level of Beagle dogs

Tab.5 Effect of SHLI on serum IgE level of Beagle dogs

Tab.6 Effect of SHLI on ser um complement SC5b-9 level of Beagle dogs

Fig.4 Effect of SHLI on ser um complements Bb(A)and C4d(B)level of Beagle dogs.See Tab.4 f or the Beagle dogtreat ment.±s,n=4.**P<0.01,co mpared wit h bef ore treat ment(-20 min).
2.5 双黄连注射剂致小鼠皮肤血管渗透性增加
皮肤蓝斑实验结果如图5和图6所示。与生理盐水组比较,Co mpound 48/80组出现明显的蓝斑浸润(图5B),皮肤组织中依文思蓝含量升高(P<0.01)。双黄连注射剂270,540和1080 mg·kg-1组亦出现蓝斑浸润(图5C,D和E),依文思蓝含量升高(P<0.01),且随给药剂量的增加,蓝斑浸润加重,依文思蓝含量升高(P<0.01)。

Fig.5 Effect of SHLI on skin vascular per meability of mice.The mice were iv given 0.5%Evans blue solution 50μl in t he tail.Fifteen minutes later,SHLI was sc given on t he back skin of mice.Sixty minutes later,t he vascular per meability was measured.A:nor mal saline;B:Compound 48/80 0.1 mg·kg-1;C,D and E:SHLI 270,540 and 1080 mg·kg-1,respectively.

Fig.6 Effect of SHLI on Evans blue content in back skin of mice.See Fig.5 for t he mouse treat ment.±s,n=5.**P<0.01,co mpared wit h nor mal saline gr oup.
3 讨论
类过敏反应的研究模型主要分为体外模型和动物模型。体外模型包括细胞模型[3-4]和体外补体激活模型等。动物模型主要有犬[5]、大鼠、小鼠[6]、豚鼠[7]、猴[7]和猪[8]等。每种模型大都以靶细胞(肥大细胞或嗜碱性粒细胞)为研究对象,探求其类过敏介质的释放机制。类过敏反应动物模型在国内的研究相对成熟。组胺、类胰蛋白酶、特异性Ig E和补体等物质均可以作为生物标志物,用于类过敏反应的诊断[9]。组胺是类过敏反应的重要指标,较为客观准确,但组胺正常值有较大的个体差异。血清组胺水平与临床变应症状发生的一致性尚有待于进一步确证[9]。单独依靠组胺升高来判断致敏性易于产生误判。为此,本研究增加了血压、Ig E和补体等指标进行综合判断,增加了评价结果的客观性。
补体系统广泛参与机体抗微生物防御反应以及免疫调节,是体内具有重要生物学作用的效应系统和效应放大系统[10]。补体介导的类过敏反应是类过敏反应类型中重要组成部分。补体系统激活过程依据其起始顺序不同,可分为经典途径、旁路途径和凝集素途径3条途径。补体C4d和Bb分别是补体经典激活途径和旁路激活途径的产物,测定这两个指标可以判断不同的激活途径[11]。本研究的设计思路是先进行组胺和IgE的检测,若出现组胺升高且Ig E不变的情况,可怀疑为类过敏反应,再进一步测定补体激活情况,即检测补体SC5b-9含量的变化。若SC5b-9含量升高,则再检测补体通路的标志物C4d和Bb,从而进一步判断激活的具体补体通路。
根据比格犬的实验结果,给予双黄连注射剂后血压降低,血清组胺含量升高,Ig E含量不变,SC5b-9升高,说明双黄连注射剂可以引起类过敏反应。给双黄连注射剂后血清中C4d含量明显上升,而Bb含量未见显著性改变,该结果提示双黄连注射剂激活补体系统可能是通过激活经典途径实现的。根据大鼠的实验结果,给予双黄连注射剂后血压降低,血清组胺含量升高,Ig E含量不变,SC5b-9升高,但未见C4d和Bb含量的明显变化,可见大鼠相对犬来说,对补体的变化不甚明显。
小鼠血管渗透性实验中,根据蓝斑面积的大小和组织浸提液提取的伊文思蓝的含量变化,可判断给药后血管渗透性的大小。给予双黄连注射剂后,小鼠出现剂量依赖性血管通透性增高,血管反应程度随剂量增高而加重,这可以认为是类过敏反应的证据。小鼠的免疫系统具有非常好的特异性,小鼠皮肤中含有丰富的肥大细胞,非常适合具有直接刺激肥大细胞特点的药物的筛选。
根据本研究不同动物模型的比较可知,犬和小鼠的类过敏反应模型具有一定的灵敏性。比较而言,大鼠模型对类过敏反应不太敏感。这也正好验证了犬的类过敏模型的科学性。Szebeni等[12]比较了大鼠、猪和犬对脂质体的类过敏反应敏感性,认为大鼠对血压变化不甚敏感,犬和猪可用于制备类过敏反应检测模型。因犬对血压的变化非常敏感,MAP的检测具有很好的灵敏性。并且,犬的补体系统较发达,亦非常适合用于补体介导的类过敏反应的评价。闫位娟[13]比较了小鼠、豚鼠和比格犬用于评价类过敏反应的敏感性和准确性,结果也表明比格犬为最佳实验动物。
综上所述,双黄连注射剂可引起类过敏反应,其特点是既可激活皮肤中的肥大细胞又可激活血液中的嗜碱性粒细胞,且具有补体介导的类过敏反应的特征。在其他种属的动物以及人体上是否具有相似的反应,尚待进一步研究。
[1]Szebeni J.Co mplement activation-related pseudoaller gy:a new class of drug-induced acute i mmune toxicity[J].Toxicology,2005,216(2-3):106-121.
[2]FDA.Guidance for Industr y-Immunotoxicology Evaluation of Investigational New Dr ugs[EB/OL].htt p://www.fda.gov/downloads/Drugs/GuidanceComplianceRegulatoryInfor mation/Guidances/uc m079239.pdf
[3]Guo W,Chen YC,Liu SP,Cheng JD.Detection met hods of mast cells degranulation in vitr o[J].Chin J Pat hophysiol(中国病理生理杂志),2002,18(8):1023-1024.
[4]Li J,Jin J,Guan CW,Li P,Tu JS,Sun H M,et al.Study of degranulation in mast cell RBL-2 H3 induced by Tween 80[J].Drug Eval Res(药物评价研究),2010,33(5):379-383.
[5]Wang ZG, Wang DQ, Yu YH, Li YK,Sui Y,Cui HF.Experi mental model of hista mine-induced anaphylactoid reaction on Beagle dogs[J].China J Chin Mater Med(中国中药杂志),2011,36(14):1842-1844.
[6]Li CY,Liang AH,Gao SR,Liu T,Hao R,Cao CY,et al.Develop ment of ani mal model for anaphylactoid test of rodent[J].China J Chin Mater Med(中国中药杂志),2011,36(4):488-491.
[7]Sun L,Liu XM,Wang X,Qi WH,Shen LZ,Li B.Tentative exploration in reasons of ani mals′pseudoallergic reactions caused by Tween 80[J].J Toxicol(毒理学杂志),2007,21(4):322.
[8]Szebeni J,Fontana JL,Wassef NM,Mongan PD,Morse DS,Dobbins DE,et al.Hemodynamic changes induced by liposomes and liposome-encapsulated hemoglobin in pigs:a model for pseudoallergic cardiopul monary reactions to liposomes.Role of complement and inhibition by soluble CR1 and anti-C5a antibody[J].Circulation,1999,99(17):2302-2309.
[9]Cheng F,Shi YQ,qin HD,Liu ZP.Inquiry into the biomarkers of drug anaphylactoid reactions[J].Chem Life(生命的化学),2008,28(6):795-798.
[10]Chen WF.Medical Immunology(医学免疫学)[M].4th ed.Beijing:People′s Medical Publishing House,2004:49-59.
[11]Szebeni J,Baranyi L,Savay S,Milosevits J,Bodo M,Bunger R,et al.The interaction of liposomes with the complement system:in vitro and in vivo assays[J].Methods Enzy mol,2003,373:136-154.
[12]Szebeni J,Alving CR,Rosivall L,Bünger R,Baranyi L,Bedöcs P,et al.Animal models of complement-mediated hypersensitivity reactions to liposomes and other lipid-based nanoparticles[J].J Liposome Res,2007,17(2):107-117.
[13]Yan WJ. The allergenicity study of traditional Chinese medicine injections(中药注射剂致敏性研究)[D].Guangxi Medical University,2009.
