有氧运动和G-CSF干预对心梗大鼠心肌细胞再生的影响及其机制探讨
2013-11-12蔡梦昕张娟娟史秀超田振军
蔡梦昕,张娟娟,史秀超,田振军
Shaanxi Normal University,Xi’an 710062,China.
心肌梗死(Myocardial Infarction,MI)是导致人类死亡的主要心血管疾病之一。MI可导致梗死区发生替代性纤维化,形成瘢痕组织,引起恶性心室重塑,心功能紊乱[35,42]。促进MI后心肌细胞的再生,对于改善心肌结构重塑,提升心功能意义重大。传统观点认为,心肌细胞属于终末分化细胞,损伤后不能再生。近年来发现,心肌细胞存在再生能力,正常生理和病理情况下成体心肌细胞均存组在组增组殖组现组象[8,9,41],其组缓组慢组更组新组随组年组龄组增组长组而组下组降[9]。Kajstura等发现,每100万个心肌细胞中有14个处于有丝分裂期,而缺血性心肌中处于有丝分裂期的数量增加了近10倍[21]。Beltrami等同样发现,MI区周围组织存在新生的心肌细胞,但数目有限,不能满足心肌修复的需要[8]。随着干细胞技术的发展,已经证实内源性心脏干/祖细胞(endogenous Cardiac Stem Cells,eCSCs)、骨髓来源的干细胞等成体干细胞,可诱导分化为心肌细胞、平滑肌细胞和内皮细胞,为组心组肌组修组复组提组供组了组细组胞组来组源[7,33,46,48]。目组前组针组对MI后心肌修复的研究主要包括心肌细胞周期的重新启动、移植心肌细胞或干细胞迁移至损伤部位并刺激分化为心肌细胞,以及动员内源性成体干细胞的归巢、增殖和分化。由于心肌细胞本身再生能力有限,而移植的细胞又存在成瘤性和排异性等风险,寻求安全有效的促进心肌细胞重新进入细胞周期,以及动员内源性成体干细胞的方法和途径具有重大意义。
研究表明,MI后给予粒细胞集落刺激因子(Granulocyte-Colony Stimulating Factor,G-CSF)可改善心功能和左心室重塑,缩小梗死面积[30,34]。G-CSF 是骨髓中多种干细胞强有力的动员剂,可增加外周血中干细胞的数量并移到受损部位,诱导心肌再生[16,32]。研究发现,骨髓干细胞的归巢与基质细胞衍生因子-1(Stromal Cell-derived Factor,SDF-1)及其受体CXCR4 信号密切相关,并通过激活GATA-4和Nkx2.5 等转录因子的表达启动心肌化的发生[4,40]。近期研究发现,有氧运动诱导心脏生理性肥大的同时,伴随有组心组肌组细组胞组增组殖组的组发组生[2,11,49]。有组氧组运组动组可组显著提高心肌中生长因子的表达,促进c-kit+eCSCs激活和分化,进而促进心肌再生[49]。近年来发现,运动同样能够有效提升MI患者心功能[13,17],适度有氧运动可抑制心肌细胞凋亡[15],缩小梗死面积,减轻胶原过度沉积和纤维化现象,减缓梗死后的心室重塑,改善左心室功能[52]。有研究提出,运动可激活干细胞活性,参与心血管和骨骼肌的再生过程[47]。然而运动提升MI心脏功能是否与心肌细胞再生有关,目前尚无文献报道。因此推测,有氧运动促进心肌损伤的修复可能与干细胞动员激活有关。运动和G-CSF干预能否更有效地动员骨髓干细胞归巢,修复心肌损伤,提升心功能需要实验证实。本研究通过建立大鼠MI模型,检测有氧运动和G-CSF干预对大鼠心功能、心肌组织结构、心肌细胞增殖标记蛋白、干细胞趋化相关因子和干细胞表面抗原蛋白的表达,探讨其可能机制,为MI患者的临床康复手段与方法的筛选提供实验依据。
1 材料与方法
1.1 实验动物与分组
3月龄雄性Sprague-Dawley大鼠85只(购于西安交通大学实验动物管理中心,动物质量合格证号:陕医动证字08-004),体重180~220g,分笼饲养,每笼6只,国家标准啮齿类动物干燥饲料喂养,自由饮食。动物室内温度20℃~29℃,相对湿度40%~50%。适应性喂养1周后,进行左冠状动脉前降支(LAD)结扎手术,术后存活75只大鼠随机分为5组:假手术组(Sham组)、心梗组(MI组)、心梗+运动组(ME组)、心梗+动员剂组(MG组)和心梗+动员剂+运动组(MGE组)。
1.2 主要仪器和试剂
主要仪器:ALC-V8组动组物组呼吸机、PowerLab/8s生组理组信号采集处理系统、LEICA-RM2126 切片机、BM-Ⅱ型病理组织包埋机、生物组织摊烤片机、BX51 奥林巴斯光学显微镜、尼康荧光显微镜、Bio-Rad电泳仪和转移槽、凝胶成像系组统、PCR组仪组等。
主要试组剂:Tween 20、SABC组试组剂组盒、DAB组显组色组试组剂组盒(武汉博士德)、兔抗多克隆抗体Ki-67、CD29、CD44、SDF-1、CXCR4、MCP-1、VLA-4(北组京组博组奥组森)和c-kit(美 国Santa Cruz)、小鼠单克隆抗体PCNA(Biotrigen)和GATA-4(美国Abcam)、Trizol(加拿大Bio Basic Inc)、Revert AidTMFirst Strand cDNA Synthesis Kit(德国Fermentas)、PCR 引物(上海生工)。
1.3 MI大鼠模型制备
5%戊巴比妥钠溶液(30 mg/kg)腹腔注射麻醉,采用呼吸机连接大鼠呼吸面罩辅助呼吸,待大鼠呼吸平稳后,开胸暴露心脏,在左心耳和肺动脉圆锥间下缘2 mm 处结扎左冠状动脉前降支,进针深度为0.3~0.5 mm,同时监测心电图和心肌颜色变化。以心电图ST 段弓背抬高,出现病理性Q 波或T 波倒置为结扎成功标志,之后逐层缝合。假心梗组只开胸穿线,不结扎。
1.4 有氧运动方案和G-CSF给药方法
ME 和MGE组术后1周进行跑台有氧运动。第1周为适应性运动,以10m/min起始速度运动10min后,逐渐递增至16 m/min,运动总时间为50 min;正式运动时,以10m/min的起始速度运动5min后,以2m/min逐渐递增至16m/min,保持该速度运动至50min,5d/周×8周[52]。MG 和MGE组手术3h后,给予生理盐水稀释的重组人粒细胞集落刺激因子(rhG-CSF)皮下注射,剂量为10μg/kg/d×5d,其余3组大鼠经皮下注射等量生理盐水[1]。
1.5 心功能测定
采用血流动力学方法测定大鼠心功能。8周运动结束后次日,麻醉并称重,经右颈总动脉逆行插管至左心室,以多导生理记录仪测试左室收缩压(Left Ventricular Systolic Pressure,LVSP)、左室舒张末压(Left Ventricular End-Diastolic Pressure,LVEDP)、左室压力最大 上升速 率(+dp/dtmax)和最大下降速率(-dp/dtmax)。
1.6 TTC 染色与样本处理
麻醉后开胸摘取心脏。每组随机取3只进行TTC 染色:生理盐水冲洗后置于液氮中速冻,10 min后取出,切成1~2mm 薄片,1%2,3,5-氯化三苯四氮唑溶液(TTC)室温孵育30min。数码相机拍照,统计梗死区(灰白色)与非梗死区(红色)面积。
将进行心肌组织Masson染色和免疫组织化学实验的标本置于10%中性甲醛溶液固定24h后,常规石蜡包埋,5μm 连续切片。将用于Western Blot和RT-PCR 实验的标本入液氮24h后,移至-80℃低温冰存备用。
1.7 免疫组织化学实验
实验严格按照SABC 免疫组化染色试剂盒说明书进行。切片脱蜡至水,PBS清洗,3% H2O2浸泡10min,微波抗原修复,PBS清洗后滴加正常山羊血清封闭液(37℃,30组min),孵组育组一组抗(4℃过组夜),其组中PCNA、Ki-67、CD29 和CD44 稀释比例为1∶80,c-kit为1∶100,PBS清洗,孵育二抗(37℃,30 min),PBS组清 洗,孵育SABC组复合组物(37℃,30min),PBS清洗,DAB显色,蒸馏水洗涤终止反应,苏木精复染、封片、镜检。设置空白对照(PBS 取代一抗和二抗)和阴性对照(PBS取代一抗)。
1.8 Western Blot实验
8%~12% Tris-甘氨酸SDS 聚丙烯酰胺凝胶电泳分离蛋白,转膜,封闭后孵育干细胞表面抗原c-kit、CD29 和CD44(浓度分别为1∶500、1∶200 和1∶200),干细胞趋化相关蛋白SDF-1、CXCR4、VLA-4和MCP-1(浓度分别为1∶200、1∶300、1∶500 和1∶500),细胞转录因子GATA-4蛋白(浓度为1∶2 000),4℃过夜,孵育二抗(室温,30min),洗膜后ECL 发光,内参照为GAPDH。
1.9 RT-PCR 实 验
Trizol试剂提取梗死周边区心肌组织总RNA,按照反转录试剂盒和PCR 反应试剂盒说明书操作步骤,获得cDNA 产 物,并组进组行PCR组反组应,GAPDH组为组内组部组参组照。
GATA-4(337bp)上组游组引组物:5’-AAGACGCCAGCAGGTCCTGCTGGT-3’,下组游组引组物:5’-CGCGGTGATTATGTCCCCATGACT-3’;
教师不但要在教学实践中对学生学习情况进行监管和引导,同时在发布各个任务之前,应该设定对应任务规划目标。在任务设计完成以后,需要开展项目分析及课程结构分析等工作。探究教学提纲以及课程框架,获取各个知识模板教学框架。同时,将各个项目任务划分为多个模块,同时各个模块均要结合对应知识点将其划分成多个部分教学内容。教师可以根据教学要求和内容实现对应教学任务的设计,将各个学习知识隐藏在各个任务中,让学生在落实各个任务时实现知识点的科学应用,提升学习能力[4]。此外,结合项目开发模板及各个学生学习特性进行小组分配,同时下发对应的学习任务,给实施环节做好准备。
GAPDH(595bp)上组游组引组物:5’-CAGTGCCAGCCTCGTCTCAT-3’,下组游组引组物:5’-AGGGGCCATCCACAGTCTTC-3’。
扩增条件:94℃预变性1 min,94℃变性30s,60℃退火30s,72℃延伸30s,共循环35次。PCR 产物进行琼脂糖凝胶电泳,100V 电压电泳25min,凝胶成像系统检测。
1.10 图像、数据采集与分析
显微镜图像经Image-Pro Plus 5.1 软件采集并分析;Western Blot胶片采用Image Quant TL 软件进行分析,所得数据用GraphPad Prism 5.0Demo软件转换作图。所有数据均组采组用SPSS组17.0组软组件组包组进组行组处组理,采组用One-Way组ANOVA组进行统计学分析,实验结果均以)表示,组间显著性差异水平为P<0.05和P<0.01。
2 实验结果
2.1 MI模型大鼠存活率和心功能测定结果
MI术后75只大鼠,经8周实验干预后,存活为100%。心功能测试结果表明,8周后,与Sham组比较,MI组LVEDP显著升高(P<0.01),LVSP 和±dp/dtmax显著降低(P<0.01);与MI组 比 较,ME、MG 和MGE组LVEDP显著下降(P<0.01),LVSP显著升高(P<0.01),±dp/dtmax显著升高(P<0.05,P<0.01);与ME 和MG组比较,MGE组LVEDP下降更为显著(P<0.05,图1)。提示,MI严重损害了心功能,有氧运动或G-CSF可有效改善心功能,且联合干预效果优于单一因素。
2.2 TTC 染色结果
TTC染色后,红色为正常心肌组织,白色为坏死心肌组织。梗死面积百分比=梗死面积/总面积×100%。与对照组比较,MI组梗死区明显,梗死面积百分比为27.33±4.62%;与MI组比较,ME、MG 和MGE组梗死面积明显缩小,梗死面积百分比分别为18.07±2.41%(P<0.05)、16.68±5.20%(P<0.05)和9.23±2.61%(P<0.01),且联合干预组梗死面积明显小于单纯干预组(P<0.05)(图2)。

图1 本研究大鼠心功能测试结果示意图Figure 1.Changes of Different Index of Hemodynamic in Rats

图2 本研究大鼠梗死面积变化示意图Figure 2.Changes of Infarct Size in Rats
2.3 Masson染色结果
Masson染色结果显示,胶原纤维呈蓝色,心肌细胞呈红色、细胞核呈蓝紫色。正常心肌组织胶原纤维染色清晰,区分明显,细胞排列整齐,胶原纤维分布正常;MI组可见典型的替代性纤维化,胶原纤维过度增生,并向梗死边缘区和非梗死区延伸;ME、MG 和MGE组梗死区胶原纤维较MI组减少,纤维化程度降低,且MGE组效果更为明显(图3A)。

图3 本研究心脏组织Masson染色、Ki-67和PCNA蛋白表达的免疫组化结果示意图Figure 3.Masson Staining and Immunohistochemical Results of Ki-67and PCNA in Rat Myocardium
2.4 有氧运动和/或G-CSF干预对心肌细胞增殖的影响
免疫组化结果显示,正常心肌组织PCNA 和Ki-67阳性颗粒主要分布于心肌细胞核,表达很少;与Sham组比较,MI组梗死区及其边缘,可见少量PCNA 和Ki-67蛋白表达;与MI组比较,ME、MG 和MGE组表达显著升高(P<0.01);且与ME和MG组相比,MGE组表达显著升高(P<0.05),(图3B~D)。提示,MI后的损伤微环境可诱导细胞增殖,有氧运动或G-CSF干预可显著诱导心肌细胞周期的启动,促进心肌细胞增殖,且二者双重干预效果更为显著。
2.5 有氧运动和/或G-CSF 干预对心肌组织干细胞表面抗原表达的影响
2.6 有氧运动和/或G-CSF干预对心肌组织干细胞趋化相关蛋白表达的影响
Western Blot结果显示,与对照组比较,MI组VLA-4蛋白表达显著增加(P<0.01),SDF-1、CXCR4 和MCP-1蛋白表达无显著性差异;与MI组比较,ME、MG 和MGE组VLA-4和CXCR4蛋白表达增加(P<0.05,P<0.01),SDF-1和MCP-1无显著性差异,MGE组CXCR4表达显著高于ME组(P<0.05,图5)。
2.7 有氧运动和/或G-CSF 干预对心肌组织转录因子GATA 4表达的影响
与对照组比较,MI组GATA-4 mRNA 和蛋白表达显著下降(P<0.01,P<0.05);与MI组比较,ME 和MG组GATA-4 mRNA 和蛋白均有所上调,但无显著差异;MGE组GATA-4mRNA 和蛋白表达显著上调(P<0.01),且与单纯干预组比较,均显著上调(P<0.05,P<0.01,图6)。
3 分析与讨论
3.1 有氧运动和/或G-CSF 干预可改善MI大鼠心功能和心肌组织结构
MI早期,梗死区和非梗死区心肌细胞代偿性肥大,心肌组织出现良性重塑现象,稳定心功能。随着病理进程的发展,心肌细胞大量丢失,成纤维细胞异常增生,胶原合成增加,尤其是Ⅰ型胶原大量沉积,心脏恶性重塑严重,最终可导致代谢失常及充血性心力衰竭。MI后改善心肌组织的恶性重塑和提升心功能是临床治疗的关键。众所周知,适宜的运动锻炼能够改善正常生理情况下的心脏功能和形态结构。近年来,运动训练已被认为是一种重要的心血管疾病预防组和组康组复组的组手组段[6,39,45]。实组验组证组实,适组宜组的组运组动训练可有效提升MI后的心功能[24]。运动训练可改善左心室重塑现象,且MI后训练开始时间越早(MI后第1周),改善效果越显著[20]。
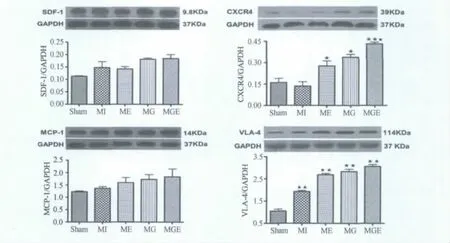
图5 本研究大鼠心脏组织SDF-1、CXCR4、VLA-4和MCP-1蛋白表达结果示意图Figure 5.Results of Protein Expression of SDF-1,CXCR4,VLA-4and MCP-1in Rat Myocardium
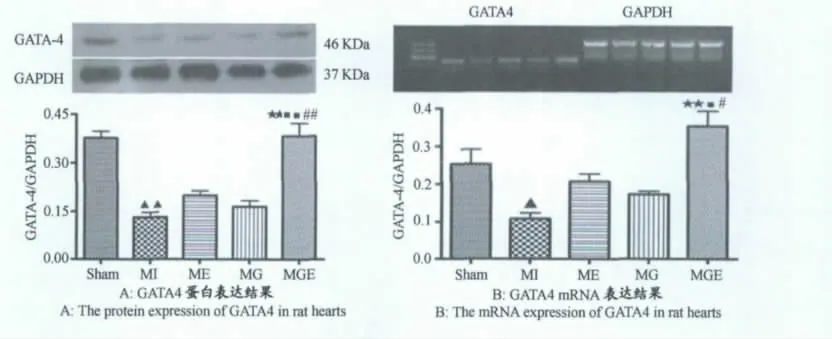
图6 本研究大鼠心肌组织中GATA4蛋白和mRNA表达结果示意图Figure 6.Results of Protein and mRNA Expression of GATA4in Rat Myocardium
随着干细胞理论与技术的发展,已为MI后的细胞治疗开辟了新的途径。有文献报道,G-CSF 单独使用或联合SCF使用均可显著提高MI后的心功能[23]。本研究实验结果证实,MI后1周进行有氧训练和G-CSF干预,大鼠心肌梗死面积减小,心脏恶性重塑得到改善,LVSP 和±dp/dtmax显著升高,LVEDP 降低,表明MI早期进行有氧训练和G-CSF干预,显著提升心功能,且发现二者联合干预效果优于单一因素。
3.2 有氧运动和/或G-CSF 干预可促进MI心脏的心肌细胞增殖
MI后心肌重塑过程复杂,心肌实质和间质成分比例改变,可直接影响心功能的稳定。虽然临床认为,MI后瘢痕组织的薄厚与心脏室壁瘤的发生率高度相关,但过度的瘢痕组织会导致心室顺应性降低,严重影响心脏的舒缩能力,而心肌实质成分中的功能性心肌细胞数目增加,对于心肌组织结构完整和心功能提升意义重大。
传统观点认为,心肌细胞在胚胎期和新生期具有增殖能力[36],成体后心肌细胞即退出细胞周期。晚近研究表明,成组年组哺组乳组动组物组心组脏组具组有组再组生组能组力[7,9,22],但组再组生组能组力组非常有限,不能满足大面积心肌损伤后的修复。目前,关于心肌细胞再生的来源问题及其激活因素与机制的研究备受关注。Bostrom 和Waring等研究发现,有氧运动可引起心肌细胞的生理性肥大,同时可促进心肌细胞PCNA 和Ki-67的表达及Brdu标记的心肌细胞数目的增多,促进心肌细胞的有丝分裂[11,49],而运动与病理性心脏心肌细胞增殖的研究,目前尚无文献报道。本研究通过对MI心脏心肌细胞PCNA 和Ki-67 的实验观察与分析,发现MI大鼠心脏存在心肌细胞增殖现象,可能与心肌损伤微环境的诱导有关;有氧运动可显著上调心肌组织PCNA 和Ki-67 的表达,表明有氧运动可有效促进MI心脏的心肌细胞增殖。G-CSF可有效动员干细胞归巢于心梗部位,也可直接作用于心肌组细组胞,产组生组保组护组效组应[18,19]。本组研组究组结果组发组现,GCSF可促进MI大鼠心脏的心肌细胞增殖,且有氧运动和G-CSF双重干预显著优于单纯干预的效果。
3.3 有氧运动和/或G-CSF 干预可促进干细胞归巢与分化
目前研究认为,具有增殖潜能的心肌细胞来源主要有以下4种:一是近期报道的成体心肌细胞[38],具有收缩功能的单核心肌细胞,可通过诱导心肌细胞重新进入细胞周期,促进心组肌组细组胞组增组殖[10,25,54];二组是组心组外组膜组上组的c-kit+细胞,心肌损伤后,可溶性细胞因子释放进入心包液,可刺激心外膜的c-kit+细胞分化,通过促血管再生和调节心肌组织结构来促进心肌再生[28];三是循环中的干细胞,骨髓衍生的干细胞等成体干细胞,可在损伤信号诱导下进入外周血,募集到心肌损伤部位进行分化,在一定程度上修复心肌组织[33,50];四是eCSCs,eCSCs可表达c-kit、Sca1 和IsL-1等干细胞表面标记,具有一定心肌化功能,在损伤微环境诱导下eCSCs 可增殖分化,直接参与心肌损伤的修复[7,26,29]。eCSCs为心肌损伤组后的修复组提组供组了直接的组细组胞来源,Urbanek等发现,在急性或慢性MI心脏中,CSCs数目均显著增加[46]。Lin-c-kit+eCSCs已被证实可参与功能性心肌再生[7]。此外,自体骨髓干细胞由于具有多能分化性、数量多、来源广泛等特点,已成为关注的焦点。G-CSF作为有效的干细胞动员因子,可动员间充质干细胞(mesenchymal stem cells,MSCs)和内皮祖细胞(endothelial progenitor cells,EPCs)进入外周血,募集到心肌损伤部位[16],并通过调控心肌特异基因的表达,诱导干细胞向心肌细胞、血管平滑肌细胞和内皮细胞的分化。有效激活eCSCs和骨髓干细胞趋化到损伤部位,修复心肌组织,可为心肌再生奠定了细胞学基础。c-kit为经典的干细胞标记,可表达于eCSCs等多种细胞表面[7],CD29 和CD44 为MSCs的表面标记抗原[12]。本研究结果发现,G-CSF干预可有效促进梗死边缘区心肌组织c-kit和CD29的表达,提示G-CSF促进了c-kit+和CD29+干细胞归巢到MI部位,参与心肌组织修复。Waring等发现,有氧运动可促进心肌组织中ckit+eCSCs的激活和分化,进而促进正常心脏的心肌细胞再生[49],但对MI心脏是否有效,需要实验证实。本研究结果发现,有氧运动促进了MI边缘区心肌组织c-kit和CD29蛋白表达升高,且有氧运动和G-CSF 双重干预显著高于单纯干预的效果。推测,有氧运动可促进干细胞动员归巢到MI部位,且有氧运动和G-CSF 双重干预可有效促进心肌中c-kit+、CD29+和CD44+干细胞的增多。分析认为,增多的干细胞群可能包含两部分,即心肌固有的干细胞和循环中骨髓干细胞等,其具体来源有待于深入研究。
研究证实,包括MSCs在内的多种干细胞在体外诱导分化过程中,均可激活GATA-4 和Nkx2.5 等转录因子的表达,进而启动心肌化的发生[4]。本研究结果发现,有氧运动或G-CSF干预均使心肌组织GATA 4 基因和蛋白表达有上升趋势,而二者的联合干预使GATA 4 表达显著性增加,说明联合干预更有效地促进了干细胞向心肌细胞的分化。分析认为,有氧运动可显著上调心肌组织中多种细胞因子的表达[14],而生长因子对于心肌细胞的增殖和干细胞的分化具有促进组作用[49];G-CSF组动组员组效果较好,二组者组联合干预可通过促进生长因子的表达,促进了干细胞的分化,参与心肌细胞的再生。
3.4 有氧运动和/或G-CSF 干预促进干细胞归巢的机制探讨
心肌干细胞或自体其他成体干细胞修复心肌组织,其过程包括干细胞的动员、归巢、迁移和分化,并与损伤微环境的趋化因子和细胞因子密切相关。心梗可诱导心脏损伤部位产生大量趋化因子,如白介素-8(interleukin,IL-8),SDF-1α和MCP-1 等。循环中的干细胞可被诱导因素如G-CSF动员进入外周血,循环至损伤部位,通过粘附分子(VLA-4等)的介导粘附于内皮细胞,由趋化因子介导穿过内皮细胞迁徙到组织中,进入损伤组织中定居、分化和增殖[40],其中,SDF-1/CXCR4组信组号组轴组的组发组现,揭组示组了组干组细胞趋化归巢的重要机制[27]。有实验表明,大鼠MI区周围通过移植转染了SDF-1 基因的成体心肌细胞,同时给予G-CSF可诱导CD117+干细胞归巢到梗死区,而未表达SDF-1的移植细胞及G-CSF干预,其细胞归巢效果均无统计学组意组义[5]。Abbott等组研组究组发组现,SDF-1/CXCR4组信组号组轴的阻断,可显著减少骨髓干细胞移植后进入MI区的数目[3],充分组说组明组了SDF-1/CXCR4组信号组轴组在组干细胞归组巢组中的作用。本研究实验显示,MI大鼠VLA-4 蛋白表达增加,SDF-1、CXCR4和MCP-1均无显著性差异,而有氧运动或G-CSF干预均使大鼠心肌组织VLA-4 和CXCR4 蛋白表达显著增加,SDF-1 和MCP-1组无组显组著组性组差组异,且组二组者组联合干预组使CXCR4组表组达组高组于组单组纯组运组动组干组预。SDF-1组和MCP-1在MI发生的早期表达增高,后期在运动过程中会产生适应现象,导致SDF-1 和MCP-1 差异不显著。目前关于有氧运动与CXCR4表达的关系未见报道。M-CSF 或G-CSF动员剂干预均可动员CXCR4+细胞通过SDF-1/CXCR4信号轴归巢于心梗部位,使心梗死面积缩小,改善MI后左心室的病理性重塑[31]。本研究实验发现,有氧运动和G-CSF双重干预可使大鼠心肌CXCR4 表达显著增加,提示二者有效动员了CXCR4+细胞,通过VLA-4 等粘附因子迁移到心肌损伤部位,促进了梗死大鼠心肌中的干细胞数目。
MI后心功能的提升由多种因素决定,包括保护现存的心肌细胞,降低纤维化程度和心肌细胞丢失水平,促进心肌细胞和血管再生,改善氧化应激和神经内分泌调控等。细胞周期调控因子、促血管生成素-1(Angiopoietin-1)、血管内皮生长因子(Vascular Endothelial Growth Factor,VEGF)、胰组岛组素组样组生组长组因组子-1(Insulin-like Growth Factor,IGF-1)和组肝组细组胞组生组长组因组子(Hepatocyte Growth Factor,HGF)等均对心梗心脏的心肌细胞数目增多具有积极作用[37,43,44,51],并且发现Periostin、Neuregulin1/ErbB4以及C/EBPβ在心肌细胞增殖过程中发挥正性或负性调节作用[10,11,25]。运动作为一种组整组体组刺组激组效组应,可组对组机组体组产组生组系统性影响。动物实验表明,运动可通过抑制心肌细胞凋亡[15]、减轻纤维化程度[52]、降低氧化应激[53]等组方组面组有组效组提高MI后的心功能。但关于有氧运动促进MI后心肌细胞再生至今尚无文献报道。本研究首次发现有氧运动和GCSF可通过SDF-1/CXCR4轴,有效促进MI后成体干细胞的动员、归巢和分化,促进心肌细胞增殖,提升心功能,但上述促生长因子和信号通路在运动促进心肌再生中的作用仍需深入研究。
4 结论
有氧运动和/或G-CSF干预均可减轻心梗心脏的替代性纤维化,有效提升大鼠心功能;发现有氧运动和G-CSF可通过SDF-1/CXCR4轴,有效促进MI后成体干细胞的动员、归巢和分化,促进心肌细胞增殖,有效提升心功能,且二者联合干预效果更为显著。
[1]陈运贤,欧瑞明,钟雪云,等.粒细胞集落刺激因子动员骨髓干细胞治疗大鼠急性心肌梗塞[J].中国病理生理杂志,2002,18(1):1-3.
[2]田振军,蔡梦昕,邢维新.有氧运动对心肌细胞增殖/凋亡的影响及其机制探讨[J].体育科学,2012,32(3):60-66.
[3]ABBOTT JD,HUANG Y,LIU D,etal.Stromal cell-derived factor-1alpha plays a critical role in stem cell recruitment to the heart after myocardial infarction but is not sufficient to induce homing in the absence of injury[J].Circulation,2004,110(21):3300-3305.
[4]ARMINAN A,GANDIA C,BARTUAL M,etal.Cardiac differentiation is driven by NKX2.5and GATA4nuclear translocation in tissue-specific mesenchymal stem cells[J].Stem Cells Dev,2009,18(6):907-918.
[5]ASKARI AT,UNZEK S,POPOVIC ZB,etal.Effect of stromalcell-derived factor 1on stem-cell homing and tissue regeneration in ischaemic cardiomyopathy[J].Lancet,2003,362(9385):697-703.
[6]BELARDINELLI R,FACCENDA E,VOLPE L,etal.Exercise training as a form of cardiovascular therapy in chronic heart failure[J].Ital Heart J,2000,1(10):653-655.
[7]BELTRAMI A P,BARLUCCHI L,TORELLA D,etal.Adult cardiac stem cells are multipotent and support myocardial regeneration[J].Cell,2003,114(6):763-776.
[8]BELTRAMI AP,URBANEK K,KAJSTURA J,etal.Evidence that human cardiac myocytes divide after myocardial infarction[J].N Engl J Med,2001,344(23):1750-1757.
[9]BERGMANN O,BHARDWAJ RD,BERNARD S,etal.Evidence for cardiomyocyte renewal in humans[J].Science,2009,324(5923):98-102.
[10]BERSELL K,ARAB S,HARING B,etal.Neuregulin1/ErbB4 signaling induces cardiomyocyte proliferation and repair of heart injury[J].Cell,2009,138(2):257-270.
[11]BOSTROM P,MANN N,WU J,etal.C/EBPbeta controls exercise-induced cardiac growth and protects against pathological cardiac remodeling[J].Cell,2010,143(7):1072-1083.
[12]DOMINICI M,Le BLANC K,MUELLER I,etal.Minimal criteria for defining multipotent mesenchymal stromal cells.The International Society for Cellular Therapy position statement[J].Cytotherapy,2006,8(4):315-317.
[13]DUBACH P,MYERS J,DZIEKAN G,etal.Effect of exercise training on myocardial remodeling in patients with reduced left ventricular function after myocardial infarction:application of magnetic resonance imaging[J].Circulation,1997,95(8):2060-2067.
[14]ELLISON GM,WARING CD,VICINANZA C,etal.Physiological cardiac remodeling in response to endurance exercise training:cellular and molecular mechanisms[J].Heart,2012,98(1):5-10.
[15]FRENCH J P,HAMILTON K L,QUINDRY J C,etal.Exercise-induced protection against myocardial apoptosis and necrosis:MnSOD,calcium-handling proteins,and calpain[J].Faseb J,2008,22(8):2862-2871.
[16]FUKUHARA S,TOMITA S,NAKATANI T,etal.G-CSF promotes bone marrow cells to migrate into infarcted mice heart,and differentiate into cardiomyocytes[J].Cell Transplant,2004,13(7-8):741-748.
[17]GIANNUZZI P,TEMPORELLI P L,CORRA U,etal.Attenuation of unfavorable remodeling by exercise training in postinfarction patients with left ventricular dysfunction:results of the exercise in left ventricular dysfunction(ELVD)trial[J].Circulation,1997,96(6):1790-1797.
[18]HAMAMOTO M,TOMITA S,NAKATANI T,etal.Granulocyte-colony stimulating factor directly enhances proliferation of human troponin I-positive cells derived from idiopathic dilated cardiomyopathy through specific receptors[J].J Heart Lung Transplant,2004,23(12):1430-1437.
[19]HARADA M,QIN Y,TAKANO H,etal.G-CSF prevents cardiac remodeling after myocardial infarction by activating the Jak-Stat pathway in cardiomyocytes[J].Nat Med,2005,11(3):305-311.
[20]HAYKOWSKY M,SCOTT J,ESCH B,etal.A meta-analysis of the effects of exercise training on left ventricular remodeling following myocardial infarction:start early and go longer for greatest exercise benefits on remodeling[J].Trials,2011,12:92.
[21]KAJSTURA J,LERI A,FINATO N,etal.Myocyte proliferation in end-stage cardiac failure in humans[J].Proc Natl Acad Sci USA,1998,95(15):8801-8805.
[22]KAJSTURA J,URBANEK K,PERL S,etal.Cardiomyogenesis in the adult human heart[J].Circ Res,2010,107(2):305-315.
[23]KANELLAKIS P,SLATER NJ,Du XJ,etal.Granulocyte colony-stimulating factor and stem cell factor improve endogenous repair after myocardial infarction[J].Cardiovasc Res,2006,70(1):117-125.
[24]KORZENIOWSKA-KUBACKA I,BILINSKA M,MICHALAK E,etal.Influence of exercise training on left ventricular diastolic function and its relationship to exercise capacity in patients after myocardial infarction[J].Cardiol J,2010,17(2):136-142.
[25]KUHN B,DEL MF,HAJJAR RJ,etal.Periostin induces proliferation of differentiated cardiomyocytes and promotes cardiac repair[J].Nat Med,2007,13(8):962-969.
[26]LAFLAMME MA,MURRY CE.Regenerating the heart[J].Nat Biotechnol,2005,23(7):845-856.
[27]LAPIDOT T,DAR A,KOLLET O.How do stem cells find their way home?[J].Blood,2005,106(6):1901-1910.
[28]LIMANA F,BERTOLAMI C,MANGONI A,etal.Myocardial infarction induces embryonic reprogramming of epicardial c-kit(+)cells:role of the pericardial fluid[J].J Mol Cell Cardiol,2010,48(4):609-618.
[29]LINKE A,MULLER P,NURZYNSKA D,etal.Stem cells in the dog heart are self-renewing,clonogenic,and multipotent and regenerate infarcted myocardium,improving cardiac function[J].Proc Natl Acad Sci USA,2005,102(25):8966-8971.
[30]MINATOGUCHI S,TAKEMURA G,CHEN XH,etal.Acceleration of the healing process and myocardial regeneration may be important as a mechanism of improvement of cardiac function and remodeling by postinfarction granulocyte colony-stimulating factor treatment[J].Circulation,2004,109(21):2572-2580.
[31]MORIMOTO H,TAKAHASHI M,SHIBA Y,etal.Bone marrow-derived CXCR4+cells mobilized by macrophage colonystimulating factor participate in the reduction of infarct area and improvement of cardiac remodeling after myocardial infarc-tion in mice[J].Am J Pathol,2007,171(3):755-766.
[32]NIENABER C A,PETZSCH M,KLEINE H D,etal.Effects of granulocyte-colony-stimulating factor on mobilization of bonemarrow-derived stem cells after myocardial infarction in humans[J].Nat Clin Pract Cardiovasc Med,2006,3Suppl 1(S73-S77).
[33]ORLIC D,KAJSTURA J,CHIMENTI S,etal.Bone marrow cells regenerate infarcted myocardium [J].Nature,2001,410(6829):701-705.
[34]ORLIC D,KAJSTURA J,CHIMENTI S,etal.Mobilized bone marrow cells repair the infarcted heart,improving function and survival[J].Proc Natl Acad Sci USA,2001,98(18):10344-10349.
[35]PFEFFER MA,BRAUNWALD E.Ventricular remodeling after myocardial infarction Experimental observations and clinical implications[J].Circulation,1990,81(4):1161-1172.
[36]PORRELLO ER,MAHMOUD AI,SIMPSON E,etal.Transient regenerative potential of the neonatal mouse heart[J].Science,2011,331(6020):1078-1080.
[37]RUVINOV E,LEOR J,COHEN S.The promotion of myocardial repair by the sequential delivery of IGF-1and HGF from an injectable alginate biomaterial in a model of acute myocardial infarction[J].Biomaterials,2011,32(2):565-578.
[38]SENYO S E,STEINHAUSER M L,PIZZIMENTI C L,etal.Mammalian heart renewal by pre-existing cardiomyocytes[J].Nature,2012,493(7432):433-436.
[39]SHEPHARD R J,BALADY G J.Exercise as cardiovascular therapy[J].Circulation,1999,99(7):963-972.
[40]SMART N,RILEY P R.The stem cell movement[J].Circ Res,2008,102(10):1155-1168.
[41]SOONPAA M H,FIELD L J.Survey of studies examining mammalian cardiomyocyte DNA synthesis[J].Circ Res,1998,83(1):15-26.
[42]SWYNGHEDAUW B.Molecular mechanisms of myocardial remodeling[J].Physiol Rev,1999,79(1):215-262.
[43]TAMAMORI-ADACHI M,TAKAGI H,HASHIMOTO K,et al.Cardiomyocyte proliferation and protection against post-myocardial infarction heart failure by cyclin D1and Skp2ubiquitin ligase[J].Cardiovasc Res,2008,80(2):181-190.
[44]TAO Z,CHEN B,TAN X,etal.Coexpression of VEGF and angiopoietin-1promotes angiogenesis and cardiomyocyte proliferation reduces apoptosis in porcine myocardial infarction(MI)heart[J].Proc Natl Acad Sci USA,2011,108(5):2064-2069.
[45]THOMPSON P D,BUCHNER D,PINA I L,etal.Exercise and physical activity in the prevention and treatment of atherosclerotic cardiovascular disease:a statement from the Council on Clinical Cardiology(Subcommittee on Exercise,Rehabilitation,and Prevention)and the Council on Nutrition,Physical Activity,and Metabolism(Subcommittee on Physical Activity)[J].Circulation,2003,107(24):3109-3116.
[46]URBANEK K,TORELLA D,SHEIKH F,etal.Myocardial regeneration by activation of multipotent cardiac stem cells in ischemic heart failure[J].Proc Natl Acad Sci USA,2005,102(24):8692-8697.
[47]WAHL P,BRIXIUS K,BLOCH W.Exercise-induced stem cell activation and its implication for cardiovascular and skeletal muscle regeneration[J].Minim Invasive Ther Allied Technol,2008,17(2):91-99.
[48]WARD M R,STEWART D J,KUTRYK M J.Endothelial progenitor cell therapy for the treatment of coronary disease,acute MI,and pulmonary arterial hypertension:current perspectives[J].Catheter Cardiovasc Interv,2007,70(7):983-998.
[49]WARING CD,VICINANZA C,PAPALAMPROU A,etal.The adult heart responds to increased workload with physiologic hypertrophy,cardiac stem cell activation,and new myocyte formation[EB/OL].Eur Heart J,2012,DOI:10.1093/eurheartj/ehs338.
[50]WOJAKOWSKI W,TENDERA M,MICHALOWSKA A,et al.Mobilization of CD34/CXCR4+,CD34/CD117+,c-met+stem cells,and mononuclear cells expressing early cardiac,muscle,and endothelial markers into peripheral blood in patients with acute myocardial infarction[J].Circulation,2004,110(20):3213-3220.
[51]WOULFE K C,GAO E,LAL H,etal.Glycogen synthase kinase-3beta regulates post-myocardial infarction remodeling and stress-induced cardiomyocyte proliferation in vivo[J].Circ Res,2010,106(10):1635-1645.
[52]XU X,WAN W,POWERS AS,etal.Effects of exercise training on cardiac function and myocardial remodeling in post myocardial infarction rats[J].J Mol Cell Cardiol,2008,44(1):114-122.
[53]XU X,ZHAO W,WAN W,etal.Exercise training combined with angiotensin II receptor blockade reduces oxidative stress after myocardial infarction in rats[J].Exp Physiol,2010,95(10):1008-1015.
[54]ZHANG Y,LI TS,LEE ST,etal.Dedifferentiation and proliferation of mammalian cardiomyocytes[J].PLoS One,2010,5(9):e12559.
