氢氯噻嗪片抽验结果及溶出度实时测定法的考察
2013-11-10赵庆华
赵庆华,巩 伟,赵 豫
按照全军药品抽验工作计划要求,笔者所在单位在全军医疗机构范围内对氢氯噻嗪片进行了评价性抽验,抽验结果表明,此次抽验覆盖面广,代表性强,在一定程度上反映了我国氢氯噻嗪片产品的总体水平。
1 基本信息
1.1 评价性抽验涉及氢氯噻嗪片的基本信息 见表1。

表1 氢氯噻嗪片的基本信息
1.2 抽验样品机构分布 抽验样品所涉及的医疗卫生机构隶属于各军区和总后勤部的医院、门诊部、干休所、疗养院、部队卫生队以及仓库等医疗卫生机构,具体分布情况见图1。
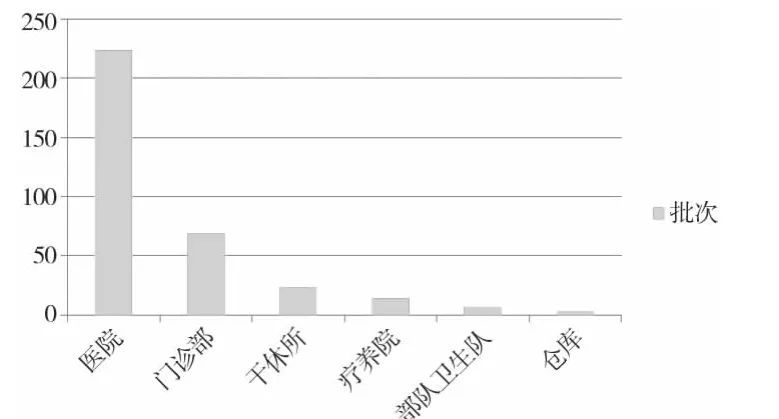
抽验样品的医疗卫生机构分布情况
1.3 检验标准 按中国药典2010年版二部“氢氯噻嗪片”项下检验[1],主要检验项目为【性状】、【鉴别】、【检查】、【其他】、【含量测定】。
1.4 检验结果 抽验氢氯噻嗪片样品数339批,检验结果均符合规定,合格率为100%。全军各大区抽取样品的检验结果未见明显差异。
2 溶出度实时测定法的考察
《中国药典》2010年版对氢氯噻嗪片采用传统溶出度测定法测定其溶出度[1],方法较为繁琐,且无法得知溶出过程中的全部信息。笔者利用本次全军抽验机会,以光纤药物溶出度实时测定仪对部分厂家10批次的氢氯噻嗪片进行了溶出度测定,建立了在线考察氢氯噻嗪片溶出过程的方法,从而比较药物溶出过程的差异,初步评价药品的质量差异。
2.1 仪器与试药
2.1.1 仪器 FODT-601光纤药物溶出度实时测定仪(上海富科思分析仪器有限公司),AE-240型电子天平(上海天普分析仪器有限公司)。
2.1.2 试药 氢氯噻嗪对照品(中国药品生物制品鉴定所,含量99.8%;批号:100309-200702);氢氯噻嗪片(规格:25 mg);A厂:3批,批号101019,标示为样品1;批号101211,标示为样品2;批号110318,标示为样品3;B厂2批:批号110201,标示为样品4;批号110302,标示为样品5;C厂5批:批号110226,标示为样品6;批号110112,标示为样品7;批号101129,标示为样品8;批号101225,标示为样品9;批号110304,标示为样品10。
2.2 方法与结果
2.2.1 检测波长及光程选择 根据标准溶液紫外吸收图谱,选择272 nm作为测定波长,550 nm作为参比波长,以消除溶液中不溶微粒等的干扰。
2.2.2 探头标定 用系列标准溶液分别标定6个光纤探头,进行线性回归,得到6条标准曲线。结果显示,在测定范围内线性关系良好,且6个通道测定结果的均一性较好(表2)。

表2 标准曲线测定结果(n=5)
2.2.3 溶出度试验方法 按中国药典2010年版二部规定的氢氯噻嗪片溶出度测定条件,取6片采用转篮法测定,由光纤药物溶出度原位过程监测仪自动记录吸收度值,绘制溶出曲线。
2.2.4 溶出度试验结果 按上述实验方法,测定了10批样品的溶出度。中国药典2010版二部规定的限度为60%,结果均符合规定。不同厂家之间、同一厂家不同批号样品之间乃至同一厂家同一批样品之间的溶出曲线差异均较大,说明氢氯噻嗪片的生产工艺不稳定,见图2。
2.2.5 统计学分析 在制剂的开发研究中,通过对比不同批次之间的溶出曲线,可以较准确地反映药物处方、工艺、生产场地及规模等因素变化对药物体外释放行为的影响。本文采用计算简单、判定结果可靠的f2因子方法作为评价体外溶出曲线相似性的方法,该方法作为评价体外溶出曲线相似性的方法已经被美国FDA的化学类药物评价与研究中心(CDER)和欧盟药品审评管理局(EMEA)收载并推荐使用。f2因子的计算公式为:
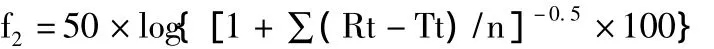
式中,Rt与Tt分别代表参比和受试制剂第t时间点的平均累积释放度,n为测试点数。根据样品溶出曲线,样品1的批内均一性较好,故选取1为参比,样品2~10为受试制剂,选取4、6、8、10、15 min 点的溶出数据,采用相似因子法进行统计分析和比较。一般认为,f2在50~100,可认为2种制剂的溶出过程相似或等同。参比制剂和受试制剂在前4个时间点的组内溶出值RSD不能超过20%,最后1个时间点的RSD不能超过10%,见表3。而统计分析结果显示,2、4、5、9四批样品符合相似因子法对数据变异的要求,其他的不能进行f2因子计算。
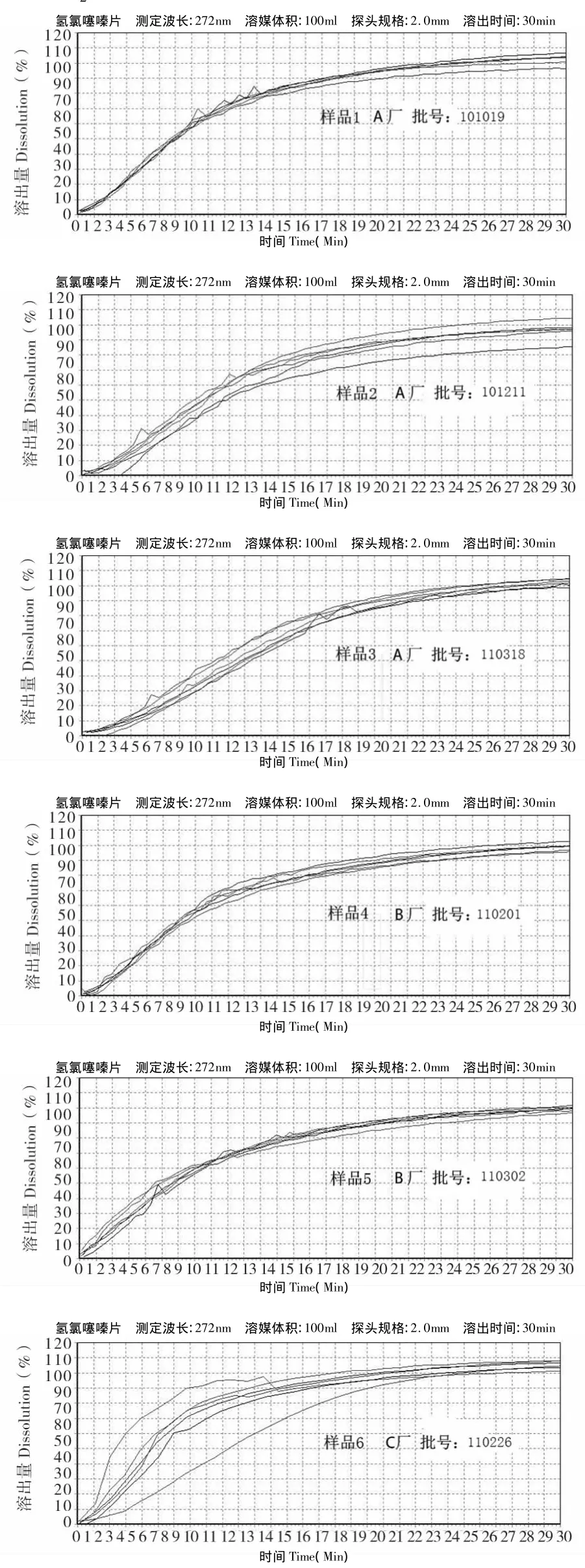
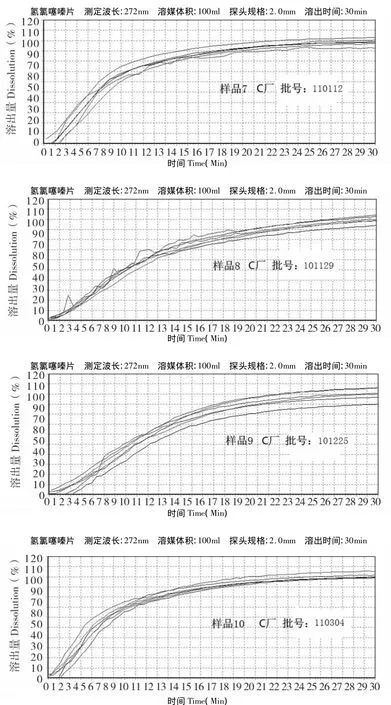
图2 不同厂家氢氯噻嗪片的实时溶出曲线
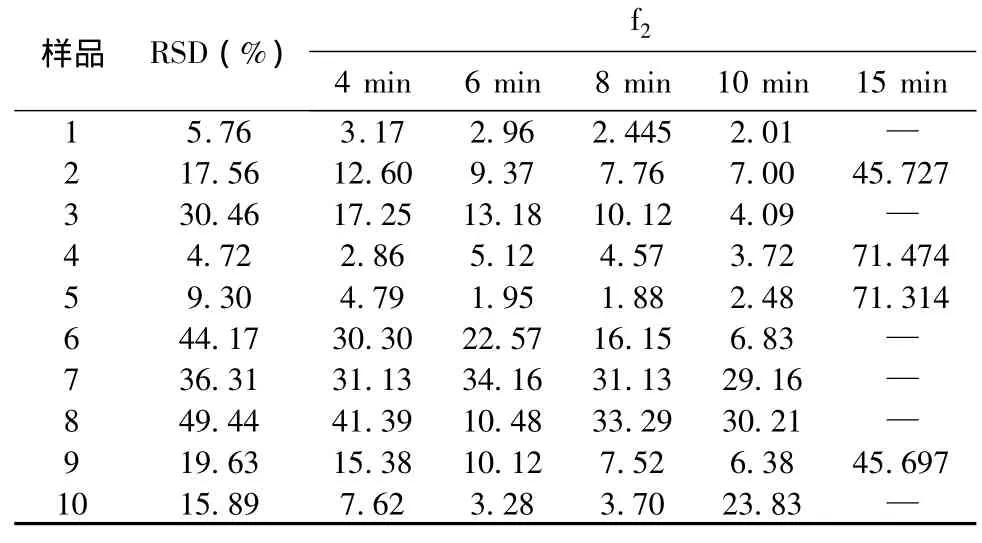
表3 统计分析结果
3 讨论
改进溶出度评价方法,以提高固体药物制剂水平,缩小我国目前药品内在质量方面与进口药品的差距,是我国医药工业发展的迫切需求;而对多个厂家生产的同类品种进行科学、有效的溶出度测定,对于溶出度评价方法的改进工作的实施,能够提供翔实的实验依据。经10批样品溶出过程考察,所有样品均符合中国药典2010版二部的溶出度检查规定,但其溶出过程却各不相同,不同厂家之间、同一厂家批内和批间的药品溶出过程差异均较大,这种差异与药物的疗效密切相关,必然影响药物的临床疗效,实时检测溶出度能较客观地反映固体制剂的质量。而根据传统的标准检验,只能检测终点的溶出值,无法监测其实际溶出过程。因此,改进溶出度评价方法势在必行。相似因子统计分析结果反映出各厂家药品的溶出过程差异较大,可推测不同厂家之间制剂工艺存在较大差异,且同一厂家同批号各片间有的也具有显著性差异。药物溶出度直接影响药物的吸收和生物利用度,从而导致体内作用强度不同,影响临床效果。故制剂研究中对药物溶出速率应予以控制。光纤药物溶出度实时测定仪能够有效监测氢氯噻嗪片的体外溶出过程,为改进制剂工艺、监控制剂工艺稳定性,提高药品分析能力提供有益的参考;且应用这种仪器,可以减轻劳动强度,提高测试精密度,对多数固体制剂质量控制具有现实意义。研究论证采用光纤药物溶出度实时测定法测定药物溶出度的可行性,酌情修订药典标准中【检查】项下溶出度的测定方法。
[1]中华人民共和国药典委员会.中华人民共和国药典(二部)[S].北京:中国医药科技出版社,2010.556.附录XC.
[2013-05-08收稿,2013-06-10修回] [本文编辑:羡秋盛]
