结直肠癌术后化疗药物5-氟尿嘧啶、奥沙利铂和亚叶酸钙的测定
2013-11-07阿依夏木马玉花丁远大
陈 锐,阿依夏木,马玉花,丁远大,封 顺
(1.新疆维吾尔自治区人民医院,新疆乌鲁木齐,830001;2,新疆大学化学化工学院,新疆乌鲁木齐,830046)
结直肠癌是常见的消化道恶性肿瘤,发生率仅次于胃癌和食道癌。近20年来结直肠癌发病率在逐渐增加,且发病年龄趋向老龄化。在西方发达国家,结直肠癌是仅次于肺癌的第2位恶性肿瘤,易发部位为直肠及直肠与乙状结肠交界处,发病多在60~70岁,50岁以下不到20%[1]。目前结直肠癌主要治疗药物为奥沙利铂、5-氟尿嘧啶和亚叶酸钙,并常组合用药。其中奥沙利铂是第1个显现对结直肠癌有效的络铂类烷化剂,同时还有另1个在体内外均有广谱抗肿瘤活性的铂类抗肿瘤药物,目前针对奥沙利铂的检测方法主要是HPLC方法[2-8]。5-氟尿嘧啶是以抗代谢而发挥作用,在细胞内转化为有效的氟尿嘧啶脱氧核苷酸后,通过阻断脱氧核糖尿苷酸受细胞内胸苷酸合成酶转化为胸苷酸,而干扰DNA的合成,其也可干扰RNA的合成,目前常用的检测方法也为HPLC[9-17]。亚叶酸钙,又称甲酰四氢叶酸钙,叶酸,一般用来解毒和治疗贫血,近年来发现其在肿瘤化疗中有新的作用,也常用于结直肠癌的治疗。
随着药物代谢组学研究的快速发展,建立针对肿瘤研究药物代谢组学的一检测方法显得特别重要。目前对上述3种药物的分析方法主要基于紫外分光光度法、毛细管电泳高频电导检测法、HPLC和HPLC-MS法等[18-20],但现有报道均仅能针对其中某一种药物进行定量定性分析,并不能实现对3种药物同时快速检测。尿液作为唯一能够在无创条件下大量获得的体液,本文通过检测尿液中这3种药物的含量,为研究药物在体内的分布、排泄及药物代谢动力学提供了研究基础。
1 资料与方法
1.1 仪器与试剂
BS124S型电子天平(精度0.0001 g,德国Sartorius公司);雷兹MP230型酸度计(上海雷磁仪器厂);高速离心机(美国 BECKMAN公司,CoulterAvanti J-25);C 18 SPE柱(3 mL,500 mg,美国Agilent公司);高纯水系统(韩国Classic UF);日本岛津高效液相色谱系统,包括液相色谱仪LC-10Avp,工作站LC Solution。甲醇(色谱纯,Sigma公司),磷酸(天津市富宇精细化工有限公司),丙酮(天津市富宇精细化工有限公司),奥沙利铂(Oxaliplatin,上海丽臣生物有限公司),5-氟尿嘧啶(5-Fluorouracil,上海丽臣生物有限公司),亚叶酸钙(Leucovorin calciu,上海丽臣生物有限公司)。所有试剂如无特别说明,均为分析纯,使用前不经任何处理;所用水为Milli-Q I级超纯水。
1.2 样品处理
1.2.1 生物样品采集:结直肠癌患者尿液(新疆维吾尔自治区人民医院)4份,均为男性,年龄(55±2)岁 ,身高(170±5)cm,体质量(65±10)kg。
1.2.2 样品预处理:活化SPE小柱:取1 mL甲醇,1 mL水,依次滴加到C18 SPE小柱中,依靠重力,使溶液流出;淋洗:待高纯水从SPE小柱中接近滴完,再量取尿液25 μ L,待尿液全部通过柱子,再分3次加入40%甲醇/水总计1mL,用1.5 mL EP管收集滤液,放入Speed Vac中离心浓缩至干粉状,再加入100 μ L高纯水进行复溶,放入冰箱以备检测。
1.2.3 液相色谱条件:色谱柱:Inertsil ODS(150 mm×4.6 mm,5 μ m);流动相 :A,pH=3磷酸水溶液,B,甲醇;A:B=20:80(v/v),流速:1.0 mL/min;柱温 :室温 ;进样量:20 μ L;检测波长:270 nm。
1.3 标准溶液的配置
分别准确称取纯品5-氟尿嘧啶、奥沙利铂、亚叶酸钙,并准确配成1.0×10-3、5.0×10-3、1.0 ×10-2、5.0 ×10-2、0.1、0.5、1.0 mg/mL 的标准溶液,于冰箱冷藏保存。
2 结 果
2.1 流动相的选择
HPLC进行药品分离时,流动相的选择是最为重要的因素,通过文献检索发现3种药物均为水溶性药物,因此首先考察了H2O/MeOH体系下3种药物的拆分效果。
亚叶酸钙首先出峰,但存在着较为严重的拖尾现象,这是由于亚叶酸钙为碱性药物,在C18柱上有着较为严重的非特异性吸附。为降低非特异性吸附,常通过调整溶液的pH值来减弱拖尾。通过考察不同pH值条件下的分离效果,最终确定最优色谱条件为 pH=3磷酸水溶液/甲醇=80/20(v/v)。在此色谱条件下,3种组分5-氟尿嘧啶、奥沙利铂、亚叶酸钙的保留时间分别为5.251、6.833和 9.187 min,实现了 3种组分的完全分离。而亚叶酸钙在此pH值条件下,以亚叶酸的形式存在,其出峰顺序由首先出峰转变为最后出峰,并且峰形良好。
2.2 方法的线性范围及检出限
配置系列标准品浓度为1.0×10-3、5.0×10-3、1.0 ×10-2、5.0×10-2、0.1、0.5、1.0 mg/mL,以峰面积和质量浓度(mg/mL)做标准曲线,相关数据见表1。从表1可以看出,3种药物的标准曲线均具有良好的线性关系,相关系数均大于0.999,说明此方法可靠,可用于定量分析。

表1 3种结直肠癌常用药品标准曲线线性方程、线性范围、检出限
2.3 实际样品的测定
2.3.1 回收率与精密度实验:由于尿液成分复杂,对其进行分离分析,首先需要对样品进行前处理,将尿液中的蛋白类大分子化合物去除。传统除蛋白的方法为丙酮沉淀法,尽管方法相对简单,但耗时较长,且移除蛋白后,尿液中仍存在着大量的小分子化合物,这些组分的存在也会对3种药物的分离分析存在干扰。为提高分析速度,减少前处理时间,同时尽可能地简化样品的复杂程度,本文选择固相萃取法,选择常用的C18 SPE小柱对尿液进行前处理,并对上样、淋洗、洗脱条件进行了优化,实现了一步简化样品的目的。
为验证方法的可行性,将4个尿样按标准加入法对其回收率进行了测定,所得结果见表2。结果表明药物的平均回收率为93.40%~110.70%,峰面积的RSD均不大于3.1%,表明方法的重复性良好,所建立的方法可用于实际样品中药物的分离分析。
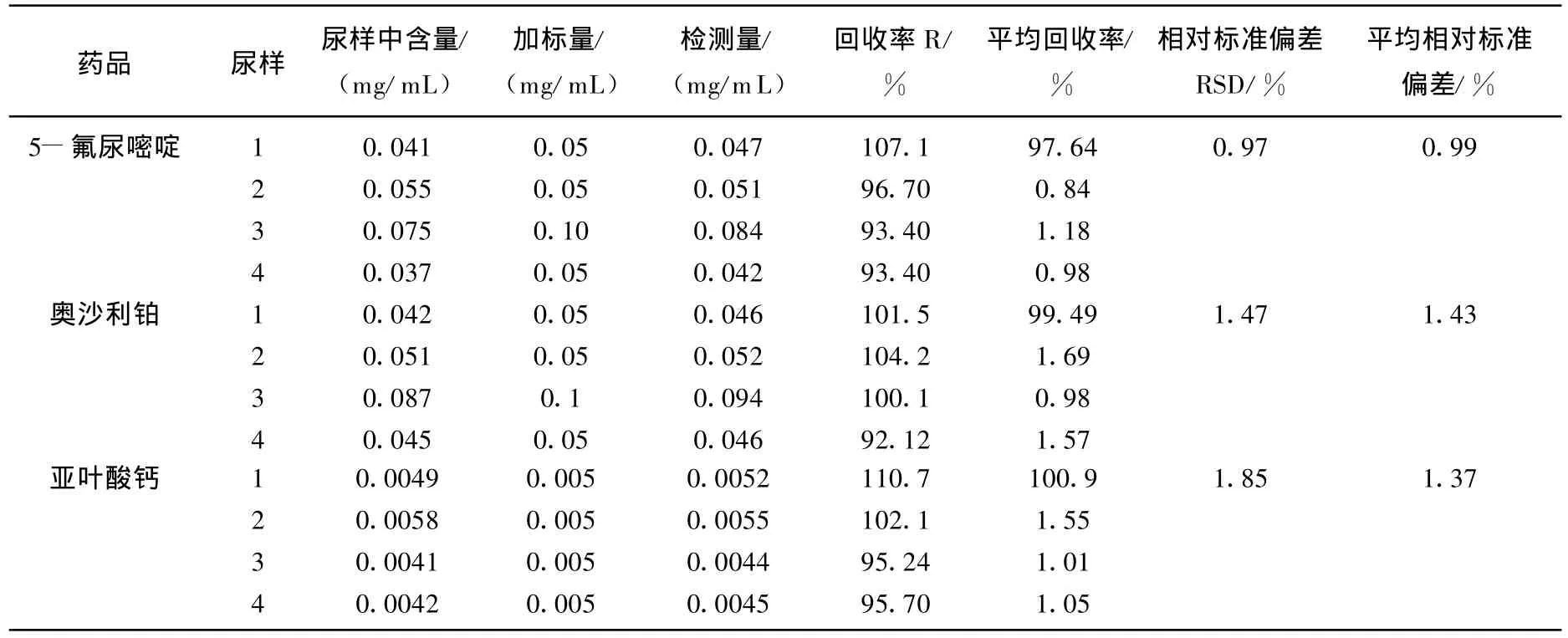
表2 3种结直肠癌常见药物的回收率R(%)和相对标准偏差RSD(%)
2.3.2 患者尿样测定:在优化的色谱条件下,对4个结直肠癌患者尿液样品进行了分析,经过SPE柱处理后的尿液样品相对简单,仅有少量峰出现,且并不干扰3种药物的分离。
[1]董秋美,郑伟华,何友.老年结直肠癌与中青年结直肠癌临床病理特征对比分析[J].南方医科大学学报,2010,30:2128.
[2]李雅静,赵春杰,王晨.奥沙利铂与胰岛素在葡萄糖注射液中配伍稳定性的考察[J].中国药师,2010,13(9):1307.
[3]田琳.HPLC法测定注射用奥沙利铂主药含量[J].中外医疗,2009,14:14.
[4]刘祝东,栾春芳,普绍平.奥沙利铂及其手性异构体的高效液相色谱分析[J].贵金属,2007,28(2):50.
[5]Luo F R,Yen T Y,Wyrick S D,et al.High-performance liquid chromatographic separation of the biotransformation products of oxaliplatin[J].J Chromatogr B,1999,724(2):345.
[6]Koellensperger G,Hann S.Ultra-fast HPLC-ICP-MS analysis of oxaliplatin in patient urine[J].Anal Bioanal Chem 2010,397(3):401.
[7]Mowaka S,Linscheid M.Separation and characterization of oxaliplatin dinucleotides from DNA using HPLC-ESI ion trap mass spectrometry[J].Anal Bioanal Chem,2008,392(5):819.
[8]Mowaka S,Ziehe M,Mohamed D,et al.Structures of oxaliplatin-oligonucleotide adducts from DNA[J].J Mass Spectrom 2012,47(10):1282.
[9]彭书泉,刘晓华,崔慧萍.HPLC法测定5-氟尿嘧啶氯化钠注射液的含量[J].山东医药工业,2002,21(3):16.
[10]黎远东,梁宁生,陆益,等.HPLC法测定人体血浆中5-氟尿嘧啶的浓度[J].广西医科大学学报,2007,24(6):953.
[11]陈碧.HPLC法测定人血清中5-氟尿嘧啶浓度[J].医药沙龙,2005,29(7):332.
[12]张迪,郭宏伟,孙宽,等.HPLC法测定复方氟尿嘧啶注射液含量及有关物质[J].中国药师,2012,15(3):356.
[13]张枫,王桥,宋学英.HPLC测定静脉给药后大鼠血清中5-氟尿嘧啶的含量[J].中国药学杂志,2002,37(6):439.
[14]Buchel B,Rhyn P,Schurch S,et al.LC-MS/MS method for simultaneous analysis of uracil,5,6-dihydrouracil,5-fluorouracil and 5-fluoro-5,6-dihydrouracil in human plasma for therapeutic drug monitoring and toxicity prediction in cancer patients[J].Biomed Chromatogr,2013,27(1):7.
[15]Chen W L,Shen Y Y,Rong H J.Development and application of a validated gradient elution HPLC method for simultaneous determination of 5-fluorouracil and paclitaxel in dissolution samples of 5-fluorouracil/paclitaxel-co-eluting stents[J].J Pharm Biomed Anal,2012,59:179.
[16]Han S W,Lee H J,Bae J M,et al.M ethylation and microsatellite status and recurrence following adjuvant FOLFOX in colorectal cancer[J].Int J Cancer,2013,132(9):2209.
[17]Rao K M,Mallikarjuna B,Krishna Rao KSV,et al.Synthesis and Characterization of pH Sensitive Poly(Hydroxy Ethyl Methacrylate-co-acrylamidoglycolic Acid)Based Hydrogels for Controlled Release Studies of 5-Fluorouracil-International[J].J Polym Mat,2013,62:565.
[18]Icsel C,Yilmaz V T,Ari F,et al.trans-Dichlorido palladium(I I)and platinu m(II)complexes with 2-(hydroxymethyl)pyridine and 2-(2-hydroxyethyl)pyridine:Synthe sis,structural characteriz ation,DNA binding and in vitro cytotoxicity studies[J].Eur J Med Chem 2013,60(3):386.
[19]Crehange G,Bosset J F,Maingon P.Preoperative radiochemotherapy for rectal cancer:Forecasting the next steps through ongoing and forthcoming studies[J].Cancer Radiother 2011,15(6):440.
[20]Nguyen T T,Ostergaard J,Sturup S,et al.Amino acid analysis by using comprehensive two-dimensional gas chromatography[J].Anal Bioanal Chem 2012,402(3):2131-2139.
