顺铂增强食管癌相关基因2蛋白对人食管癌EC9706细胞的增殖抑制和凋亡诱导作用*
2013-11-07宋海岩邓晓慧孙春莉
宋海岩, 邓晓慧, 孙春莉
食管癌是目前全球发病率、死亡率最高的恶性肿瘤之一,晚期食管鳞癌主要治疗手段是化疗,顺铂(cisplatin,DDP)是食管鳞癌治疗最常用的化疗药物之一,但是DDP的副作用较大且易出现肿瘤细胞耐药等情况,限制了其临床应用及疗效。食管癌相关基因2(esophageal cancer-related gene 2,ECRG2)或丝氨酸转肽酶抑制剂Kazal type 7(serine peptidase inhibitor,Kazal type 7,SPINK7)是 Su 等[1]在 1998 年利用mRNA差异显示技术在正常食管组织和来自林县的3对高癌家族中分离与鉴定的新基因(Gen-Bank:AF268198)。体内外实验均证实,ECRG2蛋白能抑制肿瘤细胞生长,促进凋亡[2]。本实验通过观察ECRG2蛋白单用或与DDP联用时对人食管癌EC9706细胞增殖和凋亡的影响,为ECRG2蛋白联合化疗药物用于抗肿瘤提供理论依据。
材料和方法
1 细胞培养及分组
人食管癌EC9706细胞(中科院上海细胞库)在含有10%胎牛血清、1×105U/L青霉素、100 mg/L链霉素的RPMI-1640培养液中,置于37℃、5%CO2培养箱中培养,实验细胞均处于对数生长期。设正常细胞组、ECRG2蛋白组(其终浓度分别为5.5 μg/L、6.5 μg/L、7.5 μg/L 和 8.5 μg/L)和 ECRG2 蛋白+顺铂组(顺铂终浓度为3 mg/L)。
2 试剂
ECRG2蛋白(上海生工),顺铂(齐鲁制药),RPMI-1640培养基和胎牛血清(HyClone),噻唑蓝(MTT)和二甲基亚砜(DMSO,Sigma),细胞凋亡检测试剂盒(碧云天),兔抗p53抗体(Abcam)。
3 EC9706细胞体外增殖抑制实验
采用MTT法,取对数生长期的细胞,调整其浓度为4×107/L,接种于96孔板,每孔体积200 μL,待细胞贴壁后,ECRG2蛋白组分别加入终浓度为5.5 μg/L、6.5μg/L、7.5 μg/L 和 8.5 μg/L 的 ECRG2 蛋白,ECRG2蛋白+顺铂组在以上各ECRG2蛋白组基础上加入终浓度为3 mg/L的顺铂,另设不加药物的正常细胞组,每个浓度均设10个复孔。分别培养24 h、48 h和72 h,于终止前4 h,每孔加入5 g/L MTT溶液20 μL,继续孵育4 h后弃去上清液,加入150μL DMSO,轻轻振荡10 min,使结晶物完全溶解,在酶联分析仪上490 nm波长处测吸光度值(A值)。
4 Hoechst 33258染色法检测细胞凋亡
取对数生长期的细胞,调整其浓度为4×107/L,接种于6孔板(内置载玻片),贴壁后按上述给药浓度分组加药,加药后各组细胞培养24 h,取出细胞爬片,按试剂盒操作步骤进行处理,光镜下观察凋亡细胞并计数。染色后细胞核呈白色的细胞被判为凋亡细胞。随机选取6个高倍镜视野,分别计数凋亡细胞数和总细胞数,计算细胞凋亡率。
5 Western blotting检测凋亡相关蛋白p53的表达
细胞培养24 h后,收集细胞,依次进行蛋白提取、定量(加细胞裂解液裂解、BCA法测定蛋白质浓度),SDS-PAGE电泳,转膜,5%脱脂奶粉液封闭2 h,加Ⅰ抗4℃过夜,TBST洗10 min×3次,加Ⅱ抗(1∶2 000)37 ℃孵育1 h,TBST洗 10 min×3次,按照ECL试剂盒说明进行显色、曝光。
6 统计学处理
数据以均数±标准差(mean±SD)表示,均数比较采用单因素方差分析,应用SPSS 13.0统计软件处理,以P<0.05为差异有统计学意义。
结 果
1 ECRG2蛋白与DDP对EC9706细胞体外增殖的影响
不同浓度ECRG2蛋白对EC9706细胞生长均有抑制作用,其抑制率呈一定的时间和浓度依赖性;不同浓度 ECRG2蛋白与3 mg/L DDP联用后,抑制EC9706细胞增殖作用增强(P<0.01),随着ECRG2蛋白浓度及时间增加,EC9706细胞增殖率显著降低,呈一定的时间、浓度依赖性,见表1。
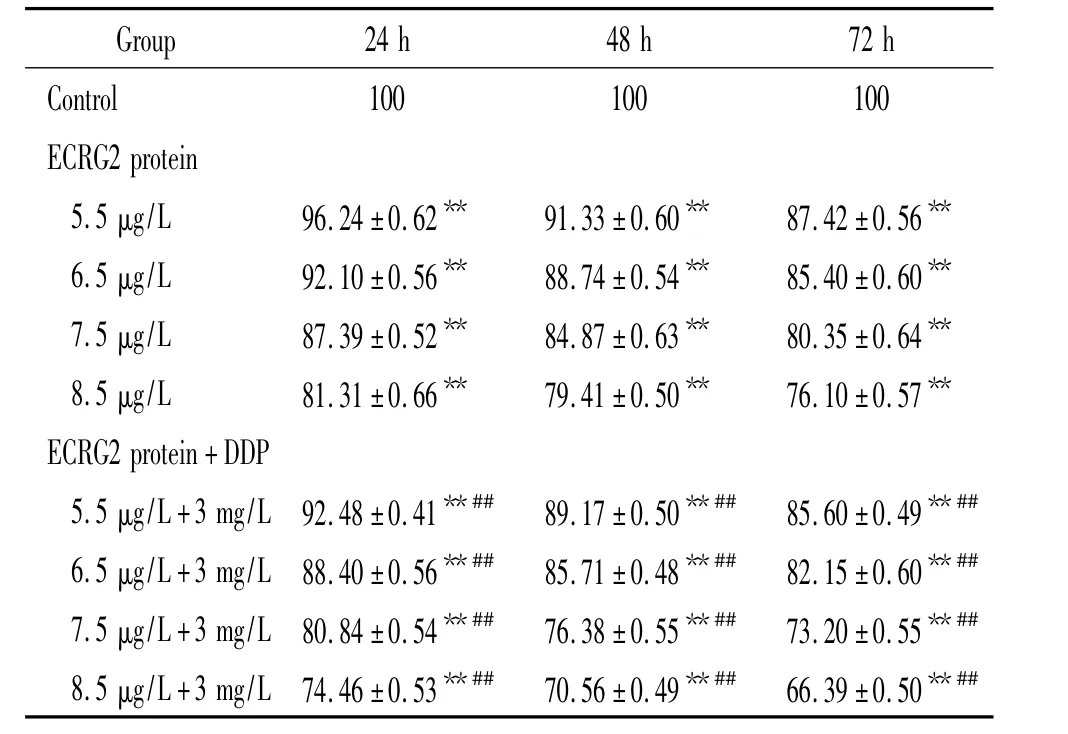
表1 ECRG2蛋白及ECRG2蛋白联合DDP作用不同时间对EC9706细胞增殖的影响Table 1.Effects of ECRG2 protein and ECRG2 protein combined with DDP on EC9706 cell proliferation at different time points(%.Mean±SD.n=24)
2 ECRG2蛋白与DDP对EC9706细胞凋亡的影响
Hoechst 33258染色后,凋亡细胞多表现为胞体缩小、变圆,核浓缩,呈白色。ECRG2蛋白单用时,细胞凋亡率与正常对照组比差异显著,呈一定的量效关系;ECRG2蛋白和DDP联合应用时,随ECRG2蛋白浓度增加EC9706细胞凋亡数目明显增加(P<0.01),呈剂量依赖关系,见图1、表2。

Figure 1.Effects of ECRG2 protein combined with DDP for 24 h on EC9706 cell apoptosis.A:normal control group;B:ECRG2 protein(8.5 μg/L)group;C:ECRG2 protein+DDP(8.5 μg/L+3 mg/L)group.图1 ECRG2蛋白联合DDP作用24 h后对EC9706细胞凋亡的影响
3 ECRG2蛋白与DDP对凋亡相关蛋白p53表达的影响
不同浓度ECRG2蛋白均可促进凋亡相关蛋白p53的表达,与正常对照组比差异显著(P<0.01),呈剂量依赖关系;ECRG2蛋白和DDP联合应用时,随着ECRG2蛋白浓度增加,与单用ECRG2蛋白组相比,EC9706细胞中p53蛋白的表达明显增加(P<0.01),见图 2。

表2 ECRG2蛋白联合DDP作用24 h后对EC9706细胞凋亡的影响Table 2.Effects of ECRG2 protein combined with DDP for 24 h on EC9706 cell apoptosis(%.Mean±SD.n=24)

Figure 2.Expression of p53 detected by Western blotting.A:normal control group;B:ECRG2 protein(5.5 μg/L);C:ECRG2 protein(6.5 μg/L);D:ECRG2 protein(7.5 μg/L);E:ECRG2 protein(8.5 μg/L);F:ECRG2 protein+DDP(5.5 μg/L+3 mg/L);G:ECRG2 protein+DDP(6.5 μg/L+3 mg/L);H:ECRG2 protein+DDP(7.5 μg/L+3 mg/L);I:ECRG2 protein+DDP(8.5 μg/L+3 mg/L).Mean±SD.n=24.**P < 0.01 vs control;##P < 0.01 vs ECRG2 protein at the same dose.图2 Western blotting检测凋亡相关蛋白p53的表达
讨 论
食管癌是目前全球发病率、死亡率最高的恶性肿瘤之一,且预后极差[3-4],中晚期患者5年生存率仅为10%左右。化疗作为食管癌综合治疗的重要手段,顺铂是治疗食管癌常用的化疗药物之一,其主要是通过诱导DNA损伤杀伤肿瘤细胞[5-6],顺铂导致的DNA损伤可以通过激活多种信号通路而激活细胞凋亡信号,最终导致细胞凋亡。但由于其严重的毒性作用,如骨髓抑制、肾脏损伤和神经毒性等,使其临床应用受到一定的限制。因此,临床上主张联合用药,即可提高治疗效果,又能降低铂类为主的化疗药物的临床用量,减低其毒副作用。
ECRG2定位于5q32~33,全长3 540 bp,由4个外显子和3个内含子组成。ECRG2 cDNA全长569 bp,含有一个258 bp的完整编码框,编码一个85个氨基酸残基的多肽。RT-PCR分析显示ECRG2 mRNA在食管及多种正常组织中表达,但在食管癌组织中表达明显下调[7]。体内、体外实验均证实,ECRG2能抑制肿瘤细胞生长、增殖,促进凋亡[2,8-9]。细胞内,ECRG2通过调控p53转录活性及中心体定位能力,参与中心体复制调控。ECRG2基因缺失导致中心体复制异常、多极纺锤体出现,最终导致染色体不稳定性、非整倍体肿瘤细胞出现[10]。肿瘤的发生和发展是肿瘤增殖和分化异常及肿瘤细胞凋亡异常的结果,大多数抗肿瘤药物都能诱导敏感肿瘤细胞发生凋亡,其抗肿瘤效能与肿瘤细胞在药物诱导下发生细胞凋亡的活性有关。因此,诱导瘤细胞凋亡成为肿瘤治疗的一个新热点,评价疗效的一项新指标[11]。本实验MTT结果显示ECRG2蛋白对食管癌EC9706细胞的增殖有明显的抑制作用,随ECRG2蛋白浓度及时间增加EC9706细胞增殖率显著降低,呈一定的时间剂量依赖效应关系;Hoechst染色结果显示ECRG2蛋白可诱导食管癌EC9706细胞凋亡,促使食管癌细胞发生凋亡。
p53是由393个氨基酸组成的转录因子,其与DNA损伤修复、细胞凋亡及肿瘤抑制密切相关[12-14]。p53基因突变在恶性肿瘤的形成与发展中发挥重要作用[15-16]。研究表明,ECRG2不仅可上调p53蛋白的表达,且可影响其转录活性,ECRG2基因转染可干扰人食管癌细胞的正常生长,抑制其增殖,并可通过上调p53发挥其作用[17]。本实验Western blotting结果显示,不同浓度ECRG2蛋白均可促进凋亡相关蛋白p53的表达,ECRG2蛋白和DDP联合应用时,随着ECRG2蛋白浓度增加,EC9706细胞中p53蛋白的表达明显增加,呈剂量依赖关系。
本实验中,DDP与EDRG2蛋白联合应用时,其抑制食管癌EC9706细胞细胞增殖、诱导其凋亡的效应及促进凋亡相关蛋白p53的表达明显强于单独用药时的效应,且随着药物浓度增加,其效应也相应增加,提示ECRG2蛋白和顺铂联合用药比ECRG2蛋白单独用药效果明显。ECRG2蛋白和顺铂联用还可以降低顺铂的药物用量,减少顺铂的毒副作用,达到较好的治疗效果。
[1] Su T,Liu H,Lu S.Cloning and identification of cDNA fragments related to human esophageal cancer[J].Zhonghua Zhong Liu Za Zhi,1998,20(4):254-257.
[2] Cui Y,Wang J,Zhang X,et al.ECRG2,a novel candidate of tumor suppressor gene in the esophageal carcinoma,interacts directly with metallothionein 2A and links to apoptosis[J].Biochem Biophys Res Commun,2003,302(4):904-915.
[3] 马 俊,鲁建军,邹健勇,等.食管鳞状细胞癌中血管内皮生长因子C mRNA的表达及其临床意义[J].中国病理生理杂志,2012,28(8):1510-1512,1520.
[4] 童 强,刘晓波,罗和生,等.食管鳞癌组织中TIG1基因甲基化及其mRNA表达的研究[J].中国病理生理杂志,2012,28(12):2278-2282.
[5] Shahzad MM,Lopez-Berestein G,Sood AK.Novel strategies for reversing platinum resistance[J].Drug Resist Updat,2009,12(6):148-152.
[6] 牟永平,吴 刚,周立社,等.抗肿瘤金属配合物药物及其药理作用的研究进展[J].中国药理学通报,2007,23(11):1409-1413.
[7] 苏 涛,刘海玲,陆士新,等.人食管癌相关基因cDNA片段的克隆与初步鉴定[J].中华肿瘤杂志,1998,20(4):254-257.
[8] Yue CM,Bi MX,Tan W,et al.Short tandem repeat polymorphism in a novel esophageal cancer-related gene(ECRG2)implicates susceptibility to esophageal cancer in Chinese population[J].Int J Cancer,2004,108(2):232-236.
[9] Li MN,Huang G,Guo LP,et al.Inhibitory effects of esophageal cancer related gene 2 on proliferation of human esophageal cancar cell EC9706[J].Zhonghua Yi Xue Za Zhi,2005,85(39):2785-2788.
[10] Cheng X,Shen Z,Yang J,et al.ECRG2 disruption leads to centrosome amplification and spindle checkpoint defects contributing chromosome instability[J].J Biol Chem,2008,283(9):5888-5898.
[11] Tan TT,White E.Therapeutic targeting of death pathways in cancer:mechanisms for activating cell death in cancer cells[J].Adv Exp Med Biol,2008,615:81-104.
[12] Li H,Lakshmikanth T,Carbone E,et al.A novel facet of tumor suppression by p53:Induction of tumor immunogenicity[J].Oncoimmunology,2012,1(4):541-543.
[13]Mai WJ,Liu P,Wang W.Characterization of the tilapia p53 gene and its role in chemical-induced apoptosis[J].Biotechnol Lett,2012,34(10):1797-1805.
[14]Umar M,Upadhyay R,Khurana R.Role of p53 and p73 genes polymorphisms in susceptibility to esophageal cancer:a case control study in a northern Indian population[J].Mol Biol Rep,2012,39(2):1153-1162.
[15] Liu G,Cescon DW,Zhai R,et al.p53 Arg72Pro,MDM2 T309G and CCND1 G870A polymorphisms are not associated with susceptibility to esophageal adenocarcinoma[J].Dis Esophagus,2010,23(1):36-39.
[16] Zhao YP,Wang FR,Shan SL,et al.Genetic polymorphism of p53,but not GSTP1,is association with susceptibility to esophageal cancer risk:a meta-analysis[J].Int J Med Sci,2010,7(5):300-308.
[17]崔永萍,成晓龙,宋肖静.ECRG2基因缺失通过p53途径导致中心体过度复制[J].山西医科大学学报,2008,39(8):677-681.
