TNF-α对HepG2细胞LXRα介导的胆固醇外流的影响及其分子机制*
2013-11-07黄爱龙阮雄中陈压西
仝 莎,陈 曜, 赵 蕾,黄爱龙, 阮雄中,陈压西
(重庆医科大学脂糖代谢性疾病重庆市重点实验室脂质研究中心,重庆400016)
非酒精性脂肪性肝病(non-alcoholic fatty liver disease,NAFLD)是由多种原因引起的肝细胞内中性脂肪(主要是甘油三酯和胆固醇酯)过度堆积的代谢性疾病。肝脏脂质代谢稳态的紊乱是构成各种形式脂肪肝的基础,而炎症在促进肝细胞脂代谢紊乱中扮演重要角色。在生理状态下肝脏内胆固醇的摄取、合成代谢是被严格调控的。近年来,我们研究发现,炎症因子可以通过干扰控制细胞内胆固醇代谢稳态的一些分子表达,改变胆固醇在体内的转运和分布,导致胆固醇过多地沉积在组织细胞内,造成组织器官损害[1-4]。肝 X 受体(liver X receptors,LXRs)是配体激活的核转录因子超家族成员,是将胆固醇分解代谢和脂类合成有机结合起来的平衡点,具有保持细胞内胆固醇平衡和防止脂质毒性的重要作用。LXRs分为LXRα和LXRβ两种亚型,LXRα在肝脏中含量最高,LXRβ则在全身各组织中广泛低表达[5]。LXRα启动子的活性增加可以上调 LXRα的转录从而诱导其下游与胆固醇输出密切相关的ATP结合盒转运蛋白 (ATP-binding cassette transporter A1,ABCA1;ATP-binding cassette transporter G1,ABCG1)的表达来调节细胞内胆固醇的外流。
许多研究发现LXRs与炎症反应有着较密切的关系,LXRα表达增高可以明显抑制炎症因子的活性从而达到抗炎效应[6],然而,炎症因子反过来是否会干扰LXRα及其下游蛋白介导的细胞胆固醇外流却少见报道。本研究利用HepG2细胞模型,观察肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)是否通过干扰LXRα的启动子活性从而使LXRα及其下游蛋白表达异常导致细胞胆固醇外流受阻,加重脂质在肝脏细胞的沉积。
材料和方法
1 材料
HepG2细胞和大肠杆菌菌株DH5α本实验室保存。
2 主要试剂
Kpn I、Xho I及 T4 DNA连接酶购自 TaKaRa;pGL3-Basic质粒和pRL-TK质粒本室保存;转染试剂X-tremeGENE HP DNA Transfection Reagent购自Roche;双萤光素酶检测试剂盒购自Promega;RPMI-1640培养基和胎牛血清购自HyClone;低密度脂蛋白(low-density lipoprotein,LDL)本实验室制备;TNF-α购自PeproTech;LXR激动剂(T0901317)购自Sigma;Trizol RNA抽提试剂购自TaKaRa;逆转录试剂盒以及Power SYBR Green PCR Master Mix购自Applide Biosystems;细胞蛋白提取试剂盒;PCR引物采用TaqMan Primer Express软件设计,由北京华大基因公司合成;β-actin、LXRα 羊多抗 IgG、ABCA1鼠多抗IgG、ABCG1兔多抗IgG及相应辣根过氧化物酶标记Ⅱ抗购自Santa Cruz。
3 主要方法
3.1 细胞培养 使用含有10%胎牛血清的RPMI-1640培养基在37℃、5%CO2培养箱中静止培养HepG2细胞,隔天换液1次,3~4 d可传代。
3.2 LXRα基因启动子萤火虫萤光素酶报告重组质粒的构建 从Promoter Database中获得LXRα启动子的DNA序列,以人HepG2细胞基因组DNA为模板,PCR扩增启动子片段。引物序列为:正向引物5’-ATTGGTACCTCCATCCTGGGCTGCCACC-3’,反向引物5’-GACCTCGAGTCATGAGTTATTCTGGGACCC-3’(下划线部分分别表示Kpn I和Xho I酶切位点),反应产物约为1 kb与萤火虫萤光素酶报告质粒pGL3-Basic分别经Kpn I和Xho I双酶切,在T4连接酶的作用下于16℃过夜,再以低温CaCl2法将连接产物转化大肠杆菌感受态筛选阳性克隆,提取质粒,并进行测序(由重庆医科大学感染性疾病分子生物学教育部重点实验室完成),命名为pGL3-Basic-LXRα-P。
3.3 转染HepG2细胞与萤光素酶活性检测 将HepG2细胞种于24孔板,等细胞汇合度达到80% ~90%时,进行转染:50 μL MEM 培养基加入 0.5μg DNA,短暂轻柔漩涡,加入 1.5 μL X-tremeGENE HP DNA Transfection Reagent,短暂轻柔漩涡,室温孵育15~30 min(15至25℃),将转染复合物逐滴加入到细胞中。转染分组1:(1)pGL3-Basic和pRL-TK;(2)pGL3-Basic-LXRα-P和pRL-TK,每组转染3孔,48 h后测定启动子活性。转染分组2:pGL3-Basic-LXRα-P和pRL-TK共转染24 h后均进行无血清培养24 h后将细胞分为以下5组:(1)对照组(control):RPMI-1640+0.2%BSA;(2)LXR激动剂组(T0901317):RPMI-1640+0.2%BSA+10 μmol/L T0901317;(3)TNF-α 组:RPMI-1640+0.2%BSA+20 μg/L TNF-α;(4)高脂组(LDL):RPMI-1640+0.2%BSA+100 mg/L LDL;(5)联合干预组(TNF-α+LDL):RPMI-1640+0.2%BSA+20 μg/L TNF-α +100 mg/L LDL,观察炎症因子对启动子活性的影响。细胞继续培养24 h后弃去培养基,PBS洗 2~3次,吸净残留的PBS,使用双萤光素酶报告基因检测试剂盒进行细胞裂解及萤光素酶活性检测实验:每孔中加入100 μL 1×PLB,室温在摇床放置15 min,将细胞裂解液吸入EP管,10 000 r/min离心5 min,收集上清液备用。在检测仪器中放入96孔板设置检测程序并选择检测区域,每孔加入 100 μL Luciferase Assay BufferⅡ测定本底值后加入20 μL细胞裂解液,迅速混匀后进行检测,记录检测值表示萤火虫萤光素酶活性。再加入100 μL Stop&Glo Buffer,迅速混匀后检测得到海肾萤光素酶活性,萤火虫萤光素酶(firefly lucifer-ase,FL)活性与海肾萤光素酶(Renilla luciferase,RL)活性的比值(FL/RL)来表示相对萤光素酶活性。
3.4 未转染HepG2细胞分组 HepG2细胞长至对数生长期,无血清培养24 h后将细胞分为以下4组:(1)对照组(control):RPMI-1640+0.2%BSA;(2)TNF-α 组:RPMI-1640+0.2%BSA+20 μg/L TNF-α;(3)高脂组(LDL):RPMI-1640+0.2%BSA+100 mg/L LDL;(4)联合干预组(TNF-α+LDL):RPMI-1640+0.2%BSA+20 μg/L TNF-α +100 mg/L LDL。细胞继续培养24 h后进行以下各项实验分析。
3.5 实时定量PCR检测 LXRα、ABCA1和 ABCG1 mRNA表达水平 将HepG2细胞平均接种于6孔板中,每组设6复孔。经实验干预后收集细胞,用Trizol法提取细胞总RNA,用分光光度计法测定 A260/A280然后对其进行标化。用逆转录试剂盒将标化的RNA逆转录为cDNA:每20 μL逆转录反应体系中加1 μg总RNA为模板,反应条件为37℃ 15 min,85℃5 s。取2 μL cDNA进行实时定量PCR,以β-肌动蛋白(β-actin)作为内参照,反应体系25 μL。扩增条件为:50 ℃ 2 min,95 ℃ 5 min,95 ℃ 20 s,55 ℃ 20 s,72℃ 30 s,共40个循环。用ΔΔCt来计算基因的表达水平,计算公式如下:ΔCt=目的基因Ct值 -βactin基因 Ct值,ΔΔCt=实验组 ΔCt-对照组 ΔCt,实验组相对于对照组基因表达水平的倍数 =2-ΔΔCt。PCR引物序列见表1。

表1 实时定量PCR引物序列Table 1.The primers for real-time PCR
3.6 Western blotting检测 LXRα、ABCA1 和 ABCG1蛋白表达 将细胞接种于10 cm培养皿,经实验干预后收集细胞。按照全蛋白提取试剂盒说明书提取细胞总蛋白,用BCA法测定蛋白含量并进行标化,蛋白上样量约为80~100 μg,β-actin作为内参照蛋白。样品加变性缓冲液在沸水中煮5 min,SDSPAGE凝胶电泳后转至PVDF膜。5%脱脂牛奶室温封闭1 h,Ⅰ抗 LXRα(1∶300),ABCA1(1∶400),ABCG1(1∶200),β-actin(1∶4 000),4 ℃孵育过夜,TBST洗3次,每次 10 min。Ⅱ抗 LXRα(1∶10 000),ABCA1(1∶5 000),ABCG1(1∶7 500),β-actin(1∶5 000)。37℃孵育1 h,TBST漂洗3次,每次10 min。ECL进行显色。
3.7 细胞胆固醇外流的测定 将细胞接种于24孔板,每组设6复孔。每孔加入 30 mg/L胆固醇、1 mg/L 25-(OH)胆固醇和 3.7 ×104Bq/well[3H ]-胆固醇。用无血清培养基培养48 h后用 PBS洗涤2次,加入处理因素。培养24 h后PBS洗涤3次,在无血清培养基中加入15 mg/L载脂蛋白A-I(apolipoprotein A-I,apoA-I),继续培养 6 h,收集上清,13 000 r/min离心10 min除去细胞碎片。每孔细胞加入0.4 mL 0.1 mo l/L NaOH,4℃溶解过夜。采用液体闪烁计数仪分别测量上清液及细胞中[3H]含量,胆固醇外流量 =培养液中[3H]/(培养液中[3H]+细胞中[3H])。
3.8 油红O染色观察细胞脂质积聚情况 细胞接种于24孔板中,每组设6复孔。经实验干预后弃去培养基,用PBS洗涤3次;加入5%甲醛盐固定30 min后用双蒸水洗涤2次,1,2-丙二醇固定2 min后弃去,室温下用油红O工作液染色30 min,双蒸水洗涤3次,苏木素复染2 min,自来水洗2次,甘油明胶封片后显微镜下观察并照相。
3.9 化学酶促-比色法定量检测细胞内胆固醇含量 将细胞接种于6孔板中,每组设6复孔,经实验干预后收集细胞,离心弃上清后加入1 mL氯仿,甲醇混合液(2∶1),用超声破细胞仪破碎细胞。收集上清液真空干燥机干燥后检测总胆固醇(total cholesterol,TC)、游离胆固醇(free cholesterol,FC)和胆固醇酯(cholesterol ester,CE)。沉淀加入 1 mol/L NaOH室温孵育过夜,用Lowry法检测蛋白含量,分别计算胆固醇与细胞内总蛋白比值,分析相对含量。
4 统计学处理
用SPSS 17.0统计软件,用单因素方差分析比较不同处理组各项检测指标的差异。数据用均数±标准差(mean±SD)表示。以P<0.05为差异有统计学意义。
结 果
1 报告基因重组质粒的构建
构建的 LXRα启动子的荧光素酶报告质粒(pGL3-Basic-LXRα-P)用Kpn I和Xho I进行双酶切和测序的方法鉴定,结果如图1所示,经Kpn I和Xho I双酶切,可获得大小约1 kb的启动子片段和4.8 kb的pGL3-Basic载体片段。将上述质粒样品进行测序,用DNAssist软件与启动子标准序列进行比对,序列准确,无突变。启动子克隆构建成功,命名为pGL3-Basic-LXRα-P。
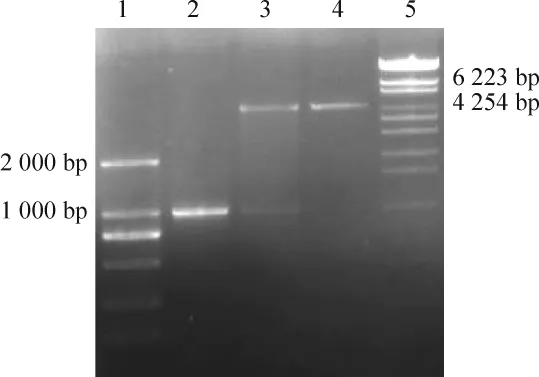
Figure 1.Double digestion of pGL3-Basic-LXRα-P plasmid by Kpn I and Xho I.1:DNA marker(DL2000);2:LXRα-P;3:pGL3-Basic-LXRα-P;4:pGL3-Basic;5:DNA marker(λ-EcoT14 I digest).图1 pGL3-Basic-LXRα-P质粒的Kpn I和Xho I双酶切鉴定
2 萤光素酶活性检测
2.1 pGL3-Basic-LXRα-P启动子活性鉴定 24孔板HepG2细胞按照上述转染分组1进行转染,48 h后检测双萤光素酶的表达。以RL表达载体pRL-TK为内参照,以FL/RL来表示相对萤光素酶活性。结果见图2A,pGL3-Basic-LXRα-P有明显活性。
2.2 炎症因子TNF-α对LXRα启动子活性的影响
确定LXRα启动子具有活性后,进一步检测炎症因子TNF-α对启动子活性的影响,24孔板HepG2细胞按照上述转染分组2进行转染。如图2B结果显示,与对照组相比,激动剂组和高脂组LXRα启动子活性明显升高,而TNF-α组LXRα启动子活性受到明显的抑制,即使有高脂存在,炎症因子TNF-α仍能抑制启动子活性。
3 炎症因子 TNF-α对 LXRα、ABCA1和 ABCG1 mRNA表达水平的影响
与对照组相比,TNF-α组 LXRα、ABCA1和 ABCG1 mRNA表达明显下调,高脂组mRNA表达均上调,而联合干预组中各组mRNA表达明显低于高脂组,见表2。
4 炎症因子 TNF-α对 LXRα、ABCA1和 ABCG1蛋白表达水平的影响
与对照组相比,TNF-α组各蛋白表达水平有所下降,而高脂组则明显增加。但与高脂组相比,联合干预组各蛋白表达水平明显下调,该结果与mRNA检测结果相符,见图3。
5 炎症因子TNF-α对胆固醇外流的影响
与对照组相比,TNF-α组的胆固醇外流量明显下降,而高脂组胆固醇外流量上调,联合干预组与高脂组相比,胆固醇外流量明显下调,见图4。

Figure 2.The luciferase activity of pGL3-Basic-LXRα-P.HepG2 cells were transfected pGL3-LXRα-P and pRL-TK,treated with serum-free medium(control),10 μmol/L T0901317,20 mg/L TNF-α,100 mg/L LDL or 20 mg/L TNF-α plus 100 mg/L LDL for 24 h.A:detection of LXRα promoter activity;B:effects of TNF-α on LXRα promoter activity.Mean±SD.n=6.*P <0.05 vs control;#P <0.05 vs LDL.图2 各组启动子活性的检测

表2 TNF-α对各组LXRα、ABCA1和ABCG1 mRNA表达的影响Table 2.Effects of TNF-α on mRNA expression of LXRα,ABCA1 and ABCG1 in HepG2 cells(folds of control.Mean±SD.n=6)
*P <0.05 vs control;#P <0.05 vs LDL.

Figure 3.Affects of TNF-α on protein expression of LXRα,ABCA1 and ABCG1 in HepG2 cells.Mean ± SD.n=3.*P <0.05 vs control;#P <0.05 vs LDL.图3 TNF-α对各组LXRα、ABCA1和ABCG1蛋白表达的影响
6 HepG2细胞内脂质积聚情况
对照组细胞内有少量红染颗粒,分别给予TNF-α或者高脂处理时,细胞内红染颗粒有增加,而联合干预组与其它3组相比,细胞内有更多红染颗粒,说明炎症因子TNF-α促进了胆固醇在细胞内的异常积聚,见图5。

Figure 4. TNF-α reduced intracellular cholesterol efflux of HepG2 cells loaded with cholesterol and 25-hydroxycholesterol.HepG2 cells were preloaded with cholesterol for 48 h.The cholesterol-loaded cells were incubated in serum-free medium(control),100 mg/L LDL,20 mg/L TNF-α or 20 mg/L TNF-α plus 100 mg/L LDL for 24 h.Mean ±SD.n=6.*P <0.05 vs control;#P <0.05 vs LDL.图4 各组HepG2细胞胆固醇外流量的测定
7 炎症因子TNF-α对HepG2细胞内胆固醇水平的影响
炎症因子组和高脂组中细胞内胆固醇的含量与对照组相比均有一定的增高,而联合干预组与其它3组相比胆固醇的含量明显增高,见表3。

Figure 5.Observation of lipid accumulation in HepG2 cells after treatment with TNF-α or LDL(×400).HepG2 cells were incubated for 24 h with serum-free medium(A),20 mg/L TNF-α (B),100 mg/L LDL(C)or 20 mg/L TNF-α plus 100 mg/L LDL(D).The cells were examined for lipid inclusion by oil red O staining.The results are typical images in four separate experiments.图5 各组HepG2细胞油红O染色的结果

表3 各组HepG2细胞中胆固醇含量的测定Table 3.Effects of TNF-α on intracellular cholesterol changes in HepG2 cells[mg/(g protein).Mean ±SD.n=6]
讨 论
目前已有大量关于甘油三酯和游离脂肪酸调节异常导致NAFLD的发病机制的研究﹝7-8﹞,相比之下胆固醇在NAFLD发病过程中的作用则有所忽视。尽管在肝脏异常沉积的脂质中绝大部分为甘油三酯,而胆固醇酯的相对含量不到10%,但是如果胆固醇在肝脏中异常沉积,就会启动肝细胞内的氧化应激、内质网应激以及细胞凋亡,从而促使NAFLD从单纯的脂肪肝向脂肪性肝炎以及肝坏死发展[9]。有临床研究表明脂肪性肝炎的患者肝脏组织中游离胆固醇的含量是显著升高的[10]。另外也有动物模型证明,高胆固醇饮食能显著促进不伴随胰岛素抵抗以及肥胖的NAFLD的发生[11]。
慢性炎症在代谢性疾病的发生、发展及预后中起了关键的作用。越来越多的研究认为,肥胖、胰岛素抵抗或高胰岛素血症、2型糖尿病、脂代谢紊乱、高血压、动脉粥样硬化等代谢综合征与炎症反应有着密切关系。大量的动物实验及临床研究证实:慢性炎症或炎症细胞因子在促进肝细胞脂肪变性,加重肝细胞脂质代谢紊乱中扮演了重要的角色[12]。
本课题组在体内外实验已证实炎症可以干扰肝脏胆固醇的外源性摄取及内源性合成从而促进NAFLD[13],而其对胆固醇外流途径的影响尚不清楚。在肝脏组织中,胆固醇由细胞内排出至细胞外主要包括:游离胆固醇经ABC膜转运蛋白转运至细胞膜外层,并与apoA-I相结合进而形成高密度脂蛋白[14];胆固醇通过经典合成途径和替代合成途径合成胆汁酸排出体外;少量转化成类固醇激素。与胆固醇外流密切相关的ATP结合盒转运蛋白家族中的ABCA1和ABCG1是LXRα的下游蛋白。肝脏中,游离胆固醇的流出主要是由ABCA1和ABCG1调节的[15]。ABCA1和ABCGl作为两种跨膜蛋白以ATP为能源,促进细胞内游离胆固醇流出从而参与胆固醇逆向转运的初始阶段,并形成高密度脂蛋白(highdensity lipoprotein,HDL)[16]。ABCA1 细胞内的胆固醇转运出来与apoA-I结合转变成盘状的新生HDL,然后在血浆中成熟为球形的HDL。ABCG1以HDL为胆固醇接受体,对胆固醇平衡的调节也起到了重要作用[17]。
基因的表达受许多因素的调节,其中启动子就是众多因素中起主要作用的一员。我们推测炎症因子有可能通过调节LXRα的启动子活性,来调节它的表达。在本研究中我们设计了LXRα启动子的萤火虫萤光素酶报告质粒,检测启动子的活性后,将其转染HepG2细胞后进行炎症处理,通过双荧光素酶报告系统来检测炎症因子对LXRα启动子活性的影响,发现炎症因子对LXRα启动子活性有明显抑制作用。进而我们观察了LXRα及其下游蛋白ABCA1和ABCG1的表达情况。给予高脂组处理时,与对照组相比,LXRα、ABCA1和ABCG1 mRNA和蛋白的表达水平上调,因此肝细胞可通过增加胆固醇外流来减轻脂质在细胞内的过度积聚。而炎症因子组与对照组相比,LXRα、ABCA1和ABCG1 mRNA和蛋白的表达下调,胆固醇的外流也受到抑制,油红O染色以及细胞内胆固醇含量测定结果显示在炎症状态下,无论细胞是否给予高脂处理,胆固醇在细胞内的积聚均明显增加。
通过上述实验,我们在体外HepG2模型上证实了炎症因子能通过抑制LXRα启动子的转录活性,从而下调LXRα及其下游蛋白ABCA1和ABCG1的表达,导致细胞内胆固醇外流减少,造成脂质的异常沉积。该研究为阐明炎症可能作为独立致病因子在脂质介导的肝损害中的作用机制提供了理论依据,为临床治疗非酒精性脂肪性肝病及新药开发提供了新的线索。
[1] Ruan XZ,Varghese Z,Powis SH,et al.Dysregulation of LDL receptor under the influence of inflammatory cytokines:a new pathway for foam cell formation[J].Kidney Int,2001,60(5):1716-1725.
[2] Ruan XZ,Moorhead JF,Jian L,et al.Mechanisms of dysregulation of low-density lipoprotein receptor expression in vascular smooth muscle cells by inflammatory cytokines[J].Arterioscler Thromb Vasc Biol,2006,26(5):1150-1155.
[3] Ruan XZ,Moorhead JF,Fernando R,et al.PPAR agonists protect mesangial cells from interleukin 1β-induced Intracellular lipid accumulation by activating the ABCA1 cholesterol efflux pathway[J].Am Soc Nephrol,2003,14(3):593-600.
[4] Chen Y,Ruan XZ,Li Q,et al.Inflammatory cytokines disrupt LDL receptor feedback regulation and cause statin resistance:a comparative study in human hepatic cells and mesangial cells[J].Am J Physiol Renal Physiol,2007,293(3):F680-F687.
[5] 代小艳,唐朝克.肝X受体在体内胆固醇平衡中的作用[J].中国病理生理杂志,2006,22(9):1854-1857.
[6] Ogawa D,Stone JF,Takata Y,et al.Liver X receptor agonist inhibit cytokine-induced osteopontin expression in macrophages through interference with activator protein-1 signaling pathways[J].Cire Res,2005,96(7):e59-e67.
[7] Hardwick JP,Osei-Hyiaman D,Wiland H,et al.PPAR/RXR regulation of fatty acid metabolism and fatty acid ωhydroxylase(CYP4)isozymes:implications for prevention of lipotoxicity in fatty liver disease[J].PPAR Res,2009,2009:952734.
[8] Fabbrini E,DeHaseth D,Deivanayagam S,et al.Alterations in fatty acid kinetics in obese adolescents with increased intrahepatic triglyceride content[J].Obesity(Silver Spring),2009,17(1):25-29.
[9] Zhang W,Kudo H,Kawai K,et al.Tumor necrosis factor-α accelerates apoptosis of steatotic hepatocytes from a murine model of non-alcoholic fatty liver disease[J].Biochem Biophys Res Commun,2010,391(4):1731-1736.
[10] Caballero F,Fernández A,De Lacy AM,et al.Enhanced free cholesterol,SREBP-2 and StAR expression in human NASH[J].J Hepatol,2009,50(4):789-796.
[11]Kainuma M,Fujimoto M,Sekiya N,et al.Cholesterol-fed rabbit as a unique model of nonalcoholic,nonobese,noninsulin-resistant fatty liver disease with characteristic fibrosis[J].J Gastroenterol,2006,41(10):971-980.
[12] Lanza-Jacoby S,Phetteplace H,Sedkova N,et al.Sequential alterations in tissue lipoprotein lipase,triglyceride secretion rates,and serum tumor necrosis factor alpha during Escherichia coli bacteremic sepsis in relation to the development of hypertriglyceridemia[J].Shock,1998,9(1):46-51.
[13] Zhao L,Chen Y,Tang R,et al.Inflammatory stress exacerbates hepatic cholesterol accumulation via increasing cholesterol uptake and de novo synthesis[J].J Gastroenterol Hepatol,2011,26(5):875-883.
[14]吕 湛,陈远贞.过氧化物酶体增殖体活化受体γ、肝脏X受体α、视黄酸X受体 α活化对 THP-1细胞结合ATP结合盒转运蛋白和CD36mRNA表达的影响[J].中国病理生理杂志,2004,20(8):1381-1384.
[15]Gelissen IC,Harris M,Rye KA,et al.ABCA1 and ABCG1 synergize to mediate cholesterol export to apoA-I[J].Arterioscler Thromb Vasc Biol,2006,26(3):534-540.
[16] Maxtiled FR,Wüstner D.Intracellular cholesterol transport[J].J Clin Invest,2002,110(7):891-898.
[17] Sabol SL,Brewer HB Jr,Santamarina-Foio S.The human ABCG1 gene:identification of LXR response elements that modulate expression in macrophages and liver[J].J Lipid Res,2005,46(10):2151-2167.
