沉默HIF-1α基因表达对大鼠肝癌细胞增殖的影响*
2013-11-07吴裕丹倪嘉延陈耀庭孙宏亮许林锋
吴裕丹, 倪嘉延, 陈耀庭, 孙宏亮, 许林锋△
原发性肝癌是临床上最常见恶性肿瘤之一,世界范围内每年约有60万新发病例,居恶性肿瘤发病率的第5位[1-2]。肝癌为血供丰富的实体恶性肿瘤,由于肿瘤快速生长所需的大量血液供应以及养分供给导致肝癌组织细胞内长期处于相对缺氧的微环境。缺氧诱导因子(hypoxia inducible factors,HIF)家族是缺氧适应反应的中心环节,HIF-1α是HIF最重要的功能性亚基。RNA干扰能特异性地封闭一个或多个基因,而不影响正常等位基因的功能,具有较高的选择性和特异性,减少非特异作用引起的副作用,是极富有前途的治疗手段。本研究通过转染特异性的HIF-1α siRNA于缺氧培养条件下的大鼠CBRH-7919肝癌细胞,通过检测HIF-1α、血管内皮生长因子(vascular endothelial growth factor,VEGF)以及增殖相关因子p21、cyclin D1的表达变化,探讨沉默HIF-1α基因表达对肝癌细胞增殖的影响,为临床抗肿瘤的基因治疗提供相关理论依据。
材料和方法
1 材料
大鼠CBRH-7919肝癌细胞株由中山大学北校区动物实验中心提供。RPMI-1640培养基购自Gibico;脂质体 LipofectamineTM2000购自 Invitrogen;NC膜购自Pall;HIF-1α、p21及cyclin D1抗体购自Santa Cruz;VEGF抗体购自CST;β-actin抗体购自博士德公司;TRIzol试剂购自TaKaRa;real-time RT-PCR试剂盒购自 TaKaRa;HIF-1α、VEGF及 β-actin引物用Primer 3软件设计,由Invitrogen公司合成。
2 方法
2.1 细胞培养 CBRH-7919细胞用含10%胎牛血清的RPMI-1640培养液,在二氧化碳培养箱内(37℃、5%CO2、饱和湿度)连续培养、传代。将生长状态良好的肝癌细胞消化下来以(8~10)×104/L密度接种于6孔板于二氧化碳培养箱内(37℃、5%CO2、饱和湿度)中培养24 h后,加入150 μmol/L CoCl2溶液,用于模拟肿瘤内部厌氧环境。
2.2 厌氧模型的建立 CBRH-7919细胞在二氧化碳培养箱内(37℃、5%CO2、饱和湿度)用含10%胎牛血清的RPMI-1640培养液中连续传代,将生长状态良好的肝癌细胞消化后,以1×105/L密度接种于6孔板培养24 h后,加入不同浓度CoCl2溶液,按CoCl2终浓度分为 5 组:0 μmol/L(常氧组)、100 μmol/L、150 μmol/L、200 μmol/L 和 300 μmol/L,处理时间分别为12和24 h。
2.3 HIF-1α siRNA载体的构建 选择GenBank中大鼠 HIF-1α基因编码区序列(coding sequence,CDS)作为分析序列,采用RNAdraw分析软件对HIF-1α序列的二级结构进行预测,然后按照Elbashir等推荐的siRNA设计原则进行设计。利用在线设计软件(www.ambion.com/techlib/misc/siRNA_finder.html),预选出3条潜在靶核苷酸序列(靶mRNA):(1)P1:5’-AGUGACUGAUUCUGGCAGCtt-3’,P2:5’-GCUGCCAGAAUCAGUCACUtt-3’;(2)P1:5 ’-GGAUGACUUUAAGCAAGAAtt-3’,P2:5’-UUCUUGCUUAAAGUCAUCCtt-3’;(3)P1:5’-GAAACUCUUCCAAGCAAUUtt-3’,P2:5’-AAUUGCUUGGAAGAGUUUCtt-3’。参照siRNA的基本设计原理选择靶序列,针对目的基因的序列设计siRNA表达载体互补的核苷酸链。将siRNA溶液与LipofectamineTM2000试剂混合,形成siRNA/LipofectamineTM2000载体复合物。
2.4 细胞转染 6孔板种植细胞(8~10)×104/L,在含10%胎牛血清的RPMI-1640培养液中培养24 h,细胞汇合度达到30% ~50%。将稀释好的HIF-1α siRNA和 LipofectamineTM2000试剂混合,形成HIF-1α siRNA/LipofectamineTM2000复合物。将HIF-1α siRNA转染载体加到含有细胞和培养基的培养板的孔中融合,然后放入37℃、5%CO2培养箱培养。6 h后换含10%胎牛血清的RPMI-1640培养液,20 h恢复生长后,荧光显微镜下观察细胞绿色荧光蛋白的表达以检测转染效率。实验分为空白对照组(仅加入LipofectamineTM2000试剂)和转染组(分别将HIF-1α siRNA 序列1、2、3转染入细胞)。
2.5 Real-time RT-PCR检测 mRNA表达水平
TRIzol法提取6孔板内各组细胞的总RNA并定量;各样本取2 ng~2 μg总RNA,按TaKaRa公司试剂盒说明进行逆转录合成cDNA。应用实时荧光定量RT-PCR检测,β-actin作为内参照。PCR引物:HIF-1α 正义链 5'-ACTGCACAGGCCACATTCAT-3',反义链 5'-CGAGGCTGTGTCGACTGAGA-3';β-actin正义链5'-CCTAGGCACCAGGGTGTGAT-3',反义链5'-TTGGTGACAATGCCGTGTTC-3'。反应体系为 20 μL,反应条件为95℃ 3 min预变性,95℃ 10 s,55℃ 30 s,39个循环,并在每个循环延伸末端点收集荧光信号,绘制扩增曲线。
2.6 Western blotting检测 冷PBS洗涤细胞2次,加入全蛋白裂解液后冰上裂解10 min收获蛋白。将抽提蛋白用BCA法定量后,于100 V泳道进行SDSPAGE;电泳结束后,以30 mA、120 min将蛋白转移至NC膜;封闭液(5%BSA/TBST)封闭60 min,加入Ⅰ抗(1∶3 000)4℃过夜,Ⅱ抗(1∶6 000)室温下杂交120 min,TBST洗膜3次后用ECL试剂盒进行发光反应,压片、显影、定影,观察蛋白印迹并进行图像分析。
2.7 MTT检测肝癌细胞增殖 选择对数生长期细胞,用不含EDTA的胰蛋白酶收集处理后的细胞,800×g离心10 min,沉淀采用300 μL PBS重悬,逐滴加入700 μL预冷的无水乙醇中,乙醇终浓度为70%,4℃避光固定过夜。800×g离心10 min,去上清。PBS洗2次。重悬细胞于500 μL含1×105U/L的RNase A的PBS缓冲液中,避光,37℃孵育30 min。加2 g/L PI至终浓度50 mg/L,避光孵育30 min。流式细胞仪激发波长488 nm,发射波长525 nm检测。
2.8 BrdU掺入实验检测细胞增殖 细胞在转染后24 h,取对数生长的细胞,用0.25%胰酶消化细胞,以完全培养基(含10%FBS的RPMI-1640)重悬细胞沉淀,将细胞种于无菌盖玻片上,孵箱培养细胞,待其贴壁。用无血清培养基饥饿细胞48 h后,更换含血清培养基,孵育4 h。取出盖玻片,用10 μmol/L BRDU标记细胞1 h。倒去培养基,PBS洗干净。吸去固定液,PBS洗2~3次各5 min。滴加用0.1%柠檬酸三钠缓冲液配制成的0.1%的曲拉通溶液,室温下破膜5~10 min,以增加细胞的通透性。倒掉曲拉通溶液,PBS洗2~3次各5 min,滴加3%过氧化氢溶液阻断内源性过氧化物酶,室温10 min。倒掉过氧化氢溶液,PBS洗2~3次各5 min,滴加正常山羊血清封闭液阻断内源性生物素,室温下10~30 min。甩去血清,每张切片加1滴或50 μL的Ⅰ抗,37℃孵育60 min或4℃过夜。PBS洗2~3次各5 min,甩去PBS液,每张切片加50 μLⅡ抗,室温下孵育30~60 min。PBS洗细胞5 min×3次,Olympus BX51荧光显微镜拍照。
3 统计学处理
数据应用SPSS 17.0版软件分析。计量资料用均数±标准差 (mean±SD)表示,两组间采用t检验,多个不同处理组组内、组间计量资料的比较应用单因素方差分析。取双侧为检验标准,以P<0.05为差异有统计学意义。
结 果
1 不同浓度CoCl2条件下肝癌细胞的活性
实验组随着CoCl2浓度的逐渐增高,CBRH-7919细胞活性趋于减小,其中CoCl2浓度为800 μmol/L时,细胞的活性最小;CoCl2浓度为100~200 μmol/L时,细胞的活性相对较高,见图1。
2 不同浓度CoCl2对HIF-1α和VEGF表达的影响
随着 CoCl2浓度升高,HIF-1α和 VEGF mRNA相对表达量逐渐增高,浓度为200 μmol/L时达到峰值,各组与常氧处理组相比,均有显著差异(P<0.05)。300 μmol/L 组,HIF-1α 和 VEGF mRNA 表达呈现下降趋势。相同浓度组随着处理的时间延长至24 h,细胞的HIF-1α mRNA相对表达量进一步增加,表达仍以200 μmol/L浓度组为最高值,随后表达反而开始降低,见图2。与此同时,细胞的HIF-1α和VEGF蛋白表达水平也呈现类似的表达规律(P<0.05),见图 3。

Figure 1.Effects of CoCl2on the viability of CBRH-7919 cells detected by MTT assay.Mean ± SD.n=3.图1 MTT检测缺氧条件下CBRH-7919细胞的活性

Figure 2.Effects of CoCl2on the mRNA expression of HIF-1α(A)and VEGF(B)in CBRH-7919 cells.Mean ±SD.n=3.*P <0.05 vs 0 μmol/L.图2 不同浓度CoCl2对CBRH-7919细胞HIF-1α和VEGFmRNA表达的影响
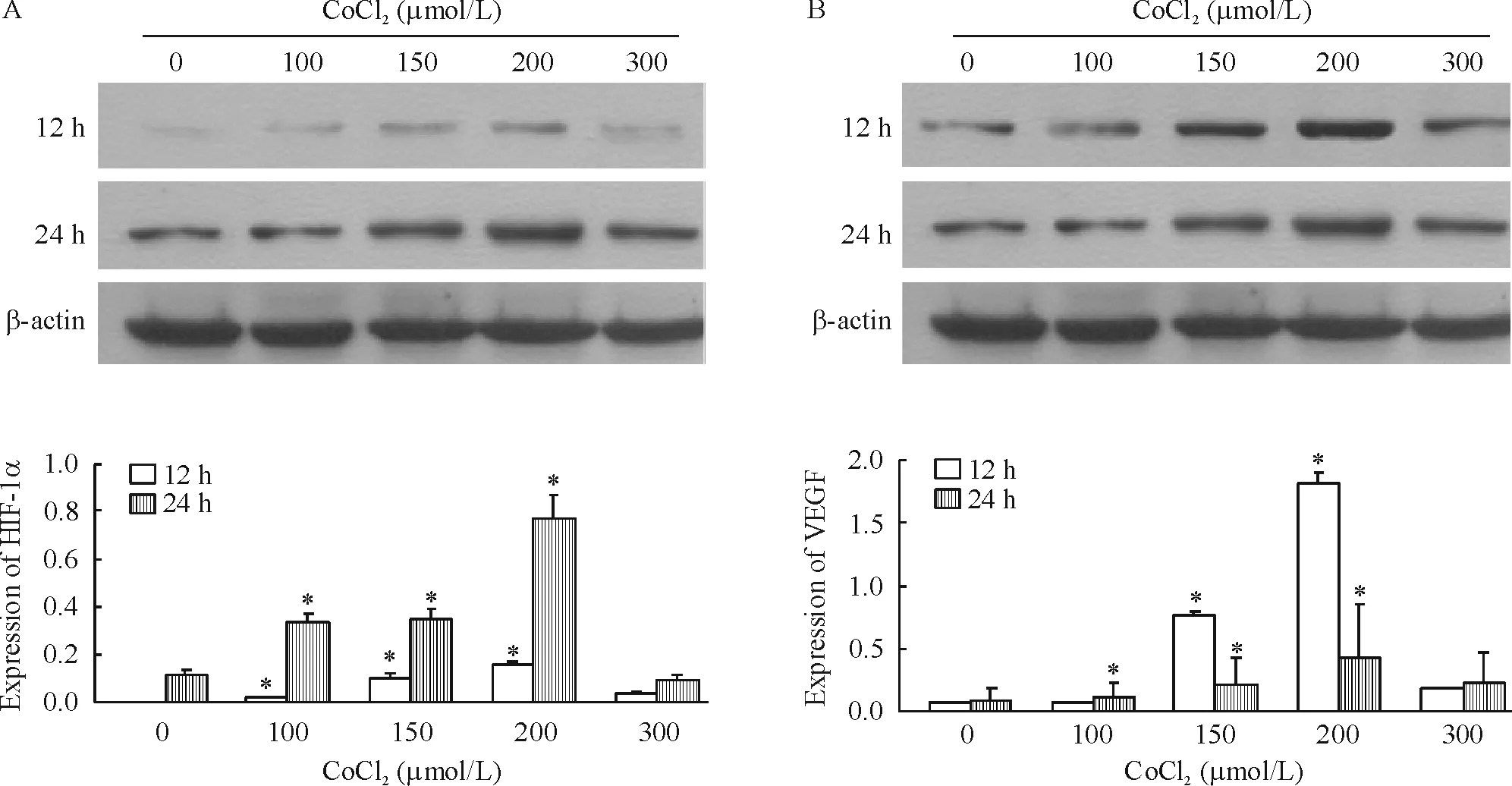
Figure 3.The protein expression of HIF-1α (A)and VEGF(B)under different concentrations(0 ~300 μmol/L)of CoCl2.Mean ±SD.n=3.*P <0.05 vs 0 μmol/L.图3 不同浓度CoCl2(0~300 μmol/L)处理后HIF-1α和VEGF蛋白表达的变化
3 HIF-1α siRNA对HIF-1α和VEGF表达的影响
未转染HIF-1α siRNA表达载体的对照组HIF-1α和VEGF mRNA表达没有显著变化,转染3组不同的 HIF-1α siRNA表达载体后,HIF-1α和 VEGF mRNA表达明显减少(P<0.05),见图4。同步检测结果显示,各转染组HIF-1α和VEGF的蛋白表达亦受到明显抑制(P<0.05),转染组与对照组HIF-1α和VEGF蛋白表达相比较明显减少,差异均有统计学意义(P<0.05),见图5。
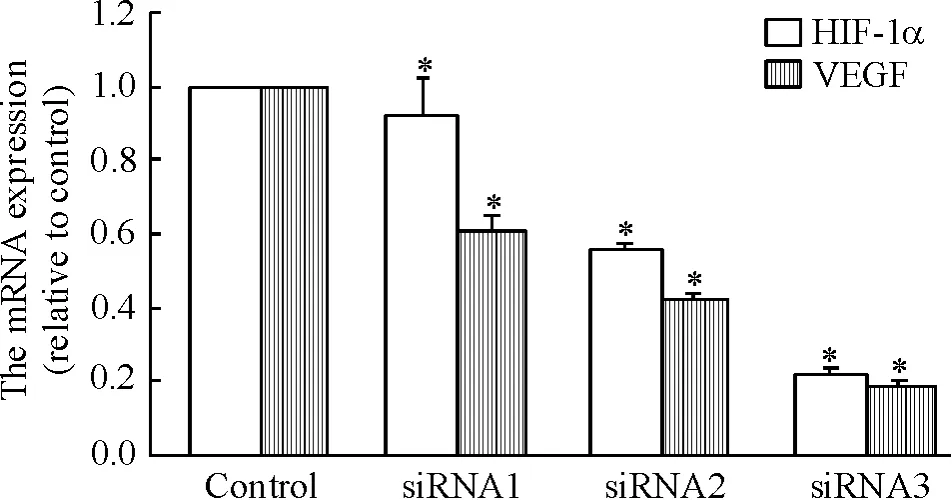
Figure 4.Changes of mRNA expression of HIF-1α and VEGF 24 h after siRNA transfection.Mean ± SD.n=3.*P <0.05 vs control.图4 不同siRNA表达载体转染细胞24 h后 HIF-1α和VEGF mRNA表达的变化

Figure 5.The protein expression of HIF-1α and VEGF 24 h after siRNA transfection.Mean±SD.n=3.*P <0.05 vs control.图5 不同的siRNA表达载体转染细胞24 h后 HIF-1α和VEGF蛋白表达的变化
4 HIF-1α siRNA 对 HIF-1α、VEGF、p21 及 cyclin D1表达的影响
HIF-1α siRNA表达载体转染组 HIF-1α、VEGF及cyclin D1蛋白表达较对照组显著减少,p21蛋白表达较对照组明显增多,转染组与对照组的差异均有统计学意义(P<0.05),见图6。
5 HIF-1α siRNA对肝癌细胞增殖的影响
HIF-1α siRNA转染组的BrdU阳性细胞比例与对照组相比明显减少,差异有统计学意义(P<0.05),见图7。
讨 论
HIF-1是由Semenza等[3]于1992年在缺氧诱导的细胞核抽提物中发现的一种重要的核转录因子。HIF-1由HIF-1α和HIF-1β 2个亚基组成,HIF-1α决定HIF-1的活性。HIF-1α在恶性肿瘤信号转导通路中扮演重要的角色,是肿瘤细胞对缺氧适应反应的中心环节,与肿瘤细胞增殖、肿瘤血管新生密切相关[4-5]。
近期的研究[6]显示HIF-1α可能在VEGF表达的信号转导通路中起着关键的作用,体现于HIF-1α可在多个层次调节VEGF的表达,其主要作用包括增强VEGF的转录活性与增加VEGF mRNA稳定性2个方面。VEGF是最早被发现的可被缺氧环境诱导生成并促进肿瘤新生血管生成的生长因子[7]。HIF-1α上调的VEGF表达增多不仅能够刺激肿瘤新生血管的形成,维持肿瘤的生长,而且发现肿瘤患者体内高水平的VEGF表达,与肿瘤的侵袭、转移密切相关[8-9]。在本研究中,通过转染特异性siRNA沉默HIF-1α,同步检测发现VEGF的表达亦明显受到抑制,与上述相关结论相一致。这些结果提示,通过沉默HIF-1α基因表达,下调VEGF的表达,可对肿瘤
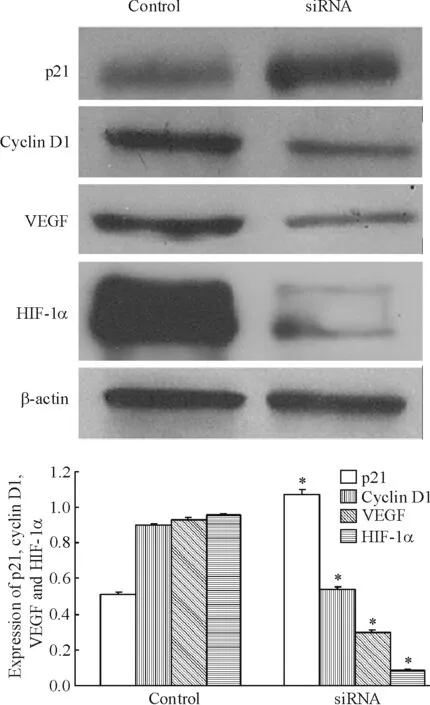
Figure 6.The protein expression of HIF-1α,VEGF,p21 and cyclin D1 24 h after siRNA transfection.Mean ±SD.n=3.*P <0.05 vs control.图6 siRNA 转染24 h后 HIF-1α、VEGF、p21及 cyclin D1蛋白表达的变化
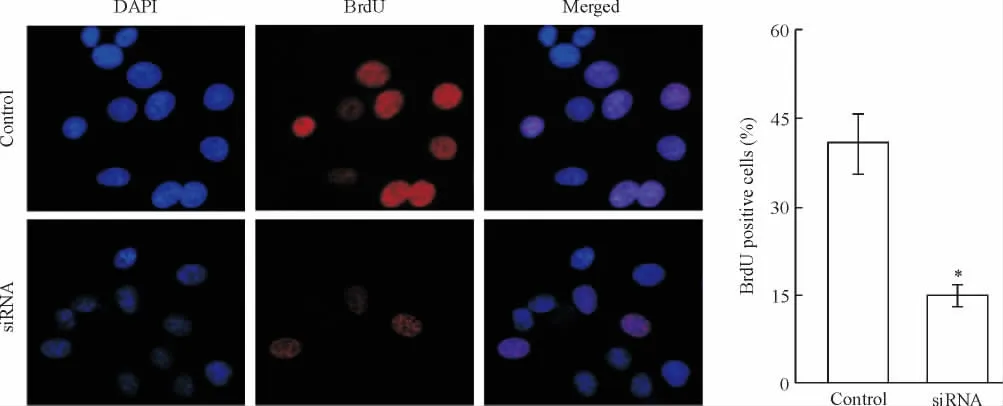
Figure 7.The proliferation of hepatoma cells detected by BrdU incorporation assay.Mean ± SD.n=3.*P <0.05 vs control.图7 BrdU掺入实验检测肝癌细胞的增殖变化
新生血管的生成,以及对肿瘤侵袭、转移的控制起到 关键的作用。
p21蛋白和cyclin D1蛋白是细胞周期调控的关键蛋白。p21基因是一种广谱的CDK抑制基因,位于人染色体6p21.2,是细胞周期进展的负性调节因子。p21基因参与诱导细胞凋亡,其蛋白产物表达的增多与细胞凋亡的增多有关。p21蛋白不仅可抑制CDK的活性,而且还可通过抑制DNA聚合酶间接阻止DNA合成[10-12]。体外实验及体内研究均已证实p21蛋白的表达能抑制肿瘤细胞的生长。Cyclin D1参与G1/S期转换的调控,是细胞周期重要的正性调控因子[13-14]。本研究中,特异性siRNA转染肝癌细胞后,HIF-1α表达明显减少,细胞周期调节蛋白cyclin D1的表达亦明显受到抑制,p21蛋白的表达却明显增多。
为进一步证明siRNA沉默HIF-1α基因表达对肝癌细胞增殖的抑制作用,本研究通过BrdU嵌入试验检测肝癌细胞增殖情况。我们发现,HIF-1α siRNA转染组的BrdU阳性细胞比例明显小于未转染siRNA的对照组,说明转染组肝癌细胞的DNA合成量明显少于对照组肝癌细胞。这提示,siRNA转染组肝癌细胞的增殖活性受到明显抑制。因此,我们认为基因表达沉默HIF-1α可明显抑制肝癌细胞的增殖作用。
综上所述,利用特异性siRNA沉默HIF-1α,一方面通过下调VEGF的表达可抑制肿瘤血管生成,控制肿瘤生长、侵袭及转移;另一方面,通过对p21蛋白和cyclin D1蛋白表达的影响,抑制肿瘤细胞增殖、控制肿瘤进展,为临床上恶性肿瘤的基因治疗提供有效基因靶点及可靠的理论依据。
[1] Ferenci P,Fried M,Labrecque D,et al.Hepatocellular carcinoma(HCC):a global perspective[J].J Clin Gastroenterol,2010,44(4):239-245.
[2] Bruix J,Sherman M.Management of hepatocellular carcinoma[J].Hepatology,2005,42(5):1208-1236.
[3] Semenza GL,Wang GL.A nuclear factor induced by hypoxia viade novo protein synthesis binds to the human erythropoietin gene enhancer at a site required for transcriptional activation [J].Mol Cell Biol,1992,12(12):5447-5454.
[4] 许林锋,倪嘉延,陈耀庭,等.HIF-1α基因沉默对大鼠肝癌CBRH-7919细胞p27和 Ki67表达的影响[J].中国病理生理杂志,2012,28(10):1825-1829.
[5] Miyake K,Nishioka M,Imura S,et al.The novel hypoxic cytotoxin,TX-2098 has antitumor effect in pancreatic cancer;possible mechanism through inhibiting VEGF and hypoxia inducible factor-1α targeted gene expression[J].Exp Cell Res,2012,318(13):1554-1563.
[6] Ahluwalia A,Tarnawski AS.Critical role of hypoxia sensor:HIF-1α in VEGF gene activation.Implications for angiogenesis and tissue injury healing[J].Curr Med Chem,2012,19(1):90-97.
[7] Feng J,Zhang Y,Xing D.Low-power laser irradiation(LPLI)promotes VEGF expression and vascular endothelial cell proliferation through the activation of ERK/Sp1 pathway[J].Cell Signal,2012,24(6):1116-1125.
[8] Liang B,Zheng CS,Feng GS ,et al.Correlation of hypoxia-inducible factor 1α with angiogenesis in liver tumors after transcatheter arterial embolization in animal model[J].Cardiovasc Intervent Radiol,2010,33(4):806-812.
[9] Li S,Yao D,Wang L,et al.Expression characteristics of hypoxia-inducible factor-1α and its clinical values in diagnosis and prognosis of hepatocellular carcinoma[J].Hepat Mon,2011,11(10):821-828.
[10] Cornils H,Kohler RS,Hergovich A,et al.Downstream of human NDR kinases:impacting on c-myc and p21 protein stability to control cell cycle progression[J].Cell Cycle,2011,10(12):1897-1904.
[11]Jung YS,Qian Y,Chen X.Examination of the expanding pathways for the regulation of p21 expression and activity[J].Cell Signal,2010,22(7):1003-1012.
[12]Strzalka W,Ziemienowicz A.Proliferating cell nuclear antigen(PCNA):a key factor in DNA replication and cell cycle regulation [J].Ann Bot,2011,107(7):1127-1140.
[13] Feng Z,Chen J,Wei H,et al.The risk factor of gallbladder cancer:hyperplasia of mucous epithelium caused by gallstones associates with p16/CyclinD1/CDK4 pathway[J].Exp Mol Pathol,2011,91(2):569-577.
[14] Luo M,Liu YJ,Xia LM,et al.Very low density lipoprotein receptor subtype II silencing by RNA interference inhibits cell proliferation in hepatoma cell lines[J].Hepatogastroenterology,2010,57(101):882-890.
