GP73与肝癌关系的研究进展
2013-11-05吴婧徐伟文
吴婧 徐伟文
2.南方医科大学生物技术学院,广东,广州 510515
肝细胞肝癌(hepatocellular carcinoma,HCC)(以下简称肝癌)是世界范围最常见的恶性肿瘤之一。据最新数据统计,全世界每年新发肝癌患者约七十万,居恶性肿瘤的第五位,并且其恶性程度高,预后差,死亡率为世界肿瘤死亡第二位。我国是全球肝癌发病率最高的国家,每年发病患者数占全球约55%。肝癌患者早期无明显症状[1],一旦出现症状就诊,往往已属于中晚期,失去了有效的治疗时机,发病后一般只能生存6个月,被誉为“癌中之王”。因此其早期诊断就显得尤为重要。
甲胎蛋白(alpha-fetoprotein,AFP)是目前全世界应用最广泛的肝癌肿瘤标志物,是诊断HCC的唯一“金标准”。它是胎儿发育早期由肝脏和卵黄囊合成的一种血清糖蛋白,在成人血清中含量甚微。当肝细胞癌变时,低甲基化作用会使AFP的基因表达开放,AFP表现为表达增加。大多数临床研究结果表明,当临界值为20 ng/mL时,AFP诊断HCC的敏感性和特异性分别为41%~65%和80%~94%[2],是早期肝癌诊断特异性较高的肿瘤标志物。
但AFP用于肝癌早期诊断存在2个问题:(1)假阴性,当AFP基因表达调控停止在转录后翻译前时,AFP的表达量会降低,就会出现假阴性,并且当肝癌较小时,AFP的表达量低于检测的最低限,易出现假阴性;而当肝癌过大时,AFP表达延迟或者表达量超过检测的最高限,HCC患者也可呈现AFP阴性。(2)假阳性,AFP不仅在HCC患者中会升高,在慢性肝炎、肝硬化、胃癌、胚胎癌及其他肿瘤患者中都常有一过性AFP增高。这就需要一种敏感性及特异性高的新肿瘤标志物作为HCC的早期诊断。
近年来人们运用各种方法,发现了多种肝癌标记物如包括高尔基体糖蛋白73(golgi protein-73,GP73),磷脂酰基醇蛋白聚糖 -3(glypican-3,GPC3),鳞状细胞癌抗原免疫球蛋白复合物(Squamous cell carcinoma antigen,SCCA),α-L岩藻糖苷酶(alphalfucosidase,AFU)等,其中GP73以良好的敏感性和特异性,被视为最有潜力的HCC标志物[3],为HCC的早期诊断带来了希望。本文将对近年来GP73与肝癌关系的研究进展做综述。
1 GP73的概述
GP73是Kladney等[4]在研究成人巨细胞性肝炎病原学首次发现的存在于高尔基体的一种II型跨膜糖蛋白,相对分子质量为7.3×104kDa。GP73有一段简短的N末端跨膜区域和一个长的C末端外功能区。这个外功能区包含一个螺旋形结构。在稳定的功能状态下,这个螺旋形结构对高尔基体的定位很有必要。但一项新的研究[5]发现,GP73的定位与C末端外功能区关系不大,其定位与N端的TMD功能区关系更为密切。除此之外,C末端还包含一个功能未知的高酸性区域和蛋白质之间相互作用点。
GP73在人体多种组织中均表达,但表达强度不一,最高可相差20倍[6]。在胃、肠、前列腺中表达较强,在肾、脾、肺、子宫及睾丸中表达较弱,在心脏中表达最弱。在正常肝脏组织,GP73主要表达于汇管区的胆管上皮细胞,在肝细胞则无表达或表达很少。但在肝脏疾病中,其在肝细胞及血清中的含量上调,在肝炎中上调水平低,在肝癌中上调水平高。经研究,这些高表达的GP73主要来自于肝细胞,而胆管细胞表达GP73则改变不明显。有研究[7,8]认为,这些组织中升高的GP73可能是通过弗林蛋白水解酶的酶切机制进入血清的。GP73是位于高尔基体顺面膜囊上的一种整合膜蛋白,稳态下如GPP130一样,通过胞内体在高尔基体与细胞表面之间往返循环,但在肝脏疾病中,认为[8~12]可能是因为急性肝细胞损伤触发或慢性肝脏组织的重构和纤维化,使GP73被前蛋白水解酶(PC)弗林水解酶裂解其远端第55个氨基位点,形成分子量比全长GP73小的分泌型GP73(sGP73),在循环过程中,运输至细胞外,进入血清中,从而使HCC及肝硬化患者血清GP73水平上调。不过又有研究[13]发现在前列腺患者的尿液中出现了全长形式的GP73,这就提示可能还存在不依赖弗林蛋白酶酶切的分泌机制。
目前对于GP73在组织上皮细胞中的功能,以及其在各种肝脏疾病中含量上调的原因尚不太清楚。但是其在多种细胞中均表达,推测其具有管家蛋白的功能。研究发现,通过“Knock-down”技术检测HepG2.2.15细胞后,证实当细胞表面的高尔基复合体减少时,GP73的表达受到抑制。因此人们猜测GP73的功能与稳定高尔基复合体结构的完整性有关。而细胞器的改变与癌症发生的关系密切,提示GP73的改变可能是肝癌所引起的肝脏细胞的应激反应。Wright等[14]采用“gene trap”的方法发现将大鼠GP73基因的C末端缩短,所培养繁殖的大鼠均有不同程度的肾脏和肝脏疾病,证实了GP73对于维持肝肾的正常功能具有重要意义。
2 GP73作为肝癌诊断标志物的价值
2005年,Block等[15]用乙型肝炎病毒感染土拨鼠,建立土拨鼠肝癌模型,并运用糖蛋白组学手段检测了GP73在肝癌组和正常组血清中的表达情况,结果发现在肝癌组血清中GP73明显增高。赵秀英等[16]对372例样本进行研究,其中健康组43例,肝炎肝硬化组110例,肝癌组219例。健康组GP73表达量为22.1 ng/mL,肝炎肝硬化组GP73表达量为81.4 ng/mL,肝癌组GP73表达量为271.5 ng/mL,GP73的表达在肝癌组明显高于健康组及肝炎肝硬化组。
Mao等[17]进行了大样本,多中心,多种族患者的GP73系列相关研究,将4217名病例分为健康组(1690例)、HBV(hepatitis B virus)组(337例)、肝硬化组(512例)、肝癌组(789例)、其他恶性肝脏疾病组(61例)、良性肝肿瘤组(206例),14种非肝肿瘤组(622例)等,对各组人群检测其血清GP73表达量。结果显示,健康组为1.2个相对单位,HBV组为2.9个相对单位,肝硬化组为4.7个相对单位,肝癌组在所有组中GP73含量最高,高达14.7个相对单位,再次证实了GP73可以作为肝癌早期的诊断标志物。
近年来许多研究者都用实验证明了GP73对于肝癌的早期诊断具有较高的敏感性与特异性,虽然各研究者所取的临界值不同,但我们可以大致看到一个范围,GP73敏感性范围为69%~83%,特异性范围为73%~97%[11,16~22](见表 1)。Mao 等[17]用 Immunoblot的方法对4217例样本进行研究,发现GP73对于肝癌早期诊断具有较高的敏感性与特异性,其敏感性为74.6%,特异性为97.4%,可见GP73对肝癌早期诊断具有一定价值。早在2005年,Marrero等[22]就发现GP73对肝癌早期诊断具有较高的敏感性和特异性。由于当时技术的限制,他们采用Immunoblot的方法检测352个样本的血清GP73,以10个相对单位作为临界值,发现GP73对于肝癌早期诊断的敏感性与特异性分别为69%和75%,AUROC为0.79,这组数据值虽然相对近年来的研究数据值较低(比较表1),但也从侧面证实了GP73对于肝癌早期诊断的价值。Tian等[18]发现在早期肝癌患者血清中GP73为110.4 μg/L,进展期肝癌患者血清水平为102.8μg/L,二者无明显差异,说明在早期肝癌患者血清中就可以检测出高水平GP73,也证实了GP73的敏感性较高。
值得一提的是,Ozkan等[23]报告对78例肝癌,55例肝硬化和28例健康人进行检测,却得出与大多数学者不同的研究结果。他们发现GP73对于肝癌早期诊断的敏感性为82%,但是特异性仅为9%,因此认为GP73作为单独的肝癌诊断标志物,优越性低于AFP。但即使如此,我们也可以发现,GP73诊断肝癌的敏感性较高,可以在一定程度上弥补AFP敏感性较低所带来的局限性,从一定程度上体现了GP73对于肝癌早期诊断的价值。
Hu等[19]通过Western blotting法检测亚洲人血清中GP73的表达,发现乙肝病毒相关性肝癌组检测的数值在所有检测组中是最高的。其在健康人组为1.13个单位,在乙肝病人组为3.01个单位,在肝硬化病人组为5.68,在乙肝病毒相关性肝癌病人组为17.15个单位。在相同条件下检测,发现GP73诊断乙肝病毒相关性肝癌的敏感性与特异性分别为77.4%,83.9%,AUROC为0.89,而AFP则为48.4%,96.8%,AUROC为0.77。毛一雷等[24]也发现了类似的结果,在以乙肝为基础的肝癌患者血清中的GP73则显著增高,其诊断肝癌的敏感度(76.9%)较AFP(48.6%)显著升高,并且特异度达到88%。
多项研究[16,17,22]都证实,不管是HBV、HCV(hepatitis C virus)病毒相关性肝癌,还是非病毒相关性肝癌,肝癌患者血清中所测得的GP73水平都显著高于良性肝病。Riener等[25]使用免疫组化的方法研究肝细胞癌、良性肝脏疾病、胆管细胞癌(Cholangiocarcinoma)及健康人的肝脏组织中GP73的表达,结果发现,肝癌组织中GP73表达明显增强,其表达明显高于其周围的非癌变组织,而肝脏良性疾病组织中GP73的表达对比周围正常组织,差别无统计学意义。Mao等[17]也发现在肝良性肿瘤及恶性肝病中检测到的血清GP73水平,显著低于HCC患者。值得一提的是,Tian等[18]用ELISA法检测HCC、肝炎、肝硬化、局灶结节性增生、血管瘤、肝内胆管瘤、肝转移性腺瘤、健康人等535例样本中血清GP73含量,虽然结果表明GP73在肝硬化组表达最高,与大多数实验结果不同,但是实验也证实了GP73在HCC、肝炎患者中的表达差异是具有统计学意义的。这些都说明用GP73有助于良恶性肝病与肝癌之间的鉴别诊断。

表1 各研究组对于GP73诊断早期肝癌的价值研究Table1 The value of serum GP73 as a marker in the diagnosis of HCC in different researches
除此之外,Riener等[25]还发现HCV感染导致的HCC和胆管细胞癌患者的血清GP73水平(均值分别为18 mg/L和14.5 mg/L)明显高于健康人群(均值为4 mg/L)。HCC和胆管细胞癌的肝脏组织强烈表达GP73。Tian等[18]也发现了同样的现象。由此可见,GP73有望成为胆管细胞癌的一个血清标志物。
研究还发现,GP73表达水平的提高可能还与肿瘤的侵犯转移密切相关。Sun等[26]用免疫组化的方法发现,肝癌组织中GP73的表达与血管侵犯、肿瘤分化等密切相关,提示GP73能增强肿瘤的浸润和转移。除此之外,研究[18,25,28]还发现GP73对于肝癌的术后预测预后也有一定的价值。据资料显示[24],GP73在HCC患者术后一周内维持在一定水平,但术后1.5~2年下降明显,低于肝癌组,略高于正常组。也有研究者[27]发现,HCC患者术后1~8周内GP73下降明显。总之,多项研究[17,24,27,28]都证实GP73在HCC患者术后或治疗后,有下降趋势,而在肝癌复发时GP73重新增高。术后血清GP73水平依旧维持在较高水平者,5年复发率明显升高。
3 GP73与AFP相比较
对表2中数据进行比较可发现,从总体水平来看,AFP对于肝癌诊断的特异性略高于GP73,但AFP的敏感性显著低于GP73,AUROC值则是GP73略高于AFP。因而从总体上来看,GP73略优于AFP。而单看敏感性,GP73则显著优于AFP。很多研究[16,22,29]都发现在AFP阴性的患者中,可以检测出高水平的GP73。
Marrero等[22]研究发现在AFP水平低于20 ng/mL的HCC患者中,有62%的患者血清GP73水平超过最佳临界值,而在AFP水平低于100 ng/mL的HCC患者中,有71%的患者血清GP73水平超过最佳临界值。赵秀英等[16]在大样本试验中也发现,对于149例AFP<400 ng/mL的HCC样本中,有108例(72.5%)患者GP73>100 ng/mL。张亚松等[29]也发现45例HCC患者血清AFP≤13.3 μg/L,GP73检出阳性25例(55.6%);33例AFP<7 μg/L,其 GP73检出阳性17例(52%)。大量研究都证实,GP73对于AFP阴性患者具有较高的检出率,能在一定程度上弥补AFP的不足。
除此之外,AFP与GP73的不同之处还表现在肿瘤转移,术后预后等方面。目前的研究认为[12]GP73与肿瘤大小,结节数目,是否多发及临床分期等无密切相关性,与病理分级及合并肝硬化相关。而AFP则与肿瘤大小,临床分期等有相关性。在肝癌较小、癌肿数量少甚至单发或患者肝功能较好时,AFP升高水平较低甚至不升高,而只有当肝癌发生侵袭时,如癌栓形成,包膜浸润,血管侵犯,肝内转移及肿瘤分化时,血清AFP才显著升高[30]。而GP73则在肝癌早期就显著升高,并且可能起到增强肿瘤转移的作用。AFP与GP73都对于肝癌术后预测预后具有一定的价值,不同之处是GP73血清水平是随时间逐渐下降[24,27],而AFP则在术后一周就明显下降。血清AFP水平在胆管细胞型肝癌患者中并没有明显提高,处于较低的水平。毛一雷等[24]研究发现,有4/6的胆管细胞型肝癌患者血清中GP73显著提高,其提高的水平低于肝癌患者,高于HBV病毒感染者。Riener[25]和Tian等[18]也得出了同样的结论。
4 GP73与AFP联合诊断
GP73敏感性高,但特异性较AFP低。AFP敏感性差,但特异性高,提示两者联合诊断能提高肝癌的检出率。研究发现[31]GP73与AFP不存在相关性(Spearman相关分析,P=0.667),在所有HCC患者中,41.3%两者仅一个指标升高,54.7%两者皆升高,而仅有4%两个指标均不升高,两者联合诊断可使HCC诊断率显著提高。
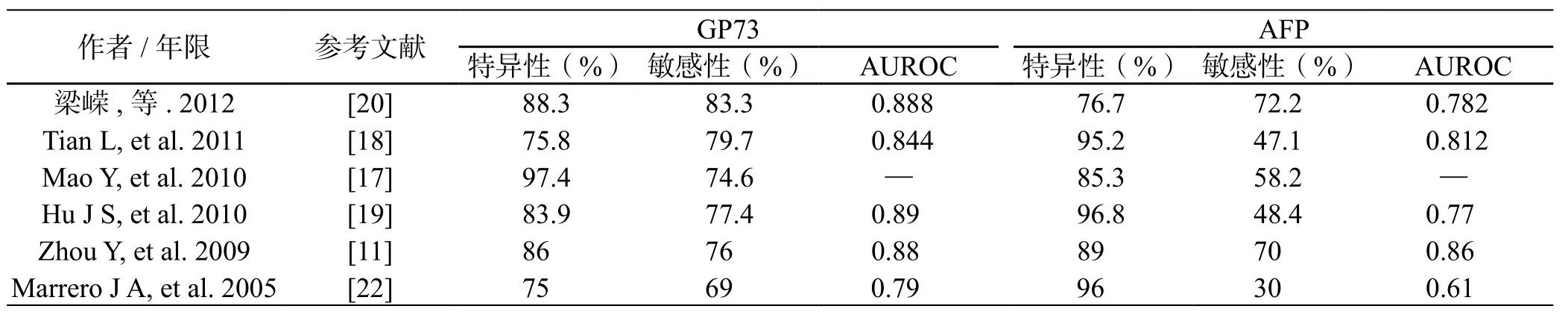
表2 GP73与AFP对于肝癌早期诊断的价值比较Table 2 Comparison of the efficacy of serum GP73 and AFP levels in the early diagnosis of HCC
Mao等[17]的多中心大样本研究表明,AFP联合GP73检测后,敏感性提高到了89.2%,特异性提高到了85.2%(GP73,AFP单项检测的敏感度分别为 74.6%、58.2%,特异性分别为 97.4%、85.3%)。姚建华[32]发现GP73和AFP联检,敏感性升高为92.98%,特异性为88.89%,准确度为90.83%,阳、阴性预测值分别为88.33%和90.32%,与单项指标相比具有统计学差异。且GP73与AFP联检的AUROC为0.929,高于单项检测值(GP73为0.9000,AFP为0.802)。
杨盛力等[33]运用Meta分析发现,GP73与AFP联合检测的敏感性和特异性分别为0.889和0.831,敏感性提高,而且AUROC为0.9282,因此GP73联合AFP检测可以减少对肿瘤患者的漏诊。同时检测血清AFP与GP73,对AFP阴性的肝癌患者中有一定诊断价值,有助于无临床症状及体征的肝癌患者的早期发现,能够达到早诊断,早治疗,提高肝癌患者生存期。总之,GP73与AFP联合诊断可以大大提高诊断肝癌的敏感性。
5 问题与展望
GP73自被发现后,一直受到人们的关注,其所具有的较高的敏感性,能够较好的弥补AFP敏感性较低所带来的局限性,与AFP联合诊断能较好的提高肝癌诊断的敏感性。而其单独检测时特异性也不低,从而也使其具有一定单独诊断肝癌的价值。
但是GP73若想推广于临床,还有很多问题尚待解决。首要问题就是GP73的生物学特性,分泌机制,功能等问题。目前对于GP73的分子生物学特性,功能知之甚少,其在多种正常细胞表达,表明其有某些看家功能,但在各种细胞中的表达水平又相差巨大,说明该蛋白还有许多未知功能。GP73是稳定高尔基体复合体的一个必要成分,还是高尔基体的功能组成成分,还是两者兼具,其在蛋白上的结构域的具体功能如何,在肝癌组织中是通过何种调控使GP73表达量升高的,GP73在肝细胞受损及HCC患者中升高的原因是否相同,它与肿瘤的发生发展是否有关,它是HCC的癌启动因子,还是HCC细胞固有的表达蛋白,通过阻断其表达是否可达到治疗HCC的目的等等均未明确,这些都有待进一步研究。
而另一个亟待解决的问题,就是GP73的临床研究缺乏多中心大样本的联合临床研究来评价其临床应用价值。大样本研究[34]将避开一个标志物在一个人群为阳性/阴性时在另外一个人群是阴性/阳性的尴尬情况,对于从多方面确定标志物的临床价值具有重要意义。除此之外,GP73与肝癌大小,分期,复发,预后等关系还需要更系统深入的分析。随着对GP73研究的深入,也发现GP73不仅在肝癌患者血清中高表达,有时在肝硬化进展期以及急性肝炎患者血清中也高表达,不利于肝癌的鉴别诊断。GP73是否还在其它肝脏疾病中高表达,在不同肝脏中疾病的血清及组织中表达是否具有统计学差异,是否可以利用这些进行鉴别诊断,这些都有待进一步研究。
目前,GP73的检测方法很多,大多数人使用ELISA,Western blot,Immunoblot这三种方法,后两种方法是半定量的,虽然能够获得较高的敏感性与特异性,但操作起来步骤多,易出错;ELISA操作简便,经济,但用ELISA方法检测GP73时,血清中存在GP73自身抗体,会干扰ELISA检测,从而导致检测结果出现误差[35]。Tian等[18]在实验中发现,用ELISA方法检测时,HCC组的血清GP73水平是正常组的2.2倍,而用Western blot方法检测时,HCC组的血清GP73水平是正常组的1.4倍,说明用ELISA检测可能更敏感。陈旺等[36]已开始研发GP73单克隆抗体,以取代GP73多克隆抗体,增加实验稳定性与均一性,从而为进一步开发更有价值的ELISA试剂盒做准备。除了ELISA之外,有研究[19]证明用RT-PCR检测GP73 mRNA似乎比Western blot更敏感,而这有可能为GP73在临床上大规模使用带来曙光。除此之外,(电)化学发光免疫分析法是目前敏感性较高的检测方法之一,临床上多使用其来检测AFP等肿瘤标志物的血清水平,但可能是成本问题以及GP73作为诊断标志物尚无官方或行业定论,目前尚无有实验室报道将(电)化学法光法用于GP73的检测。但寻求一种更经济,简便,稳定可靠,可供大规模使用的方法检测GP73,以推广其在临床检测中的应用是必须的。因而,若能研发出高灵敏、稳定检测血清GP73的方法试剂,不管对于GP73和AFP二者单独,还是联合运用于临床,都将是巨大进展,也将为日后我们对二者进行临床检测标准化规范带来简便。除了标准化临界点外,对于检验过程的标准化,也是必不可少的。规范检验过程中所有环节,可以减少任一环节的出错对检验结果的影响,提高精准度,减少出错率[37]。
另外,随着对肿瘤的不断研究,人们发现在肿瘤的进展过程中,蛋白质的糖基化,特别是岩藻糖基化是一个十分常见的现象。Norton等[38]使用凝集素亲和层析法进一步证明,从HCC来源的细胞分泌出来的GP73中有3/4的被岩藻糖基化,利用质谱法进一步证明,从培养的肝癌细胞分泌出来的大部分GP73分子上至少2/3N-连接糖基化位点被占据。说明在肝癌患者中,GP73的岩藻糖基化是一个十分常见的现象。研究也发现,岩藻糖基化的GP73比GP73相对于肝癌诊断具有更高的敏感度和特异度。一项包括80名患者的研究中[39],GP73诊断肝癌的敏感性和特异性为65%和90%,而岩藻糖基化的GP73敏感性和特异性高达90%和100%,提示可能有一些肝癌患者,其血清中GP73的水平不高,但岩藻糖基化的GP73明显增高。提示对于某些GP73阴性或低水平者,检测岩藻糖基化的GP73不失为一个更好的选择。
GP73不仅在肝癌等肝脏疾病中表达上调,而且在胆管细胞癌[18,24,25]、前列腺肿瘤[40]、肺癌[6]、精原细胞癌[41]等多种肿瘤中也存在表达上调,但在大部分透明细胞癌中表达下调[42]。GP73在多种肿瘤中的异常表达,使其有可能成为相应肿瘤的新的辅助诊断标志物。Kristiansen等[40]发现在614例前列腺肿瘤患者中,567例前列腺肿瘤腺体中GP73表达量上调,其诊断灵敏度为92.3%,稍低于AMACR(95%,583/614)。而在84%(26/31)AMACR阴性患者中也发现GP73有所上调,从而证实GP73可能成为前列腺肿瘤诊断的一个辅助标志物。Varambally及Wei等[13,43]也得出了类似的结论。Zhang等[6]用免疫组化的方法对178例肺癌患者进行检测,发现所有肺腺癌标本均为阳性,其中83.6%的细胞扩散染色。不过在鳞状细胞癌仅有16.3%染色强烈。而对于血GP73含量,相较于正常人(53 ng/mL),肺癌患者增高30%(69 ng/mL)。并且作者还推测肺癌组织中的GP73能通过肺泡进入循环系统的,若如此,就可以利用其它检测方法,使GP73有可能成为辅助肺癌(特别是肺腺癌)诊断及监测的生物标志物。不过也有研究[42]发现GP73对于肾癌的诊断方面意义不大。
总之,血清GP73是一个较为重要的肝癌标志物,其在诊断方面具有较高的敏感性和特异性,特别是高敏感性能有效弥补AFP低敏感性所带来的局限性。虽然目前GP73广泛运用于临床还存在很多问题,但是随着各界学者以及临床医师对该领域的进一步深入研究,相信在不久的将来,GP73将广泛应用到HCC的早期诊断,发病机制,肿瘤药物治疗靶点以及治疗效果等研究中去。
[1] 中华人民共和国卫生部. 原发性肝癌诊疗规范(2011年版)[J]. 临床肝胆病杂志, 2011, 27(11): 1141-1159.
[2] Debruyne E N, Delanghe J R. Diagnosing and monitoring hepatocellular carcinoma with alpha-fetoprotein: new aspects and applications[J]. Clin Chin Acta, 2008, 395(1-2), 19-26.
[3] Li X, Wu K, Fan D. Serum golgi phosphoprotein 2 level:a better marker than alpha-fetoprotein for diagnosing early hepatocellular carcinoma[J]. Hepatology, 2009, 50(5): 1682.
[4] Kladney R D, Bulla G A, Guo L, et al. GP73, a novel Golgilocalized protein upregulated by viral infection[J]. Gene,2000, 249(1-2): 53-65.
[5] Hu L, Li L, Xie H, et al. The Golgi localization of GOLPH2(GP73/GOLM1) is determined by the transmembrane and cytoplamic sequences[J]. PLoS One, 2011, 6(11): e28207.
[6] Zhang F, Gu Y, Li X, et al. Up-regulated Golgi phosphoprotein 2 (GOLPH2) expression in lung adenocarcinoma tissue[J]. Clin Biochem, 2010, 43(12):983-991.
[7] Puri S, Bachert C, Fimmel C J, et al. Cycling of early Golgi proteins via the cell surface and endosomes upon lumenal pH disruption[J]. Traffic, 2002, 3(9): 641-653.
[8] Bachert C, Fimmel C, Linstedt A D. Endosomal trafficking and proprotein convertase cleavage of cis Golgi protein GP73 produces marker for hepatocellular carcinoma[J].Traffic, 2007, 8(10): 1415-1423.
[9] Iftikhar R, Kladney R D, Havlioglu N, et al. Disease-and cell-specific expression of GP73 in human liver disease[J].Am J Gastroenterol, 2004, 99(6): 1087-1095.
[10] Shi Y, Chen J, Li L, et al. A study of diagnostic value of golgi protein GP73 and its genetic assay in primary hepatic carcinoma[J]. Technol Cancer Res Treat, 2011, 10(3):287-294.
[11] Zhou Y, Yin X, Ying J, et al. Golgi protein 73 versus alphafetoprotein as a biomarker for hepatocellular carcinoma: a diagnostic meta-analysis[J]. BMC Cancer, 2012, 12: 17.
[12] Yamamoto K, Imamura H, Matsuyama Y, et al. AFP,AFP-L3, DCP, and GP73 as markers for monitoring treatment response and recurrence and as surrogate markers of clinicopathological variables of HCC[J]. J Gastroenterol,2010, 45(12): 1272-1282.
[13] Varambally S, Laxman B, Mehra R, et al. Golgi protein GOLM1 is a tissue and urine biomarker of prostate cancer[J].Neoplasia, 2008, 10(11): 1285-1294.
[14] Wright L M, Huster D, Lutsenko S, et al. Hepatocyte GP73 expression in Wilson disease[J]. J Hepatol, 2009, 51(3):557-564.
[15] Block T M, Comunale M A, Lowman M, et al. Use of targeted glycoproteomics to identify serum glycoproteins that correlate with liver cancer in woodchucks and humans[Z].Proc Natl Acad Sci U S A, 2005, 102(3): 779-784.
[16] 赵秀英, 李宁, 丁惠国, 等. 血清高尔基体糖蛋白73在肝细胞癌诊断中的作用[J]. 中华肿瘤杂志, 2010, 32(12):943-946.
[17] Mao Y, Yang H, Xu H, et al. Golgi protein 73 (GOLPH2) is a valuable serum marker for hepatocellular carcinoma[J]. Gut,2010, 59(12): 1687-1693.
[18] Tian L, Wang Y, Xu D, et al. Serological AFP/Golgi protein 73 could be a new diagnostic parameter of hepatic diseases[J]. Int J Cancer, 2011, 129(8): 1923-1931.
[19] Hu J S, Wu D W, Liang S, et al. GP73, a resident Golgi glycoprotein, is sensibility and specificity for hepatocellular carcinoma of diagnosis in a hepatitis B-endemic Asian population[J]. Med Oncol, 2010, 27(2): 339-345.
[20] 梁嵘, 罗小玲, 葛莲英, 等. GP73在肝细胞癌诊断中的价值[J]. 肿瘤, 2012, 32(2): 115-118.
[21] 费迎明, 许文芳, 周建康, 等. 高尔基体蛋白73(GP73)在原发性肝癌中的早期诊断价值研究[J]. 医学研究杂志,2011, 40(12): 57-60.
[22] Marrero J A, Romano P R, Nikolaeva O, et al. GP73,a resident Golgi glycoprotein, is a novel serum marker for hepatocellular carcinoma[J]. J Hepatol, 2005, 43(6):1007-1012.
[23] Ozkan H, Erdal H, Tutkak H, et al. Diagnostic and prognostic validity of Golgi protein 73 in hepatocellular carcinoma[J].Digestion, 2011, 83(1-2): 83-88.
[24] 毛一雷, 杨华瑜, 徐海峰, 等. 新的肝癌血清标记物GP73在肝癌诊断中的初步研究[J]. 中华医学杂志, 2008, 88(14):948-951.
[25] Riener M O, Stenner F, Liewen H, et al. Golgi phosphoprotein 2 (GOLPH2) expression in liver tumors and its value as a serum marker in hepatocellular carcinomas[J].Hepatology, 2009, 49(5): 1602-1609.
[26] Sun Y, Yang H, Mao Y, et al. Increased Golgi protein 73 expression in hepatocellular carcinoma tissue correlates with tumor aggression but not survival[J]. J Gastroenterol Hepatol, 2011, 26(7): 1207-1212.
[27] 梁嵘. 高尔基体糖蛋白73对原发性肝癌的诊断价值研究[D]. 广西医科大学, 2012.
[28] Hann H W, Wang M, Hafner J, et al. Analysis of GP73 in patients with HCC as a function of anti-cancer treatment[J].Cancer Biomark, 2010, 7(6): 269-273.
[29] 张亚松, 石玉玲, 张喜钦. GP73在肝癌早期诊断中的应用价值[J]. 医学临床研究, 2011, 28(4): 651-653.
[30] 蔡云峰, 甄作均, 陈焕伟, 等. 肝癌术后肝再生状态与肝癌复发关系的初步研究[J]. 中国普通外科杂志, 2008, 17(7):692-696.
[31] 方玫玫, 陈展洪, 李星, 等. 肝癌及肝硬化患者血清中GP73的表达及临床意义[J]. 实用医学杂志, 2011, 27(20):3716-3718.
[32] 姚建华. 高尔基体蛋白73和甲胎蛋白联检在原发性肝癌诊断中的临床应用[J]. 放射免疫学杂志, 2012, 25(6):673-675.
[33] 杨盛力, 王云霞, 赵志辉, 等. 比较GP73和AFP联合检测与AFP单项检测对原发性肝癌的诊断价值的meta分析[J]. 肝胆外科杂志, 2012, 20(4): 251-255.
[34] Sturgeon C M, Hoffman B R, Chan D W, et al. National Academy of Clinical Biochemistry Laboratory Medicine Practice Guidelines for use of tumor markers in clinical practice: quality requirements[J]. Clin Chem, 2008, 54(8):e1-e10.
[35] Gu Y, Chen W, Zhao Y, et al. Quantitative analysis of elevated serum Golgi protein-73 expression in patients with liver diseases[J]. Ann Clin Biochem, 2009, 46(Pt 1): 38-43.
[36] 陈旺, 杨华瑜, 毛一雷, 等. 高尔基蛋白73单克隆抗体在肝细胞肝癌诊断中的价值[J]. 中国医学科学院学报, 2011,33(1): 39-44.
[37] 石远凯, 杨晟. 合理应用肿瘤标志物以提高临床治疗水平[J]. 中华检验医学杂志, 2012, 35(2): 101-102.
[38] Norton P A, Comunale M A, Krakover J, et al. N-linked glycosylation of the liver cancer biomarker GP73[J]. J Cell Biochem, 2008, 104(1): 136-149.
[39] Drake R R, Schwegler E E, Malik G, et al. Lectin capture strategies combined with mass spectrometry for the discovery of serum glycoprotein biomarkers[J]. Mol Cell Proteomics,2006, 5(10): 1957-1967.
[40] Kristiansen G, Fritzsche F R, Wassermann K, et al. GOLPH2 protein expression as a novel tissue biomarker for prostate cancer: implications for tissue-based diagnostics[J]. Br J Cancer, 2008, 99(6): 939-948.
[41] Fritzsche F R, Kristiansen G, Riener M O, et al. GOLPH2 expression may serve as diagnostic marker in seminomas[J].BMC Urol, 2010, 10: 4.
[42] Fritzsche F R, Riener M O, Dietel M, et al. GOLPH2 expression in renal cell cancer[J]. BMC Urol, 2008, 8: 15.
[43] Wei S, Dunn T A, Isaacs W B, et al. GOLPH2 and MYO6:putative prostate cancer markers localized to the Golgi apparatus[J]. Prostate, 2008, 68(13): 1387-1395.
