造血干细胞移植术后人巨细胞病毒包膜糖蛋白gB抗原血症及gB特异性CD8+ T细胞测定
2013-11-05刘安兵黄雅萍胡建华梁韩英杨鎔王慧琦陈晓明范骏
刘安兵 黄雅萍 胡建华 梁韩英 杨鎔 王慧琦 陈晓明 范骏
人巨细胞病毒(human cytomegalovirus,HCMV)是疱疹病毒科β属的一种机会性致病性双链DNA病毒,当机体免疫力低下尤其异基因造血干细胞移植术后HCMV的激活增加了威胁生命的多种并发症的风险[1~3]。在异基因造血干细胞移植术后,有效的HCMV特异性CD8+T细胞免疫应答能够长期避免HCMV激活和疾病的发生[4]。因此,研究移植术后HCMV感染状态和CD8+T细胞免疫机制可能对控制病毒感染建立理论基础。
目前病毒即刻早期(immediate-early,IE)和磷蛋白 65(phosphoprotein 65,pp65)抗原的检测尤其pp65抗原血症的检测更被认为是诊断HCMV活动性感染的“标准方法”之一[5~6]。包膜糖蛋白B(glycoprotein B,gB)是由HCMV UL55编码的最重要包膜抗原之一,检测gB抗原可能有助于诊断和监测HCMV感染。gB具有重要的免疫原性,不仅能够诱导机体产生中和抗体[7],而且还能诱导特异性CD8+T细胞免疫,是T细胞免疫应答的重要靶抗原[8~9]。因此,检测gB诱导的特异性T细胞对阐明HCMV致病机理具有重要作用。
本研究检测了92份异基因造血干细胞移植术后病人外周血白细胞标本gB、 IE和pp65抗原,探讨了gB抗原检测的应用价值;分析了gB特异性CD8+T细胞在移植术后控制HCMV感染的免疫应答效应。
1 方法
1.1 标本来源及分组
共收集外周血EDTA抗凝标本92份。标本来源于异基因造血干细胞移植术后本院住院和门诊随访病人,排除二次移植及术前检测HCMV pp65或IE抗原阳性的病人,共64例(男性34例,女性30例),平均年龄29.7±9.9岁(10岁~55岁),术前原发病包括髓性白血病(42例),淋巴细胞性白血病(16例),骨髓异常增生综合症(3例),再生性障碍性贫血(2例)和淋巴瘤(1例)。
根据病人行移植术之日至此次检测的时间长短对所收集的待测标本进行分组:A组(0≤时间间隔/月≤3),共22份标本;B组(3<时间间隔/月≤12),共27份标本;C组(时间间隔/月>12),共43份标本。
1.2 外周血白细胞gB、pp65和IE抗原检测
取新鲜EDTA 抗凝血5 mL,分离白细胞并制作白细胞涂片[10]。免疫组化二步法检测gB、pp65和IE抗原。商品化鼠源性HCMV gB单克隆抗体购自美国Novus公司,HCMV pp65单克隆抗体、IE单克隆抗体和EnVisionTMSystem检测试剂盒购自丹麦Abcam公司。光学显微镜为日本产OLYMPUS(CHA213)。操作流程参照厂商说明书进行。以正常MRC-5细胞和HCMV Towne株感染的MRC-5细胞分别为阴性对照和阳性对照。MRC-5和HCMV标准株Towne株购自美国菌种保藏中心(American Type Culture Collection,ATCC)。阳性细胞呈棕黄色或棕褐色,阴性细胞呈淡蓝色。阳性结果以阳性细胞数/5×104WBC表示[11]。
1.3 gB抗原T细胞表位筛选及MHC-肽五聚体合成
根据gB蛋白(登录号:M60929)氨基酸序列,应用SYFPEITHI算法[12]和高通量的REVEALTM主要组织相容性抗原-肽结合力测定[13]预测、筛选出7条潜在的HLA-A*1101限制性的gB九肽。氨基酸序列如下:P1,VTITTARSK;P2,ISWDIQDEK;P3,MTATFLSKK;P4,GTVFVAYHR;P5,VTINQTSVK;P6,KVLRDMNVK;P7,TSYNQTYEK。然后合成HLA-A*1101-gB九肽五聚体(ProImmune公司)。
选取异基因造血干细胞移植受者16例,术后100天采集外周全血标本16份,Ficoll密度梯度离心法分离出16份PBMCs,Ficoll液购自天津市灏洋生物制品科技有限责任公司,分别用合成的7种五聚体进行染色,每种五聚体染色一次,进行MHC-肽五聚体实验。
1.4 MHC-肽五聚体实验
五聚体染色根据试剂说明书进行。1×106个外周血单个核细胞(PBMCs)加入2μL的五聚体孵育10 min,用2 mL洗液洗涤两次,之后加入8μL的FluoroTag-藻红蛋白(PE)和1μL异硫氰酸荧光素(FITC)标记的CD8单克隆抗体(ProImmune公司)于4℃避光孵育20 min。2 mL洗液洗涤两次后Beckman Coulter流式细胞仪(FC500 MPL,Fullerton,CA)进行分析,至少分析100 000个细胞。
1.5 统计学方法
采用SPSS 16.0软件包进行统计分析。抗原检测阳性率比较采用配对四格表资料McNemar检验、相关性分析采用Spearman相关分析;组内阳性率比较采用配对四格表资料Fisher确切概率法;组间阳性率比较采用四格表资料校正χ2检验;gB332-340五聚体+CD8+T细胞频率与gB抗原血症的相关性分析使用Pearson相关分析。P<0.05表示差异有统计学意义。
2 结果
2.1 gB、IE和pp65抗原检测
外周血白细胞样本中HCMV gB抗原检测阳性细胞棕褐色染色明显,边界清晰,区别于淡蓝色的阴性细胞,见图1所示。92份标本的gB抗原、IE抗原和pp65抗原检测阳性率分别为82.6%(76/92)、92.4%(85/92)和90.2%(83/92),两两比较:gB抗原和IE抗原阳性率差异有显著性(P=0.035);gB抗原和pp65抗原阳性率差异无显著意义(P=0.065);pp65抗原和IE抗原阳性率差异无显著意义(P=0.727)。三者抗原检测结果两两之间均呈正相关(rgB&IE=0.827,P=0.000 ;rgB&pp65=0.877,P=0.000 ;rIE&pp65=0.912,P=0.000)。
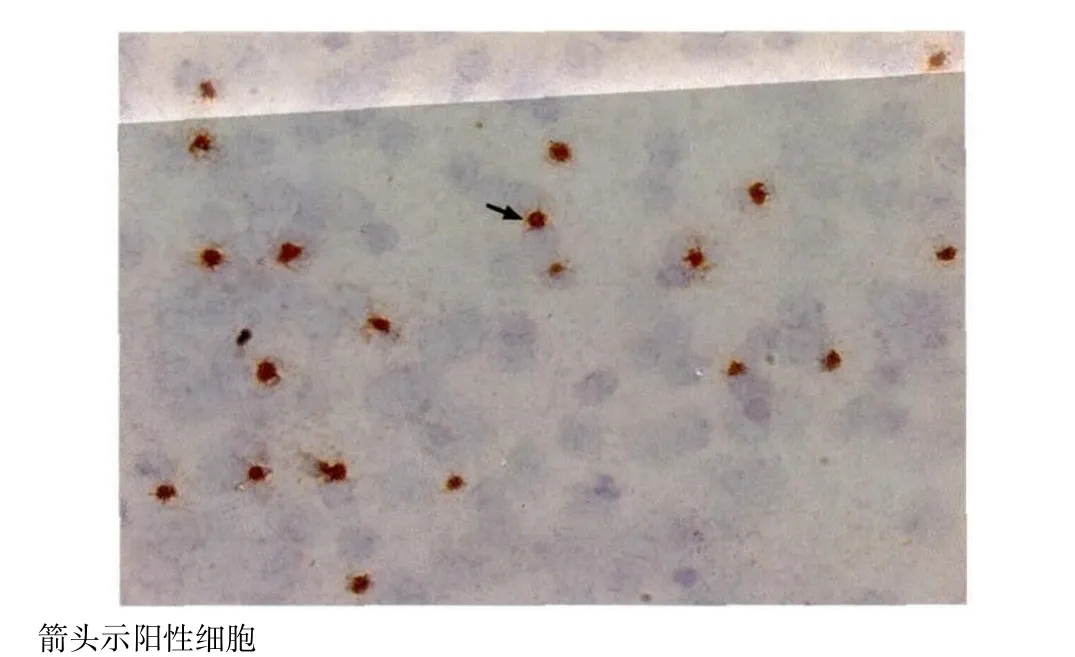
图 1 酶免疫组化pp65抗原血症检测Figure 1 Detection of pp65 antigenaemia in a leucocytic sample by enzyme immunohistochemistry
2.2 组内及组间gB、IE和pp65抗原检测比较
A、B、C三组组内gB、IE和pp65抗原检测阳性率分别为:(1)A 组:86.4%(19/22)、90.9%(20/22)和 90.9%(20/22);(2)B 组:88.9%(24/27)、100%(27/27)和 92.6%(25/27);(3)C 组:76.7%(33/43)、88.4%(38/43)和88.4%(38/43)。其中C组gB抗原和IE抗原之间(P=0.005)、gB抗原和pp65抗原之间阳性率差异有统计学意义(P=0.005);A组内gB抗原和IE抗原之间(P=1.000)、gB抗原和pp65抗原之间(P=1.000)阳性率差异无显著意义;B组内gB抗原和IE抗原之间(P=0.236)、gB抗原和pp65抗原之间(P=1.000)阳性率差异无显著意义。在C组中,gB阴性而IE或pp65阳性的标本,其IE或pp65阳性值处于一个较低的范围(1~6/5×104WBC)。
A、B、C三组组间gB、IE和pp65抗原检测阳性率比较:同种抗原检测阳性率组间差异均无显著性,即三种抗原在移植术后不同时期内的阳性率保持稳定。
2.3 gB表位筛选和gB特异性CD8+ T细胞测定
选取16例异基因造血干细胞移植HLA-A*1101受者于移植后100天采集外周全血标本16份,分离出16份PBMCs,分别用合成的7种不同五聚体进行染色,每种五聚体染色一次,各种五聚体+CD8+T细胞的均值如下:P1,0.14%;P2,0.23%;P3,0.18%;P4,0.16%;P5,0.15%;P6,0.16%;P7,0.15%。各种五聚体测定对应的染色阳性的细胞进行两两比较,结果显示P2(gB332-340)对应的五聚体+CD8+T细胞与其它九肽对应的五聚体+CD8+T细胞相比具有显著性差异(P<0.05)。图2为1例异基因造血干细胞移植患者术后100天流式细胞术检测外周血gB332-340特异性的CD8+T细胞的结果。gB九肽(ISWDIQDEK)可能是HLA-A*1101限制性的相对优势抗原肽。分析发现,gB332-340特异性的CD8+T细胞的频率与外周血gB抗原血症的发生呈负相关(r=-0.6721;P=0.0043)。
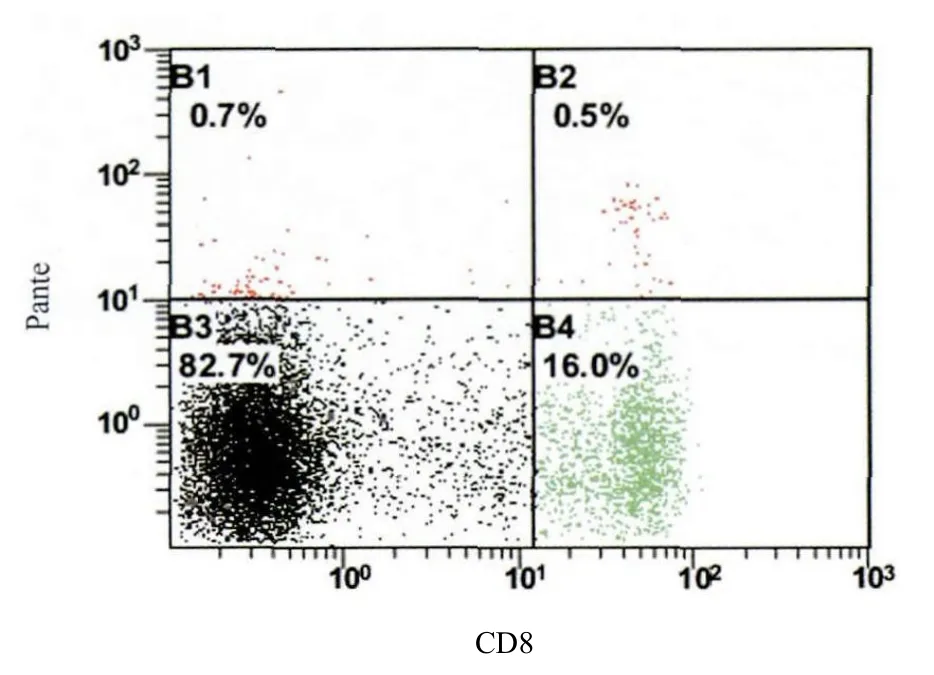
图 2 流式细胞术外周血gB332-340特异性的CD8+ T细胞检测Figure 2 Detection of gB332-340-specific CD8+ T cells in a peripheral blood sample by flow cytometry
3 讨论
人巨细胞病毒是异基因造血干细胞移植术后感染的常见病原体,尽管目前常规采取术前预防性抗病毒治疗,HCMV仍然是导致患者术后感染和死亡的重要原因之一[14]。gB是HCMV最重要的包膜糖蛋白之一,参与病毒穿入宿主细胞、细胞间传播[15]以及感染细胞间融合[16]过程。鉴于gB蛋白在HCMV感染中的重要作用,检测gB抗原可能有助于诊断和监测HCMV感染。
在与pp65和IE抗原检测的比较中发现,gB抗原与pp65和IE抗原均呈正相关(rgB&IE=0.827 ;rgB&pp65=0.877 ;rIE&pp65=0.912),其阳性率(82.6%)和pp65抗原阳性率(90.2%)的差异无显著意义(P=0.065),但比IE抗原阳性率(92.4%)低(P=0.035)。HCMV的复制周期可以分为三个阶段:即刻早期、早期和晚期[17]。蛋白IE、pp65和gB分别在复制周期的即刻早期、晚期和晚期合成[17~19];而在一个病毒复制周期中,gB的合成完成更晚于pp65;gB是组成病毒包膜结构的蛋白之一,膜蛋白合成成熟意味着病毒即将完成装配。这似乎可以解释gB抗原检测阳性率低于IE抗原检测阳性率,而与pp65抗原检测阳性率无差异。我们仍需要扩大样本含量得以证实这一结果。在对待测样本的检测中,大部分的标本可同时检测到三种抗原,表明在病毒复制周期中蛋白质的合成不是完全独立的过程,而是一个有序并重叠关联的过程。
为了比较移植术后不同时期三种病毒抗原的检测情况,我们将待测样本分组并排除二次移植及术前pp65或IE抗原阳性等因素:A组(移植术后3个月内)、B组(移植术后3个月至1年)和C组(移植术后1年以上)。三种抗原检测阳性率在移植术后1年内差异无显著性,这提示在移植术后短期或中期的HCMV检测中,类似于IE和pp65,gB有潜在的早期诊断价值。值得注意的是,由于gB合成成熟预示着病毒的装配完成,及在病毒穿入和细胞间传播中的重要作用[20~21],gB抗原阳性可能是一个提示病毒感染能力的指标。在异基因造血干细胞移植术后3个月内,HCMV感染与急性移植物抗宿主病及急性排斥反应的发生相关[22],严重的HCMV病可能导致移植失败甚至死亡;相应地,病毒检测应首先满足早期诊断的需要以便临床预先干预和治疗,此时选择病毒复制早期的抗原(如IE抗原)更具预防意义。对于移植术后长期随访的病人来说,控制慢性排斥反应和维持机体各器官功能的平衡稳定相对更为重要[23],同时,抗病毒需要提高机体免疫功能而可能导致排斥的发生[24];相应地,病毒检测应首先满足确定诊断的需要以防抗病毒药物加重脏器负担。因此,此时应选择病毒复制晚期的抗原(如gB抗原)以减少病毒感染的假阳性诊断。在此次研究中,移植术后1年以上的标本,其gB抗原阳性率低于IE和pp65抗原阳性率(P=0.005);并且,在gB阴性而IE或pp65阳性的标本中,IE或pp65阳性值处于一个较低的范围(1~6/5×104WBC)。这些提示,gB抗原血症检测是在监测移植术后长期随访病人HCMV感染中对IE和pp65抗原血症检测方法的一种补充。
我们应用基于流式细胞术的五聚体技术成功筛选出HLA-A*1101限制性的gB相对优势抗原九肽gB332-340,认为gB是CD8+T细胞免疫应答的靶抗原。另外发现gB332-340特异性的CD8+T细胞的频率与外周血gB抗原血症的发生呈负相关(r=-0.6721;P=0.0043),或许gB332-340特异性的CD8+T细胞在控制HCMV感染中起到重要作用。我们下一步将深入探讨gB332-340特异性的CD8+T细胞的功能(如细胞毒性分析、细胞因子分泌等)。这些工作将为HCMV致病机理的阐述和T细胞过继免疫治疗打下坚实基础。
[1] Boeckh M, Leisenring W, Riddell S R, et al. Late cytomegalovirus disease and mortality in recipients of allogeneic hematopoietic stem cell transplants: importance of viral load and T-cell immunity[J]. Blood, 2003, 101(2): 407-414.
[2] Zhang X, Huang Y P, Gao H N, et al. Quantification of cytomegalovirus glycoprotein Bn DNA in hematopoietic stem cell transplant recipients by real-time PCR[J]. PLoS One, 2012, 7(12): e51224.
[3] Baldanti F, Lilleri D, Gerna G. Monitoring human cytomegalovirus infection in transplant recipients[J]. J Clin Virol, 2008, 41(3): 237-241.
[4] Quinnan G V Jr, Kirmani N, Rook A H, et al. Cytotoxic t cells in cytomegalovirus infection: HLA-restricted T-lymphocyte and non-T-lymphocyte cytotoxic responses correlate with recovery from cytomegalovirus infection in bone-marrow-transplant recipients[J]. N Engl J Med, 1982,307(1): 7-13.
[5] Baldanti F, Revello M G, Percivalle E, et al. Use of the human cytomegalovirus (HCMV) antigenemia assay for diagnosis and monitoring of HCMV infections and detection of antiviral drug resistance in the immunocompromised[J]. J Clin Virol, 1998, 11(1): 51-60.
[6] Boeckh M, Bowden R A, Gooley T, et al. Successful modification of a pp65 antigenemia-based early treatment strategy for prevention of cytomegalovirus disease in allogeneic marrow transplant recipients[J]. Blood, 1999,93(5): 1781-1782.
[7] Navarro D, Lennette E, Tugizov S, et al. Humoral immune response to functional regions of human cytomegalovirus glycoprotein B[J]. J Med Virol, 1997, 52(4): 451-459.
[8] Berencsi K, Rando R F, deTaisne C, et al. Murine cytotoxic T cell response specific for human cytomegalovirus glycoprotein B (gB) induced by adenovirus and vaccinia virus recombinants expressing gB[J]. J Gen Virol, 1993, 74(Pt 11): 2507-2512.
[9] Hopkins J I, Fiander A N, Evans A S, et al. Cytotoxic T cell immunity to human cytomegalovirus glycoprotein B[J]. J Med Virol, 1996, 49(2): 124-131.
[10] 洪良庆, 郑克立, 朱兰英, 等. 白细胞中巨细胞病毒抗原检测及在肾移植的临床应用[J]. 中华医学检验杂志, 1998,21(1): 33-35.
[11] Zhang X, Fan J, Yang M F, et al. Monitoring of human cytomegalovirus infection in bone marrow and liver transplant recipients by antigenaemia assay and enzymelinked immunosorbent assay[J]. J Int Med Res, 2009, 37(1):31-36.
[12] Rammensee H, Bachmann J, Emmerich N P, et al.SYFPEITHI: database for MHC ligands and peptide motifs[J]. Immunogenetics, 1999, 50(3-4): 213-219.
[13] Westrop S J, Grageda N, Imami N. Novel approach to recognition of predicted HIV-1 Gag B3501-restricted CD8 T-cell epitopes by HLA-B3501(+) patients: confirmation by quantitative ELISpot analyses and characterisation using multimers[J]. J Immunol Methods, 2009, 341(1-2): 76-85.
[14] Gratama J W, Cornelissen J J. Diagnostic potential of tetramer-based monitoring of cytomegalovirus-specific CD8+T lymphocytes in allogeneic stem cell transplantation[J]. Clin Immunol, 2003, 106(1): 29-35.
[15] Isaacson M K, Compton T. Human cytomegalovirus glycoprotein B is required for virus entry and cell-to-cell spread but not for virion attachment, assembly, or egress[J]. J Virol, 2009, 83(8): 3891-3903.
[16] Navarro D, Paz P, Tugizov S, et al. Glycoprotein B of human cytomegalovirus promotes virion penetration into cells,transmission of infection from cell to cell, and fusion of infected cells[J]. Virology, 1993, 197(1): 143-158.
[17] Fan J, Ma W H, Yang M F, et al. Real-time fluorescent quantitative PCR assay for measuring cytomegalovirus DNA load in patients after haematopoietic stem cell transplantation[J]. Chin Med J(Engl), 2006, 119(10): 871-874.
[18] Chiou S H, Yang Y P, Lin J C, et al. The immediate early 2 protein of human cytomegalovirus (HCMV) mediates the apoptotic control in HCMV retinitis through up-regulation of the cellular FLICE-inhibitory protein expression[J]. J Immunol, 2006, 177(9): 6199-6206.
[19] Britt W J, Mach M. Human cytomegalovirus glycoproteins[J]. Intervirology, 1996, 39(5-6): 401-412.
[20] Sarcinella L, Mazzulli T, Willey B, et al. Cytomegalovirus glycoprotein B genotype does not correlate with outcomes in liver transplant patients[J]. J Clin Virol, 2002, 24(1-2):99-105.
[21] Coaquette A, Bourgeois A, Dirand C, et al. Mixed cytomegalovirus glycoprotein B genotypes in immunocompromised patients[J]. Clin Infect Dis, 2004,39(2): 155-161.
[22] Baldanti F, Lilleri D, Gerna G. Human cytomegalovirus load measurement and its applications for pre-emptive therapy in patients undergoing hematopoietic stem cell transplantation[J]. Hematol Oncol, 2008, 26(3): 123-130.
[23] Caillard S, Moulin B. Transplant patient monitoring[J]. Rev Prat, 2007, 57(3): 299-308.
[24] Waldman W J, Knight D A, Lurain N S, et al. Novel mechanism of inhibition of cytomegalovirus by the experimental immunosuppressive agent leflunomide[J].Transplantation, 1999, 68(6): 814-825.
