游离三碘甲状腺原氨酸(FT3)时间分辨荧光免疫分析试剂盒的研制
2013-11-05王毅何咏婷冯健明刘银河
王毅 何咏婷 冯健明 刘银河
游离三碘甲状腺原氨酸(free triiodothyronine,FT3)是由甲状腺滤泡细胞合成及分泌的激素,具有促进物质与能量代谢,促进机体生长和发育的生物学活性,是甲状腺疾病的重要诊断指标,对某些非甲状腺疾病也有辅助诊断价值。
目前,临床检测FT3的常用方法有酶联免疫分析法(enzyme-linked immunosorbent assay,ELISA)、化学发光免疫测定法(chemiluminescence immunoassay,CLIA)和TRFIA。第一代TRFIA以PerkinElmerTM公司产品为代表,检测FT3采用间接竞争法。即以二抗包被微孔反应板,加入三碘甲状腺原氨酸(triiodothyronine,T3)单克隆抗体的工作液,以DTTA-Eu3+标记的FT3-BSA为示踪物与样本中的FT3竞争结合T3单抗,通过增强液的解离增强作用,检测每孔的荧光值,将其代入标准品制作的标准曲线中计算出血样中的FT3含量。该方法需要分步孵育,最终反应时间达130 min或以上,操作较为复杂。
1 材料与方法
1.1 原料与仪器
抗FT3单克隆抗体及FT3抗原均购于Fitzgerald公司;羧基修饰的T3复合物购自Biodesign公司;96孔微孔反应板(8×12)为深圳金灿华公司的产品;DTTA-Eu3+标记原料购自PerkinElmer公司;SephacryTMS-200为GE Healthcare 产品;FT3质控血清为美国Bio-Rad公司产品。时间分辨荧光免疫检测系统为PerkinElmer 公司的DELFIA®1420。全自动化学发光分析系统为德国SIEMENS公司的ADVIA Centaur®Systems。650份血清样本收自深圳市孙逸仙心血管医院检验科,其中150份异常样本(根据中国甲状腺疾病诊治指南确诊为甲亢或甲减)和500份正常血清样本(根据中国甲状腺疾病诊治指南确诊为甲状腺功能正常),以上样本均是清晨空腹时使用血清分离胶真空采血管或普通促凝干燥管用静脉穿刺法采集静脉血,让其凝结,用离心法分离出血清,并置于-20℃保存。
1.2 试剂盒组分制备
1.2.1 固相包被抗原的制备
用50 mmol/L、pH4.2的磷酸盐缓冲液将包被抗原稀释至 6 μg/mL,然后 200 μL /孔加入(8×12)微孔反应板中,4℃过夜,倾去包被液,加入含有0.5%BSA的封闭液250 μL/孔,37℃下放置2 h后,倾去封闭液,板块向外离心5 min,真空抽干,封热塑膜,2~8℃环境保存。
1.2.2 Eu3+标记抗体的制备与纯化
将1 mg抗FT3单克隆抗体加入Millipore公司带有滤膜的离心管(货号UFC803008,30 KDa)中,10 000 rpm 离心 5~6 min,弃去滤液,往柱中心加入标记缓冲液(50 mmol/L Na2CO3pH 9.4),10 000 rpm 离心5~6 min,弃去滤液,重复上述步骤4次。最后一次将离心管取出,弃掉滤液,将离心柱的滤芯反装入离心管中,往离心柱中加入200 μL标记缓冲液,静置1 min,9 000 rpm离心 5~6 min收集滤液,即为待标记的抗体原料。将0.5 mg的DTTA-Eu3+标记原料加入到1 mg标记抗体中,混匀后4℃静置46±2 h进行标记孵育。标记完成后上样过SephacryTMS-200层析柱(1.6 cm×80 cm)分离纯化,用洗脱液(50 mmol/L 的Tris-HCl)洗脱,同时使用自动部分收集器收集流出液(1 mL/管),逐管测量吸光度(A=280 nm),取峰管中的铕标记物进行混合,以PerkinElmer 公司Eu3+标记试剂盒中的Eu3+为标准,测定混合峰管的Eu3+浓度。所得标记率(Eu3+mol/IgG mol)为10,蛋白质回收率为87%。
1.2.3 参考标准品的制备
用去激素人血清作为标准品稀释液将FT3抗原配制成浓度梯度为 0、1.5、4、8、20、70 pmol/L 的一系列标准溶液,采用国家标准品对配制的校准品进行校准。以0.5 mL/瓶的规格进行分装,冻干,并于-20℃干燥环境中保存。
1.3 操作程序
1.3.1 FT3时间分辨荧光免疫分析试剂盒操作程序
微孔反应板按次序加入25 μL /孔的标准品或待测样本,再加入用分析缓冲液按1:100倍稀释的铕标记抗体工作液200 μL/孔,室温下缓慢振荡(微量振荡器)60 min。洗板6次(用条式洗板),拍干。向每孔中加入增强液200 μL,于室温下缓慢振荡5 min后置于 PerkinElmer公司的DELFIA®1420时间分辨荧光免疫分析检测仪进行检测,在30 min内完成检测。
1.3.2 全自动化学发光分析系统操作程序
按照ADVIA Centaur®Systems要求装载样本及试剂包,系统自动执行检测程序。
2 结果
2.1 剂量-反应曲线
以PerkinElmer公司的DELFIA®1420时间分辨荧光免疫分析检测仪测定荧光值与各参考标准品浓度值,用Log-Logit 进行数学模型拟合,并自动绘制校准曲线。其剂量-反应曲线线性相关系数绝对值为0.9973,如图1所示,表明本试剂盒制备的试剂具有良好的剂量反应线性关系。
2.2 试剂检测灵敏度及线性范围
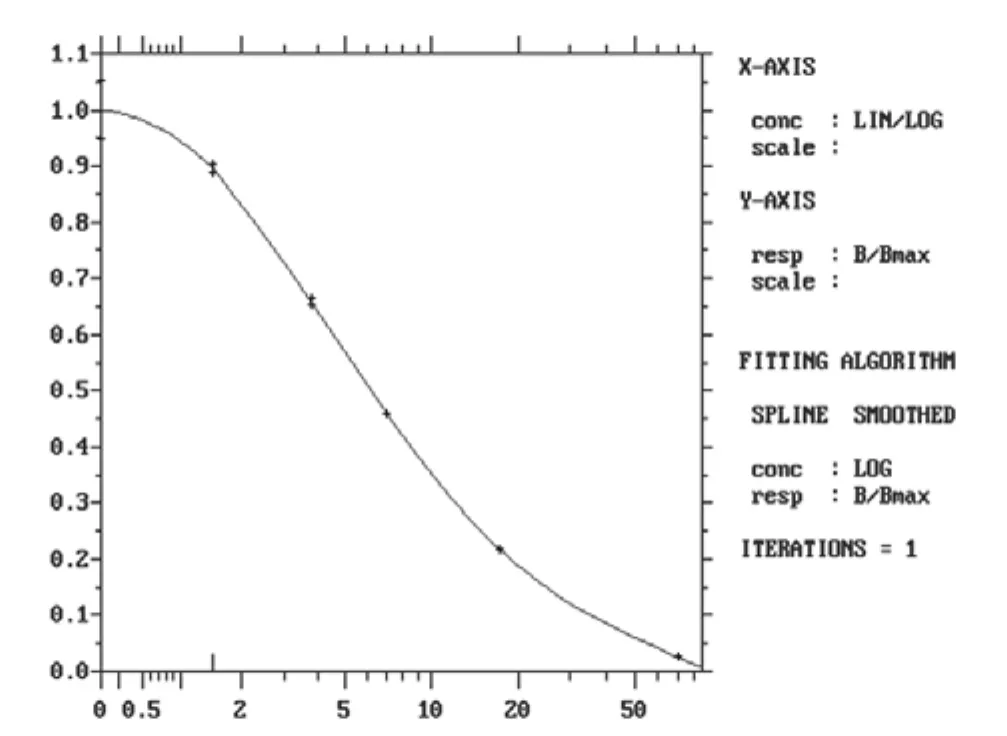
图1 FT3测定试剂盒标准曲线(TRFIA)Figure 1 Standard curve of the FT3 TRFIA kit (TRFIA)
以参考校准品A点(零校准品)作为待测样本做20个复孔,计算其平均荧光值以及标准差。以A点测定荧光值的平均值减去2个标准差所得的荧光值代入标准曲线方程,计算得出的浓度为其灵敏度。本试剂盒灵敏度为0.7 pmol/L,不高于1.5 pmol/L。按照EP6-A要求进行评价,试剂检测线性范围为:1.5~70 pmol/L。
2.3 精密度
通过对Bio-Rad公司FT3三个血清质控品(Q1、Q2、Q3,其说明书靶值浓度分别为 3.8、6.0、12.5 pmol/L)进行10个复孔测定,分3次试验,然后根据数值计算出变异性。其分析内变异系数小于8.2%、分析间变异系数均不高于10.5%和其总变异系数均不高于9.0%,符合试剂盒检定的要求,见表1。
2.4 特异性(交叉反应)
将已知FT3浓度的样本平分成5等分,其中4等分中分别加入T4、FT4 、rT3 和 rT4纯品至表2所示浓度。5份样本在本试剂盒的复孔测定浓度及计算的交叉反应率,符合试剂盒设计要求,见表2。

表2 试剂盒特异性测定Table 2 Determination of specificity of the kit
2.5 测量准确度-回收实验
将FT3样本分成每份1 mL的3等分,向其中2份分别加入11 pmol/L和35.2 pmol/L的FT3标准液各0.1 mL至理论浓度分别为4.7 pmol/L、6.9 pmol/L,作为回收样本;向另一份样本加入0.1 mL无FT3的溶剂,作为本底样本。3份样本在本试剂盒的复孔测定浓度及计算的回收率,实验结果符合试剂盒设计要求,见表3。
2.6 稳定性
取自制同一批次的3盒试剂分别做以下处理,即运输7天、加速降解以及标准品的反复冻融,从实验结果观察,参考标准品的各点荧光值无明显变化,且本底荧光值无明显升高或降低。表明试剂盒参考标准曲线无明显漂移,满足试剂盒稳定性要求。
2.7 正常值参考范围
取已确诊为甲状腺功能正常的500份正常人血清样本,其中男性214例(年龄17~63岁),女性286例(年龄15~69岁)。用本试剂盒检测,统计得出500份正常人血清的均值(x)为4.85 pmol/L,标准差(s)为0.825,根据正常范围确定标准为x±2s,统计确定正常参考范围为:3.2~6.5 pmol/L。各实验室在使用该试剂盒进行FT3浓度测定时,应根据各地区标本的差异设定自己的参考值范围。

表1 精密度测定Table 1 Determination of precision

表3 试剂盒回收率测定Table 3 Determination of recovery rates of the kit
2.8 与化学发光免疫测定法的比较
应用自制TRFIA试剂盒与SIEMENS公司的试剂盒对临床血清样本的FT3浓度进行检测,比较2种试剂盒的检测性能,见表4、5与图2。

图2 自制试剂盒与西门子试剂盒血样测试相关回归分析(相关系数r=0.992,P<0.05)Figure 2 Analysis of correlation between home-made and SIEMES FT3 kit (correlation coefficient r=0.992, P<0.05)
3 讨论
T3是一种控制代谢活动的重要的激素。大约80%的T3与甲状腺结合球蛋白(TBG)结合,其余与甲状腺素结合前体蛋白或血清蛋白结合。约0.3%的T3以游离形式存在。研究表明,只有FT3,才能起到代谢控制活性。T3是评价甲状腺功能的重要临床指标,对甲亢、甲低(尤其是甲亢)等甲状腺疾病的诊断和疗效监测有重要的临床意义。
Potlukova等[1]对桥本甲状腺炎(Hashimoto's thyroiditis,HT)的研究发现,该病患者血清C1q抗体水平与FT3、FT4呈负相关,与TSH呈正相关。
Graves病是一种自身免疫性甲状腺功能紊乱疾病,为在遗传易感人群中免疫调节缺陷所致,从而导致甲状腺刺激性的抗体产生。在美国,1.3%的人群为甲亢(临床的为0.5%,亚临床的为0.7%)[2]。妊娠妇女中,Graves病甲亢的发生率为0.5%~2%,妊娠之前接受治疗或者妊娠期间正在接受治疗Graves病甲亢的怀孕妇女占1%[3]。即使治疗会使甲状腺功能恢复正常,但还是应该对Graves病甲亢患者持续监测甲状腺功能[4]。Graves等T3型甲亢的诊断中,FT3的测定具有重要意义,其诊断标准为T4、FT4正常或偏低,而T3、FT3升高。
Kim等[5]的研究结果显示,在亚临床甲状腺功能减退症患者及甲状腺功能正常人群中,游离甲状腺激素与胰岛素抵抗相关,多项研究表明甲状腺功能减退症、亚临床甲状腺功能减退症及甲状腺功能正常人群甲状腺激素降低胰岛素敏感性,增加胰岛素抵抗[6~7],而胰岛素抵抗可导致血糖升高。另外,有研究证实糖尿病患者甲状腺疾病的发生率显著增高[8]。
甲状腺激素对肾脏的生长发育起促进作用,同时影响肾脏代谢与清除,因此肾脏病变也会导致甲状腺素的显著变化[9],FT3的测定对于一些肾脏疾病起一定的辅助诊断作用。
此外,有研究表明危重患者血清T3、FT3、T4下降幅度与疾病严重程度相关[10]。
在许多临床条件下,如妊娠、病毒性肝炎、遗传性TBG增多症、低蛋白血症、遗传性TBG缺乏症和多种药物(如激素、糖皮质激素、生长激素等)刺激时,载体蛋白的浓度会发生变化,因此即使当甲状腺功能正常时,总T3的浓度也会随着载体蛋白浓度的改变而发生变化[11]。然而FT3浓度不受载体蛋白浓度的影响,因此检测FT3能更客观、更真实地反映机体代谢状况。
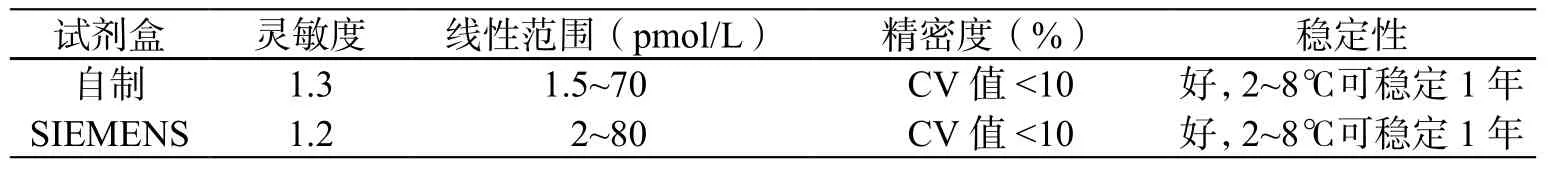
表4 自制试剂盒与SIEMENS化学发光试剂盒的性能比较Table 4 Performance comparison of home-made and SIEMENS CLIA kit

表5 自制试剂盒与西门子化学发光试剂盒的检测效能比较Table 5 Power of test comparison of home-made and SIEMENS CLIA kit
TRFIA是继放射免疫、酶免疫、荧光免疫、化学发光免疫测定之后的新一代标记免疫测定技术,具有灵敏度高、快速、灵活、试剂无放射性污染的特点。本文所研制的FT3测定试剂盒采用了直接竞争法,即T3抗体与示踪物耦联,包被T3大分子结合物,与样本中的FT3竞争结合DTTA-Eu3+标记的T3单克隆抗体,相比第一代TRFIA减少了抗体的加入过程,使测定过程变得简便快捷;较放射免疫分析法试剂和酶联免疫试剂,该试剂标记物没有衰变期和酶的不稳定性,其货架期一般可达到1至1.5年,使运输和贮存更为方便;与国际知名品牌化学发光试剂盒的性能比较显示:灵敏度、批内精密度相仿;自制试剂盒检测线性范围为1.5~70 pmol/L,接近SIEMENS试剂盒的2~80 pmol/L;两者对样品的检测效能呈显著相关性,YTRFIA=1.0404X化学发光-0.1467,r= 0.992,P<0.05;有文献报道,在检测甲状腺功能血清学项目(TSH、FT3、FT4)上TRFIA完全能够替代放射免疫分析法,还具有精密度及灵敏度高,抗干扰能力强,可报告范围宽等优点。TRFIA与CLIA在FT3检测上的灵敏性、准确性基本相当,在临床上可互为补充。相比进口昂贵的FT3试剂和设备,试剂盒和时间分辨免疫分析系统均能实现国产化,价格比进口CLIA FT3测定试剂盒低2~3倍,且采用板式微孔反应板,反应时间为1小时,批检样本数量50份以上就能比CLIA或电化学发光法更节约时间成本,更适合我国国情发展需要。
[1] Potlukova E, Jiskra J, Limanova Z, et al. Autoantibodies against complement Clq correlate with the thyroid function in patients with autoimmune thyroid disease[J]. Clin Exp Immunol, 2008, 153(1): 96-101.
[2] Hollowell J G, Staehling N W, Flanders W D, et al. Serum TSH, T(4), and thyroid antibodies in the United States population (1988 to 1994): National Health and Nutrition Examination Survey (NHANES Ⅲ)[J]. J Clin Endocrinol Metab, 2002, 87(2): 489-499.
[3] Laurberg P, Bournaud C, Karmisholt J, et al. Management of Graves' hyperthyroidism in pregnancy: focus on both maternal and foetal thyroid function, and caution against surgical thyroidectomy in pregnancy[J]. Eur J Endocrinol, 2009,160(1): 1-8.
[4] Umar H, Muallima N, Adam J M, et al. Hashimoto's thyroiditis following Graves's disease[J]. Acta Med Indones, 2010,42(1): 31-45.
[5] Kim B J, Kim T Y, Koh J M, et a1. Relationship between serum free T4 (FT4) levels and metabolic syndrome (MS)and its components in healthy euthyroid subjects[J]. Clin Endocrinol(Oxf), 2009, 70(1): 152-160.
[6] Garduño-Garcial J, Alvirde-Garcia U, López-Carrasco G,et a1. TSH and free thyroxine concentrations are associated with differing metabolic markers in euthyroid subjects[J].Euro J Endocrinol, 2010, 163(2): 273-278.
[7] Lambadiari V, Mitrou P, Maratou E, et a1. Thyroid hormones are positively associated with insulin resistance early in the development of type 2 diabetes[J]. Endocrine, 2011, 39(1):28-32.
[8] Kadiyala R, Peter R, Okosieme O E. Thyroid dysfunction in patients with diabetes: clinical implications and screening strategies[J]. Int J Clin Pract, 2010, 64(8): 1130-1139.
[9] Iglesias P, Díez J J. Thyroid dysfunction and kidney disease[J]. Eur J Endocrinol, 2009, 160(4): 503-515.
[10] Wrede C E. Endocrine regulation in critically ill patients[J].Dtsch Med Wochenschr, 2010, 135(14): 712-715.
[11] 李小平, 何云南, 胡庆武. 甲亢患者测定血清T3、T4、FT3、FT4和sTSH浓度的临床应用探讨[J]. 放射免疫学杂志, 2010, 23(4): 443-444.
