四羧基单核金属酞菁配合物的表征
2013-11-05陶正章高延敏贾宁宁杨志磊
陶正章,高延敏,贾宁宁,杨志磊
(江苏科技大学材料科学与工程学院,江苏 镇江,212003)
与聚合物太阳能电池相比,染料敏化太阳能电池(DSSC)具有容易进行分子设计和合成的优点,是太阳能电池研究的新热点[1-3]。目前染料敏化太阳能电池使用的主要为钌染料[4],其价格昂贵且有毒,因此寻找替代材料成为重要的研究课题。金属酞菁及其衍生物敏化剂具有光稳定性好、在红光及近红外区吸收强、无毒的特性,是最有希望的钌染料替代材料[5-7]。
近年来,酞菁衍生物在光伏领域的应用得到迅速发展,针对其分子设计与合成方面的研究工作也开展较多[8-11]。人们通过分子设计和合成技术扩大了酞菁衍生物的吸光范围,从而提高了其光电转化效率。例如,梁茂等[12]合成的三聚茚基三芳胺染料最大吸收峰出现在538nm,宁波等[13]合成的纳米铜酞菁最大吸收峰出现在604 nm。然而,综合考虑酞菁衍生物光吸收性和热稳定性的研究文献比较少。为此,本研究合成了3种带有四羧基的单核金属酞菁配合物,采用红外光谱、紫外-可见光谱、热重分析等对产物的吸收光谱和热稳定性进行分析比较,以期为金属酞菁衍生物的实际应用提供参考。
1 实验
1.1 酞菁配合物的制备
合成酞菁配合物的反应式如下,其中M分别代表Cu、Zn和Fe。

分别称取偏苯三酸8g、尿素1.5g和氯化锌2.5g,搅拌均匀后,滴加四水合钼酸0.15g,以上原料均为分析纯。将原料倒入烧瓶中,控制油浴温度为150℃,直到整个溶液变为无色透明状。继续升温至230℃,反应4h得到深绿色的固体初级反应产物。用1.0mol/L稀盐酸浸泡8h,过滤并用蒸馏水洗涤,得到酰胺金属酞菁化合物。烘干后用2.0mol/L饱和NaCl的NaOH溶液浸泡并加热沸腾,恒温6h,然后用蒸馏水洗涤抽滤,最后用浓盐酸调节pH值为3左右,得到絮状沉淀,过滤后离心并干燥,即可得到四羧基单核锌酞菁配合物ZnPc(COOH)4。将原料中氯化锌换成氯化亚铁和氯化铜,按上述相同方法分别制备FePc(COOH)4和CuPc(COOH)4。
1.2 酞菁配合物的表征
采用FST2000傅里叶红外光谱仪测定酞菁配合物的红外光谱,KBr压片;带有羧基结构的酞菁配合物易溶于乙醇等有机溶剂,因此采用U-3010紫外可见分光光度计测定酞菁配合物在乙醇溶液中的紫外-可见光谱;采用Diamond TG/DTA综合热分析仪分析酞菁配合物的热稳定性。
2 结果与讨论
2.1 红外光谱分析
图1为3种合成产物的红外光谱。由图1可见,在4个波数区域出现了伸缩振动吸收峰,其中1600cm-1附近的 C==O伸缩振动峰和1400 cm-1附近的C—O吸收峰表明合成物带有羧基结构,1080cm-1附近为酞菁环C—H伸缩振动峰,740cm-1附近为取代苯环振动峰。由以上分析可知,合成产物为具有羧基结构的酞菁配合物。

图1 四羧基单核金属酞菁配合物的红外光谱Fig.1 FTIR spectra of four carboxyl mononuclear metal phthalocyanine complexes
2.2 紫外-可见吸收光谱分析
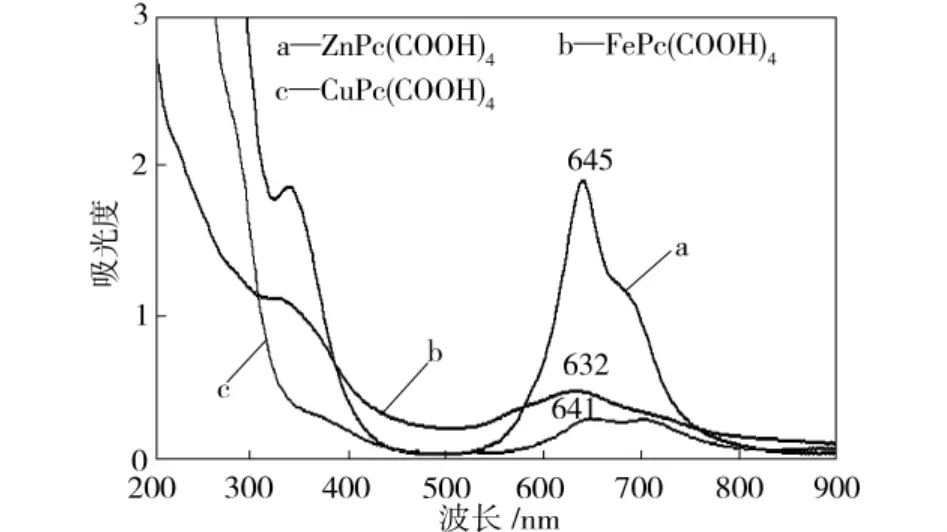
图2 四羧基单核金属酞菁配合物的紫外-可见吸收光谱Fig.2 Ultraviolet-visible absorption spectra of four carboxyl mononuclear metal phthalocyanine complexes
3种金属单核酞菁配合物在乙醇溶液中的紫外-可见吸收光谱如图2所示。由图2可见,所合成的酞菁配合物在200~900nm范围内有两个较强吸收峰,分别为Q带(可见光区600~700 nm范围)和B带(紫外光区300~500nm范围)[12]。吸收峰产生的机理是酞菁环配体环上的π电子跃迁[13],Q带由2a1u→6eg的跃迁引起,B带则由4a2u→6eg的跃迁引起,其分子轨道如图3所示。

图3 金属酞菁分子轨道示意图Fig.3 Molecular orbital schemes of metal phthalocyanine
FePc(COOH)4、CuPc(COOH)4、ZnPc-(COOH)4的紫外-可见吸收光谱对应的最大吸收峰波长分别为632、641、645nm,产生这种差异的原因是:中心金属Fe、Cu、Zn的离子参与了分子轨道的形成过程,导致电子跃迁的2a1u→6eg与4a2u→6eg分子组态能级发生变化,HOMO轨道能级升高程度不一致,因此金属酞菁发生了一定的波长红移。3种金属单核酞菁配合物的最大吸收波长大小顺序为 ZnPc(COOH)4>CuPc-(COOH)4>FePc(COOH)4。另外,本研究合成的酞菁配合物最大吸收波长为645nm,大于文献[12]中三聚茚基三芳胺染料最大吸收波长538 nm和文献[13]中铜酞菁染料最大吸收波长604 nm,相比较而言扩大了光吸收范围,增加了光电转化效率。
2.3 热稳定性分析
金属酞菁配合物在工作时,热量的累积会导致其敏化区域温度急剧上升,因此金属酞菁配合物的热稳定性是决定其能否投入实际应用的关键。3种金属单核酞菁配合物的TG-DTA曲线如图4所示。从图4中可以看出,金属酞菁配合物的热失重一般分为3个阶段:100℃以下为结晶水的脱除过程;340℃左右,酞菁环结构被破坏,挥发物质逸出;700℃左右,酞菁环分解完毕,残留无机物。同时,上述过程伴随着热量变化,3种金属单核酞菁配合物的吸热峰位置也存在差异。
酞菁配合物在300℃附近出现晶型转变,即存在由α构型晶体转化为β构型晶体的相变。一般来说,α构型晶体处于平面结构,对光有较大的吸收量,导致酞菁配合物的光电转化率较高。因此,酞菁配合物中α构型晶体越稳定,其光电性能就越好。当α构型转变成β构型时,酞菁环共轭结构发生破坏。α与β晶型之间存在相平衡,其平衡常数满足式(2):

图4 四羧基单核金属酞菁配合物的的TG-DTA曲线Fig.4 TG-DTA curves of four carboxyl mononuclear metal phthalocyanine complexes
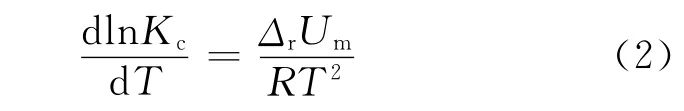
式中:Kc为α晶型向β晶型转变的化学平衡常数;T为温度;R为摩尔气体常数;ΔrUm为等温等压条件下的热力学能量变化。由式(2)可知,ΔrUm/T2越大,则Kc越大,β晶型增多,不利于光吸收。图4中DTA曲线第二个吸热峰的面积反映金属酞菁在此温区吸热量的大小,通过面积计算可知,在等温等压条件下,ΔrUm/T2(Cu)>ΔrUm/T2(Zn)>ΔrUm/T2(Fe),因此 Kc(Fe)最小。这表明在给定的温度条件下,3种金属单核酞菁配合物的热稳定性优劣顺序为FePc-(COOH)4> ZnPc(COOH)4> CuPc(COOH)4。当温度高于这个区域时,酞菁环结构已经被破坏。
3 结论
(1)采用高温熔融法可制备四羧基单核金属酞菁配合物。
(2)3种四羧基单核金属酞菁配合物在紫外-可见光区域的最大吸收波长大小顺序为ZnPc-(COOH)4>CuPc(COOH)4>FePc(COOH)4,其热稳定性优劣顺序为FePc(COOH)4> ZnPc-(COOH)4> CuPc(COOH)4。
(3)本研究合成的酞菁配合物最大吸收波长为645nm,相比较而言扩大了光吸收范围,增加了光电转化效率。
[1]周迪,佘希林,宋国军.金属有机类光敏剂在染料敏化太阳能电池中的应用[J].贵金属,2010,31(1):37-41.
[2]林红,李鑫,刘忆翥,等.太阳能电池发展的新概念和新方向[J].稀有金属材料与工程,2009,38(22):722-725.
[3]Dai S Y,Wang K J,Weng J,et a1.Design of DSC panel with efficiency more than 6%[J].Solar Energy Materials and Solar Cells,2005,85:447-455.
[4]Hou Y J,Xie P H,Zhang B W,et al.Influence of the attaching group and substituted position in the photosensitization behavior of ruthenium polypyridyl complexes[J].Inorg Chem,1999,38:6320-6322.
[5]Nathan M Bamsey,Avery P Yuen,Ah-Mee Hor,et al.Integration of an M-phthalocyanine layer into solution-processed organic photovoltaic cells for improved spectral coverage[J].Solar Energy Materials and Solar Cells,2011,95(7):1970-1973.
[6]Kantekin H,Dilber G,Nas A,et al.Microwaveassisted synthesis and characterization of a new soluble metal-free and metallophthalocyanines peripherally fused to four 18-membered tetrathiadiaza macrocycles[J].Journal of Organometallic Chemistry,2010,695(8):1210-1214.
[7]Zhong Aimin,Zhang Yuexing,Bian Yong.Structures and spectroscopic properties of non-peripherally and peripherally substituted metal-free phthalocyanines[J].J Mol Graphics Modell,2010,29(3):470-474.
[8]Cihan Kantar,Erbil Agar.The microwave-assisted synthesis and characterization of novel polymeric phthalocynines containing resorcinarene[J].Dyes Pigments,2008,77(2):487-490.
[9]Tamer Ezzat Youssef.Efficient green procedures for the preparation of novel tetraalkynyl substituted phthalocyanines[J].Polohedron,2010,29(7):1776-1783.
[10]Shaabani A,Maleki Moghaddam R.Microwave assisted synthesis of metal-free phthalocyanine and metallophthalo-cyalnines[J].Dyes Pigments,2007,74(6):279-280.
[11]Ismail Degirmencioglu,Riza Bayrak,Mustafa Er,et al.The microwave-assisted synthesis and struc-tural characterization of novel,dithia-bridged polymeric phthalocyanines containing a substituted thiophenylamine Schiff base[J].Dyes Pigments,2009,83(1):51-58.
[12]梁茂,王旭达,袁颖,等.2种三聚茚基三芳胺染料的合成及其光伏性能[J].应用化学,2011,28(12):1388-1390.
[13]宁波,姜朋丽,郭增彩,等.纳米铜酞菁及其衍生物的合成与表征[J].东北师大学报:自然科学版,2011,43(4):84-87.
