利用6-磷酸-β-葡萄糖苷酶在低温条件下获得酶-底物复合物实际结构的方法
2013-10-31王薇刘一苇李宏滨
王薇,刘一苇,李宏滨
中国科学院微生物研究所,北京 100101
准确地把握生物大分子及其复合物的结构是了解生命过程的基础,对其三维结构的解析,可给出大量的其本身及所属体系的信息。该工作可大致分成以下4个环节:高纯度大分子样品的制备;晶体的获得;结构的解析;结构信息指导下的生物学研究。在目前的技术条件下,样品晶体的质量是影响其结构解析的主要原因[1-3]。影响生物大分子晶体及其复合物质量的主要原因是分子的化学稳定性及构象一致性较差而得不到稳定的复合物晶体。例如,在通常条件下,当酶与底物发生反应时,底物会被酶降解,所以不易清楚地看到底物和酶的结合情况。突变酶中关键基团使酶失活以及选用底物类似物替代原有底物的的方法,经常被用来捕捉酶和底物的结合,但由此方法获得的结构多为近似结构。另外,在常温条件下酶与底物的结合一般不太稳定,这样底物即便在失活酶中的位置也经常不易确定。
我们在研究中发现[4-7]:在低温 (−20 )℃条件下,分子构象的一致性、分子间结合的稳定性都会大大改善,一般酶的生物活性也会大幅度降低。由此获得的酶-底物复合物更为稳定,得到的晶体结构衍射数据更趋于复合物结合时的实际结构[8-9]。More等的研究也发现[10],当温度由70 ℃降到−20 ℃时,β-葡萄糖苷酶的活性由100%降到 0.01%,也就是说在−20 ℃条件下,该酶基本失活。基于上述考虑,我们提出了“酶晶体低温抑活底物固定”方法。该方法是在低温环境下浸泡底物,此时酶基本失去活性,底物不易降解,而酶和底物结合的稳定性却大大提高,平衡后迅速进行液氮固定,首先,可以获得真实的酶-底物复合物结构;其次,可进一步提高底物的占有率和空间稳定性,提高底物电子密度的质量。
为了进行低温浸泡试验[11],我们选择了 6-磷酸-β-葡萄糖苷酶 (BglA)。根据催化底物分解时是否需要辅因子,BglA分两类:糖基水解酶家族1 (Glycoside hydrolase family 1,GH1)和糖基水解酶家族4 (Glycoside hydrolase family 4,GH4)。GH4的 6-磷酸-β-葡萄糖苷酶在催化底物分解时需要金属离子 (Mn2+、Ni2+、Co2+或Fe2+)和NAD+的辅助,同时需要一个还原性环境[12-15],而GH1的6-磷酸-β-葡萄糖苷酶则可以独立完成催化作用[16-17],其大小约50 kDa。BglA于1972年首次从产气杆菌 Aerobacter aerogenes中被分离得到[18],随后1974年在大肠杆菌Escherichia coli中又再次被纯化出来[19]。BglA能专一性地水解6-磷酸-β-葡萄糖苷键,可将底物对硝基苯-β-D-吡喃葡萄糖苷-6-磷酸 (pNPβG6P)水解为对硝基苯酚和 6-磷酸-β-葡萄糖[20-21]。
1 材料与方法
1.1 材料
bglA基因 (EC31211186)由上海捷瑞生物工程有限公司合成;宿主杆菌主菌株 E. coli DH5α、E. coli BL21 (DE3)和载体 pET-28a由本室保存;SDS-PAGE低分子量标准购自中国科学院上海生物化学研究所;His-TrapTMHP 5 mL购自于美国 GE公司;蛋白晶体筛选试剂 Crystal Screen HR2-110和 HR2-112购自美国 Hampton Research公司;BCA蛋白浓度检测试剂盒购自美国 Pierce公司;底物 pNPβG6P 由美国 National Institutes of Health (NIH)的Dr. John Thompson提供。
1.2 BglA的表达
将构建好的 pET-28a-bglA重组质粒转化E. coli BL21 (DE3),转化成功的单克隆菌株置于20 mL LB 培养基中 (卡那霉素 5 μg/mL),过夜培养后接种于2 L LB摇瓶,37 ℃振荡培养,当OD600达到 0.6~0.8时,加入 IPTG至终浓度0.001 mol/L,37 ℃继续振摇5 h,6 000 r/min离心10 min收集细菌。
1.3 BglA的提取与纯化
收集的细菌用80 mL PBS (pH 7.4)重悬后,超声波破碎裂菌,12 000 r/min离心10 min,收集上清。利用蠕动泵将上清液与His-Trap HP镍柱过夜结合。采用快速蛋白液相色谱法,以缓冲液 A (20 mmol/L Tris-HCl,50 mmol/L NaCl,pH 8.0)和缓冲液 B (20 mmol/L Tris-HCl,50 mmol/L NaCl,500 mmol/L 咪唑,pH 8.0)对结合有蛋白的镍柱进行梯度洗脱,并进行蛋白峰收集及SDS-PAGE检测。收集到的蛋白在超滤浓缩管中置换成分子筛缓冲液 (20 mmol/L Tris-HCl,50 mmol/L NaCl,pH 8.0),经 Superdex 200凝胶层析柱进一步纯化,蛋白峰收集并再次进行SDS-PAGE检测。BCA蛋白浓度测定法测定蛋白浓度。
1.4 蛋白晶体的生长
蛋白晶体的培养采用悬滴式蒸气扩散法,筛选试剂来源于 Crystal Screen HR2-110和HR2-112试剂盒。将1 μL蛋白溶液与1 μL池液混匀,同200 μL的池液进行气相平衡,静置于16 ℃环境生长。
1.5 常温试验
首先,准备晶体板,并制备防冻液。防冻液成分:1 μL 50% (V/V)甘油,2 μL 池液 (0.1 mol/L N-2-羟乙基哌嗪-N'-2-乙磺酸钠盐 (HEPES sodium),pH 7.5,10% (V/V)异丙醇和 20%聚乙二醇4 000 (Polyethylene glycol 4 000)(W/V))。制备好的防冻液放入晶体板。用尼龙环挑取BglA蛋白晶体,放入防冻液中,加入3 μL 20 mmol/L底物 pNPβG6P。用尼龙环挑出蛋白晶体与底物复合物,放入液氮固定。
1.6 低温试验
准备低温晶体板,用水将含有甘油的纸条润湿,再将坐滴孔内加满水,盖上玻璃盖,以保持环境的湿度;制备防冻液,成分为:1 μL 50%(V/V)甘油,2 μL 池液(0.1 mol/L N-2-羟乙基哌嗪-N'-2-乙磺酸钠盐 (HEPES sodium),pH 7.5,10% (V/V)异丙醇和 20%聚乙二醇 4 000(Polyethylene glycol 4 000)(W/V))。制备好的防冻液放入晶体板。之后用尼龙环挑取出BglA蛋白晶体,放入防冻液中,迅速置于−20 ℃低温冰箱中。静置 10 min后,迅速取出蛋白晶体板,快速加入3 μL 20 mmol/L底物pNPβG6P。再次将晶体板放回−20 ℃低温冰箱中。静置10 min后迅速取出晶体板,用尼龙环挑出蛋白晶体与底物复合物,放入液氮固定。
2 结果
2.1 BglA的表达与纯化结果
为了有效地纯化蛋白,在设计 bglA重组序列时,在C末端多加了1段由6个组氨酸构成的His-tag。携带重组质粒 pET-28a-bglA的 E. coli BL21在37 ℃经IPTG诱导后,表达大量可溶性BglA蛋白,分子量大小约50 kDa。
利用组氨酸标签和咪唑的相互作用,通过His-Trap层析柱梯度洗脱,在40 mmol/L咪唑浓度及 60 mmol/L浓度附近获得浓度较高的蛋白(图 1)。收集到的蛋白在超滤浓缩管中置换成分子筛缓冲液,经Superdex 200凝胶层析柱,BglA进一步被纯化 (图 2),随后用BCA法进行蛋白浓度测定,蛋白浓度高达8 mg/mL。
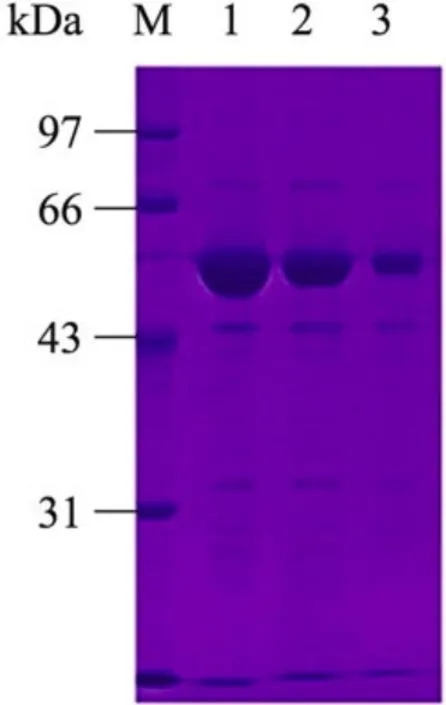
图1 BglA镍柱亲和层析之后电泳结果图Fig. 1 SDS-PAGE analysis of BglA after purified with a His-Trap HP column. M: protein marker. The collected fractions of BglA corresponding to the SDS-PAGE lanes 1,2,3.
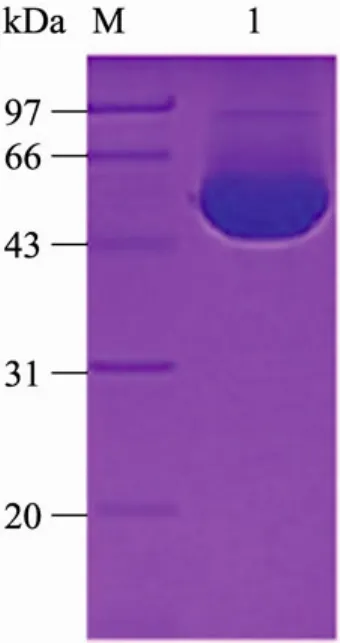
图2 BglA凝胶过滤层析之后电泳结果图Fig. 2 SDS-PAGE analysis of BglA after purified with a Superdex 200 10/300 column. M: protein marker. The collected fraction of BglA corresponding to the SDS-PAGE lane 1.
2.2 晶体生长结果
晶体的生长条件筛选选用Hampton Research的Crystal Screen的HR2-110和HR2-112试剂盒,共98个不同条件的池液,每个池液含有缓冲液,沉淀剂和盐3类成分。观察发现有几个不同的条件均生长出了晶体,其中在池液成分为0.1 mol/L HEPES sodium (pH 7.5)、10% (V/V)2-propanol、20% (W/V)PEG 4 000的生长条件下,经过2周的时间,生长出了能够达到X射线衍射条件的晶体 (图 3)。
2.3 数据收集、处理结果及底物电子密度图
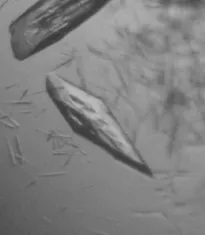
图3 在某一条件下得到的蛋白晶体Fig. 3 Crystals of BglA. The crystals of BglA grown at 16 ℃, and the longest dimension of the crystals is 290 μm.
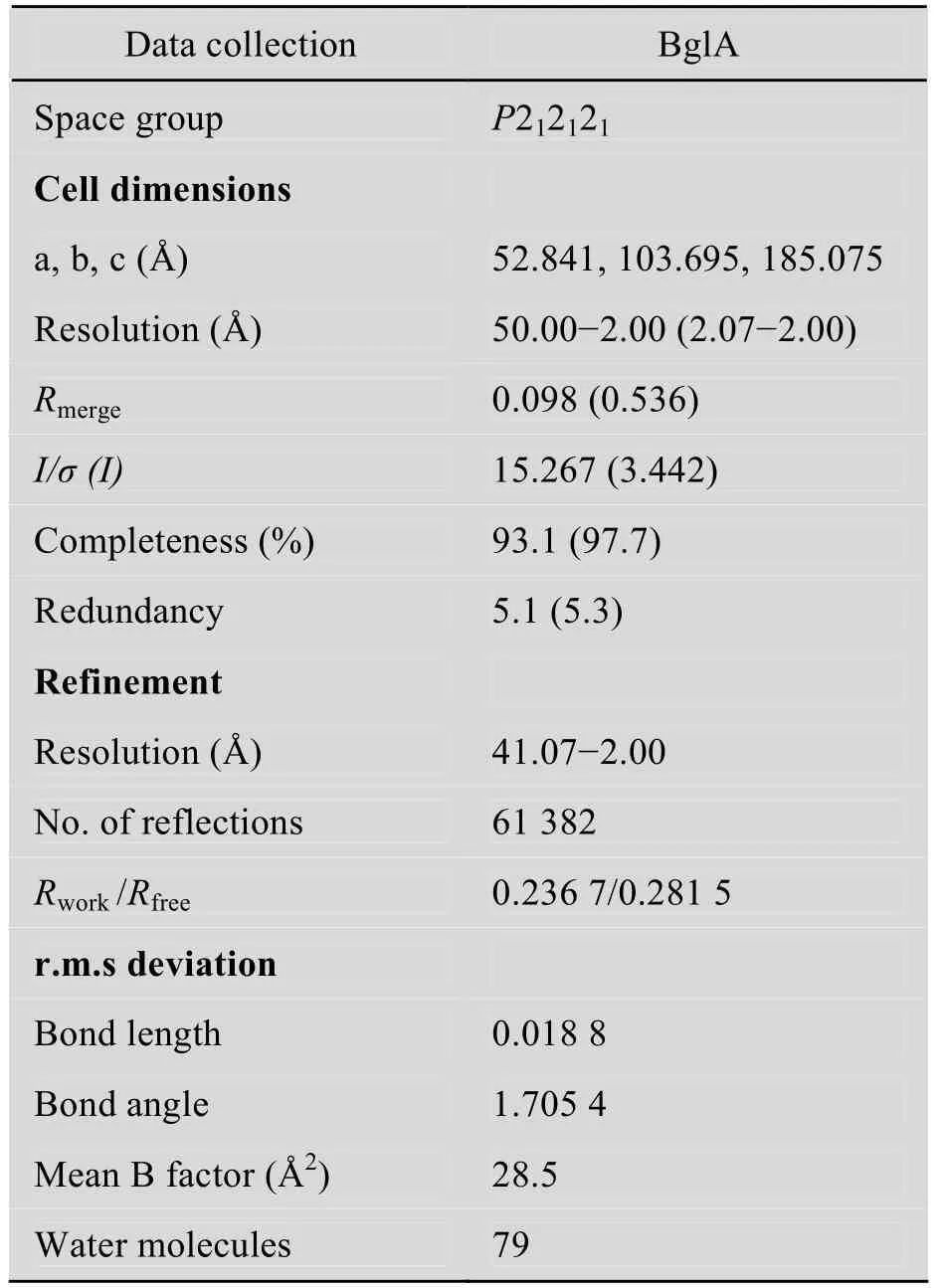
表1 BglA晶体衍射数据Table 1 Data collection and refinement statistics
在−20 ℃的低温条件下,利用“酶晶体低温抑活底物固定”方法,将BglA晶体与底物进行浸泡,并用液氮固定,通过X射线进行衍射数据收集并处理,获得了完整的底物电子密度图。BglA晶体衍射数据的空间群属于P212121,最高分辨率为2 Å,结构采用分子置换法解析。数据收集和优化的统计数据如表1所示。在利用“酶晶体低温抑活底物固定”方法进行低温试验前,我们选用前期生长良好的BglA晶体,使用常规方法,进行了酶与底物浸泡的对比试验。所用晶体的空间群属于I222,晶胞参数为a=69.441 Å,b=86.902 Å,c=161.765 Å,最高分辨率为 2.4 Å,结构采用分子置换法解析。经优化处理后得到了水解底物的电子密度图。通过对比的衍射电子密度图显示,底物pNPβG6P在经低温处理的BglA晶体结构中有完整的电子密度;对于未经低温处理的BglA晶体,底物在相应位置已经被水解(图 4)。
3 讨论
3.1 低温防冻剂配方的选择
在利用“酶晶体低温抑活底物固定”方法进行低温试验时,选用甘油作为主防冻剂,但当用尼龙环挑出单颗晶体放入防冻剂之后,晶体出现了迅速融化的现象。之后,我们对此环节进行改进,尝试放入多颗晶体,以使溶液达到饱和状态。在放入第1颗晶体时,晶体依然很快融化;继续放入第2颗,晶体只是部分开裂;放入第3颗晶体后,该晶体完好。另外,我们也尝试将晶体加入不含甘油的池液,晶体并未开裂或融化,但经过−20 ℃低温处理后,再次观察发现晶体部分开裂,用尼龙环挑晶体时出现了断裂现象,说明此时的晶体脆性增强,防冻剂的保护不可或缺。因此,找到适合各种温度的多体系低温防冻剂配方,使晶体不易开裂并可以承受更深的低温是我们需要进一步解决的问题。
3.2 “酶晶体低温抑活底物固定”方法对底物电子密度的影响
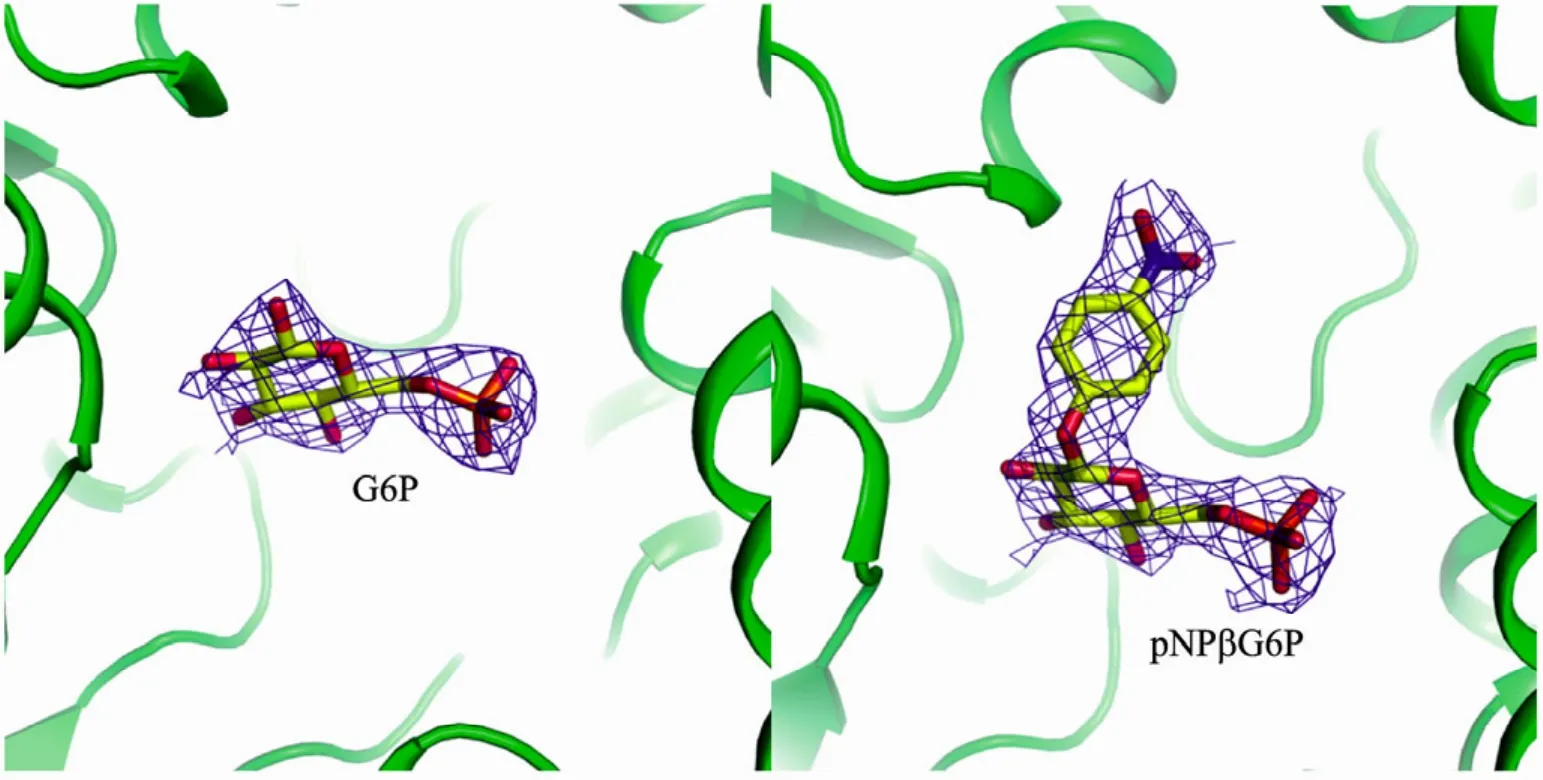
图4 不同条件下获得的底物电子密度图Fig. 4 Comparison between the electron density of bound substrates from two methods. 2Fo-Fc electron density map is contoured at 1.0 σ, the left shows that the substrate was hyzrolyzed at normal temperature, the right shows that the electron-density of the substrate was intact at −20 ℃.
本研究使用的“酶晶体低温抑活底物固定”方法,是在−20 ℃条件下将 BglA晶体与pNPβG6P进行浸泡,通过X射线收集衍射数据并处理,最终获得了完整的底物电子密度图。与常规方法相比较,使用的底物相同,但取得的效果却差别明显。我们认为,用常规方法无法获得完整的底物电子密度,因为一般酶在常规温度下都能够迅速水解底物,而“酶晶体低温抑活底物固定”方法是在保持天然结构的状态下,将酶活力降低到几乎失活的水平,延缓底物的水解。另外在低温状态下,pNPβG6P的 β糖苷键的柔性会降低,使得硝基苯基团的位置更固定,也有利于取得较好的电子密度。
3.3 低温酶学及复合物中间态的进一步研究
为了进一步试验“酶晶体低温抑活底物固定”方法在低温酶学研究领域的普适性,在获得了BglA与其底物复合物的实际结构后,我们还利用本实验室现有的酰亚胺酶 (Imidase)与其特异性底物进行了浸泡试验,获得了比较完整的底物电子密度图。由于复合物晶体的衍射数据低于3 Å,我们正在进行进一步的优化筛选,以期获得优于3 Å的数据结果,进而得到理想的底物电子密度图。另外,我们也正在选择其他的酶与底物进行低温浸泡试验,进一步扩大复合物中间态的研究范围。
3.4 低温条件下的单晶生长
从“酶晶体低温抑活底物固定法”自然派生出的一个思路便是研究深低温条件下生物大分子单晶生长的技术。如前所述,在深低温条件下生物大分子有着更好的化学稳定性和构象一致性,有望得到分辨率更高的晶体。目前,我们已经利用溶菌酶在−20 ℃低温环境下进行晶体生长实验,以不同浓度 DMSO替代甘油作为主防冻剂进行梯度试验,获得了生长良好的晶体,并得到了较高分辨率的衍射数据。
[1]Heras B, Martin JL. Post-crystallization treatments for improving diffraction quality of protein crystals. Acta Crystallogr D Biol Crystallogr, 2005,61(9): 1173−1180.
[2]Abergel C. Spectacular improvement of X-ray diffraction through fast desiccation of protein crystals. Acta Crystallogr D Biol Crystallogr, 2004,60(8): 1413−1416.
[3]Su D, Lou ZY, Sun F, et al. Dodecamer structure of severe acute respiratory syndrome coronavirus nonstructural protein nsp10. J Virol, 2006, 80(16):7902−7908.
[4]Liu Y, Xiong Y, Naidenko OV, et al. The crystal structure of a TL/CD8αα complex at 2.1 Å resolution-implications for modulation of T cell activation and memory. Immunity, 2003, 18:205−215.
[5]Bowman GD, O'Donnell M, Kuriyan J. Structural analysis of a eukaryotic sliding DNA clamp-clamp loader complex. Nature, 2004, 429(6993):724−730.
[6]Mi Y, Wood G, Thoma L. Cryoprotection mechanisms of polyethylene glycols on lactate dehydrogenase during freeze-thawing. AAPS J,2004, 6(3): e22.
[7]Dobrianov I, Kriminski S, Caylor CL, et al.Dynamic response of tetragonal lysozyme crystals to changes in relative humidity: implications for post-growth crystal treatments. Acta Cryst Crystallogr D Biol Crystallogr, 2001, 57(1):61−68.
[8]Kuo A, Bowler MW, Zimmer J, et al. Increasing the diffraction limit and internal order of a membrane protein crystal by dehydration. J Struct Biol, 2003, 141: 97−102.
[9]Ellis MJ, Antonyuk S, Hasnain SS. Resolution improvement from `in situ annealing' of copper nitrite reductase crystals. Acta Cryst Crystallogr D Biol Crystallogr, 58: 456−458.
[10]More N, Daniel RM, Petach HH. The effect of low temperatures on enzyme activity. J Biochem, 1995,305(1): 17−20.
[11]Liu WD. Structural analysis of hydroxyquinol 1,2-dioxygenase from Pseudomonas putida DLL-E4 and crystallographic study on two pesticide degradation related enzymes [D].Nanjing: Nanjing Agricultural University, 2010 (in Chinese).刘卫东. Pseudomonas putida DLL-E4 1,2,4-苯三酚1,2-双加氧酶的晶体结构及两种农药降解相关酶的蛋白质晶体学研究[D]. 南京农业大学,2010.
[12]Raasch C, Streit W, Schanzer J, et al. Thermotoga maritima AglA, an extremely thermostable NAD+-,Mn2+-, and thiol-dependent alpha-glucosidase.Extremophiles, 2000, 4(4): 189−200.
[13]Robrish SA, Fales HM, Gentry-Weeks C, et al.Phosphoenolpyruvate-dependent maltose:phosphotransferase activity in Fusobacterium mortiferum ATCC 25557: specificity,inducibility, and product analysis. J Bacteriol,1994, 176(11): 3250−3256.
[14]Suresh C, Rus'd AA, Kitaoka M, et al. Evidence that the putative alpha-glucosidase of Thermotoga maritima MSB8 is a pNP alpha-D-glucuronopyranoside hydrolyzing alpha-glucuronidase.FEBS Lett, 2002, 517(1/3): 159−162.
[15]Thompson J, Gentry-Weeks CR, Nguyen NY, et al.Purification from Fusobacterium mortiferum ATCC 25557 of a 6-phosphoryl-O-alpha-D-glucopyranosyl: 6-phosphoglucohydrolase that hydrolyzes maltose 6-phosphate and related phospho-alpha-D-glucosides. J Bacteriol, 1995,177(9): 2505−2512.
[16]Thompson J, Robrish SA, Bouma CL, et al.Phospho-beta-glucosidase from Fusobacterium mortiferum : purification, cloning, and inactivation by 6-phosphoglucono-delta-lactone. J Bacteriol,1997, 179(5): 1636−1645.
[17]Thompson J, Ruvinov SB, Freedberg DI, et al.Cellobiose-6-phosphate hydrolase (CelF)of Escherichia coli : characterization and assignment to the unusual family 4 of glycosylhydrolases. J Bacteriol, 1999, 181(23): 7339−7345.
[18]Palmer RE, Anderson RL. Cellobiose metabolism in Aerobacter aerogenes 3. Cleavage of cellobiose monophosphate by a phospho-β-glucosidase. J Biol Chem, 1972, 247(11): 3420−3423.
[19]Wilson G, Fox CF. The beta-glucoside system of Escherichia coli IV. Purification and properties of phospho-beta-glucosidases A and B. J Biol Chem,1974, 249(17): 5586−5598.
[20]Yin J, Liu YW, Li J, et al. Cloning, expression,crystallization and characterization of a novel 6-phospho-β-glucosidase from Thermoanaerobacter tengcongensis. Chin J Biochem Mol Biol, 2008,24(10): 916−924 (in Chinese).尹捷, 刘一苇, 李洁, 等. 腾冲嗜热厌氧杆菌 6-磷酸-β-葡萄糖苷酶的表达与结晶及其功能鉴定.生物化学与分子生物学报, 2008, 24(10): 916−924.
[21]Totir M, Echols N, Nanao M, et al. Macro-to-micro structural proteomics: native source proteins for high-throughput crystallization. PLoS ONE, 2012,7(2): e32498.
