Alg-g-PEI/pVEGF复合物体内促血管生成作用
2013-10-31黄忠辉滕伟陈盈王琴梅
黄忠辉,滕伟,陈盈,王琴梅
1 中山大学附属第一医院卫生部辅助循环重点实验室,广东 广州 510080
2 中山大学附属光华口腔医院,广东 广州 510080
血管新生是指在已有血管结构基础上,形成新血管网的生物过程。血管新生的机理比较复杂,诸多促进新生的因素中包括血管内皮生长因子 (VEGF)和碱性成纤维细胞生长因子(Basic fibroblast growth factor, bFGF)等的调控作用[1]。通过基因治疗的方法来调控 VEGF和bFGF的水平,具有作用特异性强、不良反应轻等优点[2-3],在临床上有重大的研究和应用意义。
然而,目前的基因治疗研究多集中于提高报告基因体外转染癌细胞的效率[4-6],对治疗基因进行体内实验的研究较少。我们已证实氧化海藻酸接枝低分子量聚乙烯亚胺 (Alginategraft-PEI,Alg-g-PEI)(图 1)能在体外介导VEGF质粒 (pVEGF)转入大鼠骨髓间充质干细胞 (Rat mesenchymal stem cells, rMSCs),表达出有效治疗剂量的VEGF,同时表现出较低的细胞毒性。在此基础上,本研究通过模拟体内条件验证 Alg-g-PEI能否有效保护 DNA,并以鸡胚和斑马鱼为动物模型,进一步探索Alg-g-PEI/pVEGF复合物在体内促进血管新生的作用,为该载体下一步的大动物实验及未来的临床应用提供理论和实践依据。
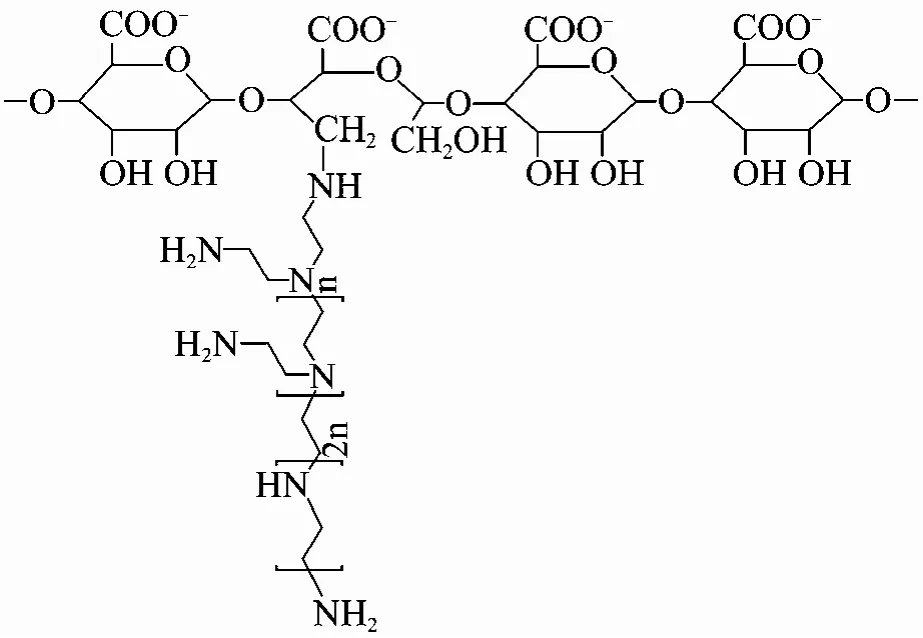
图1 Alg-g-PEI的化学结构[7]Fig. 1 Chemical structure of Alg-g-PEI[7].
1 材料与方法
1.1 材料
Alg-g-PEI:本实验室自制,分子量17 000 Da,氮含量 23.3%;血管内皮生长因子真核表达质粒 (pVEGF)受赠于广东省人民医院;胎牛血清购自Hyclone公司;Alamar Blue购自广州国奥生物有限公司;5日龄受精种蛋购自华南农业大学畜牧研究所;甲基纤维素 (Methyl cellulose,MC, 188042)购自 Sigma公司;血管荧光转基因斑马鱼 (Flk-1)由中山大学附属第一医院神经内科实验室惠赠;斑马鱼培养液 (Holtbuffer)的配方(1 L):NaCl 3.5 g;KCl 0.05 g;NaHCO30.025 g;CaCl20.1 g,加入双蒸水充分溶解。
凝胶电泳仪 (电泳仪DYY-6C型);凝胶图像分析仪 (GAS7001X,UVITEC);鸡胚孵化箱(型号HH.B11.260-TBS,上海跃进医疗器械厂);体视显微镜 (Nikon AZ100)。
1.2 方法
1.2.1 复合物的制备
将pVEGF稀释至40 ng/µL,根据所需N/P配制不同浓度的Alg-g-PEI或PEI 25K水溶液,pVEGF与Alg-g-PEI或PEI 25K等体积混合后涡旋 3~5 s,室温静置 30 min,自组装形成Alg-g-PEI/pVEGF复合物,立即使用。
1.2.2 细胞毒性检测
常规分离、培养大鼠骨髓间充质干细胞(rMSCs)[8]。在有血清 (10%)条件下,使用Alamar Blue法[9-10]测定 N/P分别为 60、90、110的Alg-g-PEI/pVEGF复合物对rMSCs的毒性,复合物在培养基中所占体积分数为10%。以PEI 25K/pVEGF (N/P=10)为阳性对照,无复合物干预的细胞存活率为100%对结果进行标准化,计算细胞存活率 (n=3)。
1.2.3 Alg-g-PEI/pVEGF复合物耐肝素置换能力
制备浓度分别为 10、12、16、18、20、50 mg/mL的肝素水溶液各10 μL,分别加入10 µL Alg-g-PEI与pVEGF质粒DNA形成的复合物 (Alg-g-PEI/pVEGF, N/P=60)溶液,共孵育15 min或2 h 后,取样行凝胶电泳分析[7]。
1.2.4 Alg-g-PEI/pVEGF复合物耐 DNaseⅠ酶降解作用
取8 µL Alg-g-PEI与pVEGF质粒DNA形成的复合物 (Alg-g-PEI/pVEGF,N/P=60)溶液,与2 μL 1 U DNaseⅠ或PBS混合,37 ℃孵育0.25、0.5、2、4、8、12、24 h (加 PBS 的孔仅孵育 6 h)后,加入 5 μL 100 mmol/L EDTA,37 ℃孵育10 min使DNase I酶失活,再加入10 μL 12 mg/mL肝素溶液,室温孵育 2 h使pVEGF和 Alg-g-PEI充分解离,取样进行凝胶电泳分析,以未经酶处理的裸pVEGF、DNase I处理的裸pVEGF为对照。
1.2.5 Alg-g-PEI/pVEGF复合物耐血清能力
取10 µL Alg-g-PEI与pVEGF质粒DNA形成的复合物 (Alg-g-PEI/pVEGF,N/P=60、90、110)溶液,分别与等体积新鲜血清 (50%)混合,37 ℃孵育3、6、12、24、48 h后,加入10 µL 12 mg/mL肝素溶液,室温孵育2 h后,取样进行凝胶电泳分析,以裸、血清同样处理的裸pVEGF、未加血清但同样孵育处理的复合物为对照。
1.2.6 Alg-g-PEI/pVEGF复合物促进 CAM 血管生成作用
配制5%的甲基纤维素 (MC)水溶液,高压蒸汽灭菌后,将 160 µL 溶液分 4次 (50、50、30、30 µL)加入 96 孔板中,每次加完后在 (60±3)℃的烘箱中烘1 h,最后从96孔板中小心挑出MC膜,置于紫外灯下照射30 min灭菌,备用。
参考贺国安等[11]的方法培养鸡胚种蛋,在(38±0.5)℃、湿度40%~70%的孵化箱中孵育到第 7天,选择发育正常的鸡胚开窗。将鸡胚随机分为9组: PEI 25K/pVEGF (N/P=10)阳性对照组、生理盐水空白对照组、N/P=90的空载体对照组、0.4 µg的裸 pVEGF对照组,Alg-g-PEI/pVEGF (N/P=90)中分别含 0.4、0.8、1.2、1.6、2.4 µg DNA的实验组。鸡胚开窗揭去气室膜暴露CAM,将MC膜置于CAM 中央血管稀少区,再将 50 µL样品溶液分别用移液枪滴加到 MC膜里,用无菌的透明胶带封贴气室端。继续常规孵育72 h后,于膜表面加入3~5 mL冰冷的固定液 (甲醇和丙酮等体积混合)固定30 min,用眼科剪小心剪下整块血管膜,在盛有固定液的培养皿中小心摊开,使膜平贴于培养皿表面,置于体视显微镜下观察和拍照。照片使用image-pro plus 6.0分析软件进行处理[12],以加样位置为中心建立一个20×20 cm2的固定选区,对选区内的血管面积进行计算,最后计算血管面积和CAM选区面积的比值 (VA/CAM)[13]。
1.2.7 复合物对斑马鱼的毒性及促血管生成作用
按标准方法养殖和繁殖斑马鱼[14-15],将健康成熟的斑马鱼按雌雄 1/2的比例放入交配鱼缸中,次日搜集受精鱼卵。
将健康的新生受精鱼卵置于24孔板中,每孔30个,加入1 mL Holtbuffer。24 h后更换新鲜培养基,再分别加入N/P为45、60、90、110的Alg-g-PEI/pVEGF复合物水溶液100 µL,以PEI 25K/pVEGF (N/P=10)为阳性对照,未处理的受精鱼卵为空白对照。共孵育一定时间后,评价其毒性和促血管生成作用。
毒性实验:对复合物干预后的斑马鱼观察96 h (隔6 h一次),记录死亡例数和时间。使用Graphpad Prism 5.0对数据进行统计分析,作Kaplan-Meier生长曲线,与阳性对照组比较,记录P值。
促血管生成实验:在72 h后 (干预后48 h)将斑马鱼用 10%多聚甲醛固定后,置于体视显微镜下观察肠下血管新生情况,拍照后使用NIH Image 图像处理软件对肠下血管面积和长度进行定量分析[16-17]。
1.2.8 结果处理
如无特别说明,所有结果均取 3次实验平均值,应用 SPSS 17.0 统计软件包进行数据处理,实验数据以均数±标准差 (x±s)表示,组间比较采用t检验,**P<0.01和*P<0.05为差异有统计学意义。
2 结果
2.1 细胞毒性检测
Alg-g-PEI/pVEGF复合物水溶液在有血清条件下对rMSCs毒性很低 (图 2),细胞存活率均在80%以上;当N/P=60、90时,Alg-g-PEI/pVEGF复合物与细胞接触4 h后基本无毒性,48 h后细胞存活率仍然高于 80%,分别为(84.61±3.15)%和 (82.62±1.97)%,大于阳性对照组 (26.03±4.06)%(**P<0.01);当 N/P=110时,随着孵育时间的增加细胞存活率下降,但48 h后存活率仍保持 (72.39±2.84)%,而阳性对照组的细胞存活率一直低于50%。
2.2 Alg-g-PEI对pVEGF的保护作用
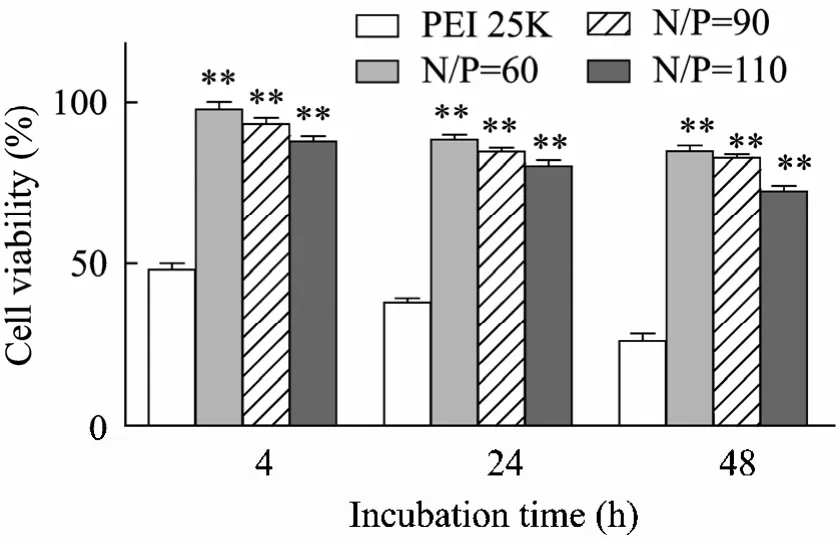
图2 rMSCs和聚合物/pVEGF复合物在有血清 (10%)条件下共孵育后的细胞存活率 (与 PEI 25K 组相比**P<0.01)Fig. 2 Cell viability of rMSCs after incubation with polymer/pVEGF complexes in 10% serum. **P<0.01 vs PEI 25K group.
肝素竞争置换实验结果表明,肝素浓度为12 mg/mL时,孵育 15 min能够置换出部分pVEGF,孵育2 h后能完全置换出pVEGF (图3A)。而10 mg/mL的肝素孵育2 h后仍不能完全置换出pVEGF。复合物耐DNase I酶解实验显示,裸VEGF与酶接触0.5 h后已完全降解,而Alg-g-PEI和pVEGF复合后,当酶解时间小于 4 h时,肝素置换出的 DNA条带与未处理pVEGF条带的亮度接近;酶解时间大于4 h,部分pVEGF被酶解,置换后的条带亮度下降,条带不清晰 (图3B)。在耐血清实验中,裸pVEGF和血清共孵育3 h后部分被降解,6 h后完全降解 (图 3C,泳道 2)。相比之下,有 Alg-g-PEI保护的pVEGF能够在48 h内免受血清的降解,肝素置换pVEGF后,电泳条带的亮度、形状与裸DNA接近,48 h后N/P=110、90的复合物仍能很好地保护ppVEGF (图 3C)。
2.3 Alg-g-PEI/pVEGF复合物促进 CAM 血管生成作用
如图 4所示,在显微镜下可观察到实验组血管 (图 4C)比空白对照组(图 4A)和阳性对照组 (图4B)多,表现为分支增多,血管密度和直径增大。空白组的血管保持正常CAM的叶脉状自然生长,血管整体分布均匀。阳性对照组的血管较实验组的稀疏,但比空白组密。定量计算结果 (表1)表明,实验组VA/CAM为44.4%,明显高于阳性对照组 (35.9%)和空白对照组(24.03%)(**P<0.01),且具有剂量依赖性。
2.4 复合物对斑马鱼的毒性及促血管生成作用
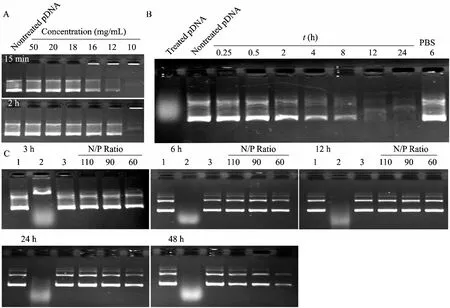
图3 Alg-g-PEI/pDNA在不同溶液中孵育一定时间后对pDNA的保护能力 (A为耐肝素竞争置换,B为耐DNaseⅠ酶解,C为耐血清降解:1、2、3泳道分别是裸pVEGF、pVEGF和50%血清共孵育、Alg-g-PEI/pVEGF和PBS共孵育)Fig. 3 Protection of Alg-g-PEI to pVEGF against pVEGF heparin (HEP)(A), DNase I (B)and serum (50%)(C).1: naked pVEGF; 2: pVEGF incubated with serum (50%); 3: Alg-g-PEI/pVEGF incubated with PBS.
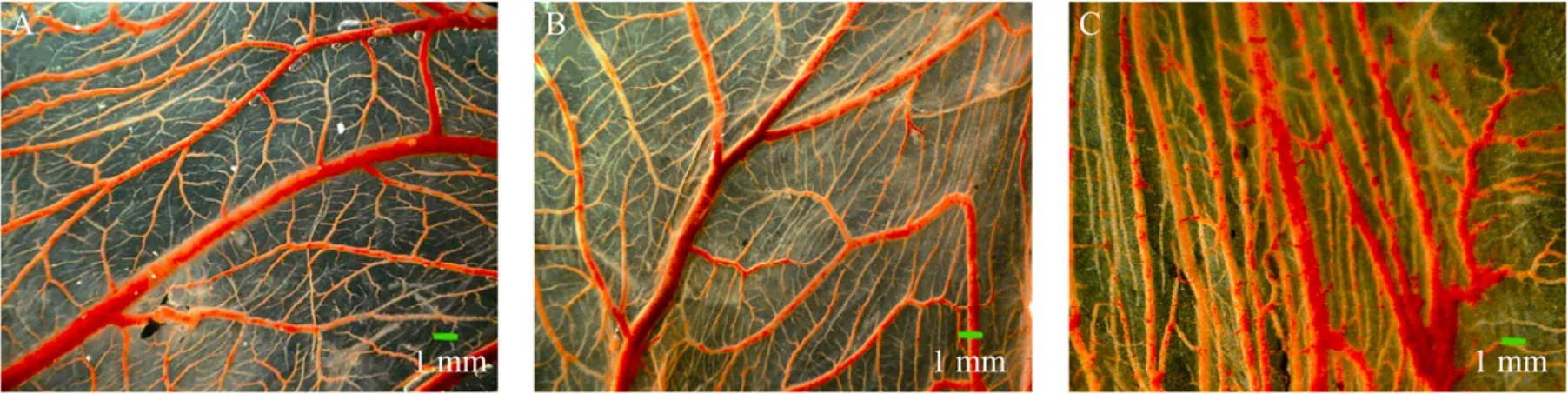
图4 Alginate-Graft-PEI/pVEGF复合物对CAM血管新生的影响 (A为空白对照组,B为PEI 25K组(N/P=10,DNA含量为2.4 µg),C为Alg-g-PEI/pVEGF复合物组 (N/P=90,DNA含量为2.4 µg))Fig. 4 Effect of Alginate-Graft-PEI/pVEGF on angiogenesis of chick embryo chorioallantoic membrane. (A)Blank group. (B)CAM treated by PEI 25K containing 2.4 µg DNA (N/P=10). (C)CAM treated by Alg-g-PEI/pVEGF complexes containing 2.4 µg DNA (N/P=90).
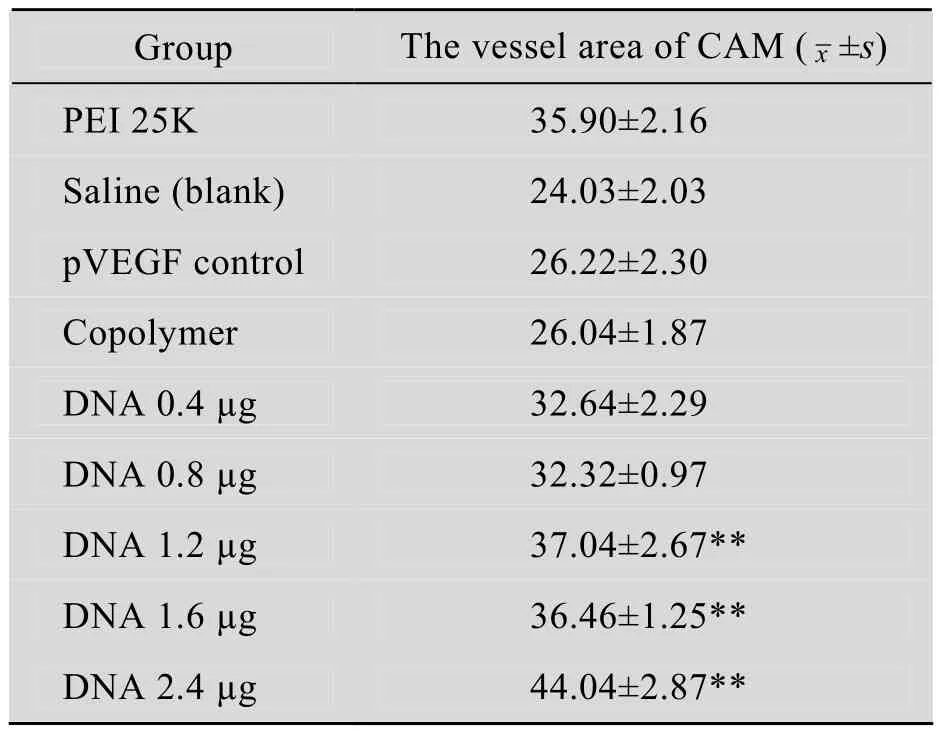
表1 不同样品处理后的CAM血管面积 (VA/CAM,x±s)Table 1 Vessel area in CAM treate by different samples (VA/CAM,x±s)
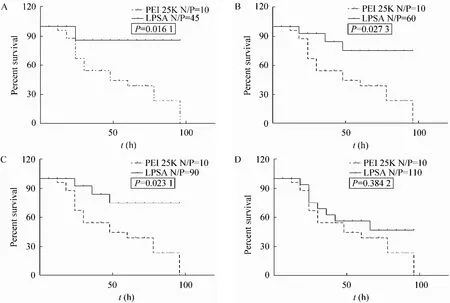
图5 不同氮磷比Alg-g-PEI/pVEGF复合物与斑马鱼胚胎共培养的Kaplan-Meier生长曲线Fig. 5 Kaplan-Meier survival curves of zebrafish embryos after incubation with Alg-g-PEI/pVEGF complexes at various N/P ratios. P-value vs PEI/pVEGF at N/P=10.
如图 5所示,在所研究范围内,Alg-g-PEI/pVEGF对斑马鱼受精卵基本无毒性。当 N/P<110,斑马鱼生存曲线平稳,96 h 后斑马鱼的生存率均在 75%以上,毒性明显低于 PEI 25K/pVEGF (N/P=10),且差异显著。而N/P=110时,毒性较大,96 h后的生存百分率低于60%(图5D)。在促斑马鱼血管生成实验中,在显微镜下可观察到 Alg-g-PEI组 (图 6C~F)血管分支明显多于空白对照组 (图6A)和PEI 25K对照组 (图6B),且肠下血管整体较长、血管面积较大。Alg-g-PEI组和PEI组均见钉突样血管新生现象 (图 6箭头处),空白组血管保持正常生长,整体分布均匀 (图 6A)。对肠下血管面积和血管整体长度进行计算后作图 (图 6G,H),发现Alg-g-PEI组与空白对照组和阳性对照组相比较均有显著性差异 (**P<0.01,*P<0.05),当N/P=110时,血管总长度和面积分别为1.11 mm和 1.70×103像素;N/P=90时,为 1.01 mm 和1.65×103像素;均明显大于 PEI 25K 对照组(0.82 mm、1.11×103像素)(**P<0.01)。
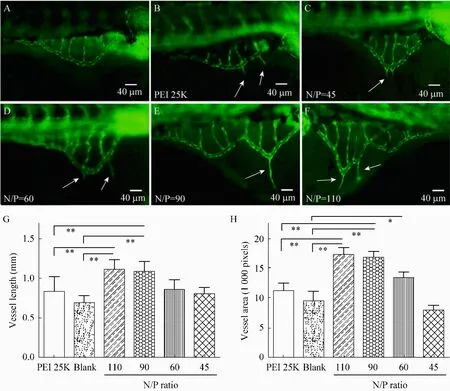
图6 不同氮磷比Alg-g-PEI/pVEGF复合物对斑马鱼血管生成作用的定性 (C~F)与定量 (G,H)分析 (A、B分别为空白对照组和PEI 25K/pVEGF (N/P=10)阳性对照组,白色箭头处为钉突样血管,**P<0.01,*P<0.05)Fig. 6 Effects of Alg-g-PEI/pVEGF on the angiogenesis of zebrafish embryos at various N/P ratios (C–F). (A)Nontreated zebrafish. (B)Zebrafish treated with PEI 25K/pVEGF (N/P=10). Quantization of length and area of subintestinal vessels (G, H)in zebrafish embryos. White arrows are vessels assembling spikes. **P<0.01; *P<0.05.
3 讨论
基因载体是基因治疗中不可缺少的一部分,病毒载体因为不易大批量生产、DNA装载量少、安全性不高等原因并没有得到广泛的临床应用[18]。鉴于基因治疗的无限潜能,人们将注意力转到阳离子非病毒载体,但与病毒载体相比,阳离子聚合物转染效率较低,因此如何提高转染效率并降低毒性成为急需解决的问题。本课题组用低分子量的 PEI 1.8K和可降解的氧化海藻酸钠接枝,合成出 Alg-g-PEI,体外转染实验表明它对不同细胞均有较高转染效率和较低的细胞毒性[7]。为了探索Alg-g-PEI在体内条件下是否依然具备低毒性和高转染能力,本研究模拟体内条件,先考察了 Alg-g-PEI/pVEGF复合物对rMSCs的毒性,结果显示复合物在有血清条件下对 rMSCs基本无毒性 (图 2)。当 N/P<110时,复合物与rMSCs孵育48 h后,细胞仍然具有较高存活率 (大于 80%),明显高于 PEI 25K (**P<0.01),初步证明Alg-g-PEI在体内有血清条件下转染的安全性。体内转染时,阴离子多糖对 pDNA的竞争置换及体内血清中非特异性酶、内切酶等对外源DNA的降解是转染的主要障碍,因此体内转染要求载体/pDNA复合物具有稳定性,能够有效保护pDNA在传递过程中以及到达靶细胞之后免遭核酸酶等的降解[19-20]。本研究以VEGF质粒作为实验DNA,通过耐肝素阴离子置换、耐 DNaseⅠ酶和血清实验考查Alg-g-PEI对 DNA的保护作用,结果表明,pVEGF与Alg-g-PEI复合后,肝素 (12 mg/mL)需要2 h完全置换pVEGF (图3A);DNaseⅠ酶需要24 h完全降解p pVEGF (图3B);血清则在48 h内仍不能完全降解pVEGF (图3C),而无保护的pVEGF在0.5 h就已被DNase I酶解完全;6 h被血清降解完全。说明Alg-g-PEI/pVEGF对pVEGF具有较好保护作用,预示了 Alg-g-PEI体内转染的可行性。
本研究选择 CAM 模型作为体内转染促进血管生成的模型,主要因为CAM操作性强、可信度高、实验结果易于观察、指标明确、结果易于定量,适合促血管生成药物高通量初筛[21-22]。我们选择7 d的鸡胚进行开窗加样,是因为CAM血管网络在这个时期形成的速度比较稳定,鸡胚生命力旺盛,CAM 血管发育稳定[23];鸡胚早期免疫系统发育不全,对所加测试药物无强烈排斥反应[21],对实验结果影响较小。选择MC膜作为载药模具,是因其质地光滑、质量轻、生物相容性好、48 h左右降解消失,与滤纸片、琼脂糖片及塑料盖玻片相比较,具有较大优势[24-25]。
在前期研究中,我们先固定pVEGF用量为1.2 µg,考察不同N/P比复合物对CAM血管生成的促进作用,结果发现N/P=90时,复合物具有最佳促进血管生成作用,然后固定N/P=90,观察血管生成的pVEGF剂量的依赖性。结果发现当pVEGF用量为2.4 µg/CAM时,促血管生成作用最明显,VA/CAM为44.4%,高于阳性对照组 (35.9%)和空白对照组 (24.03%)。说明 Alg-g-PEI在体内环境下能够成功将目的基因导入到细胞里,并表达出能够促进局部血管生成的蛋白量,且蛋白量可通过剂量调控。
为进一步验证 Alg-g-PEI/pVEGF在体内的安全性和有效性,我们考察了 Alg-g-PEI对Flk-1斑马鱼胚胎的毒性和血管新生的促进作用。与大鼠等模型相比,斑马鱼具有与人类在血管发育过程中的基因及信号通路有高度同源性、成本低适合高通量筛选、易于观察、指标容易定量等特点,被广泛应用于血管发生机制研究及促血管新生相关药物的筛选[26]。斑马鱼的Kaplan-Meier生存曲线结果 (图 5)显示,当N/P=45、60、90,Alg-g-PEI/pVEGF几乎不影响斑马鱼的存活与发育,斑马鱼生存百分率 75%以上,与PEI 25K/pVEGF对照组相比*P<0.05,说明体内应用时Alg-g-PEI/pVEGF具有低毒性。
因斑马鱼肠下血管由血管新生形成,且易操作、易定量,我们通过定性观察和定量计算斑马鱼肠下血管长度、面积来探讨Alg-g-PEI/pVEGF复合物对斑马鱼血管新生的促进作用。一般斑马鱼肠下血管呈篮子形状,从体节的腹部边缘往卵黄方向延伸,横向长约 50~100 µm[27]。本研究发现,Alg-g-PEI/pVEGF有效地促进了斑马鱼肠下血管新生,主要表现在:肠下血管网在体节方向延长超过150 µm;血管网整体面积增大;血管的直径增大、分支增多;血管篮子底部有钉突样血管生成 (图 6箭头处)。这说明VEGF得到了有效表达,斑马鱼实验再一次证明了 Alg-g-PEI/pVEGF具有较低的毒性,并且能促进体内血管生成。
总之,本研究通过系列实验证明了Alg-g-PEI与pVEGF复合后对rMSCs和斑马鱼都具有较低的毒性,且能有效保护 pDNA。Alg-g-PEI能介导 pVEGF在组织细胞内表达出治疗量的VEGF,促进血管生成。预示Alg-g-PEI作为一种基因载体具有较好的应用前景和开发潜力,我们将进一步研究Alg-g-PEI的转染机制以及在大动物体内促血管生成的量效、时效关系,为将来的临床应用提供更加充分的理论和实践依据。
[1]Xie Q, Tang N, Wan R, et al. Recombinant snake venom cystatin inhibits tumor angiogenesis in vitro and in vivo associated with downregulation of VEGF-A165, Flt-1 and bFGF. Anticancer Agents Med Chem, 2013, 13(4): 663−671.
[2]Gong Y, Koh DR. Neutrophils promote inflammatory angiogenesis via release of preformed VEGF in an in vivo corneal model. Cell Tissue Res, 2010, 339(2): 437−448.
[3]Claes F, Vandevelde W, Moons L, et al. Another angiogenesis-independent role for VEGF:SDF1-dependent cardiac repair via cardiac stem cells. Cardiovasc Res, 2011, 91(3): 369−370.
[4]Brzoska AJ, Firth N. Two-plasmid vector system for independently controlled expression of green and red fluorescent fusion proteins in Staphylococcus aureus. Appl Environ Microbiol,2013, 79(9): 3133−3136.
[5]Dierselhuis MP, Schrama E, Scott DW, et al. Gene therapy with IgG-HY fusion proteins to reduce male-specific T-cell reactivity in vitro. Hum Gene Ther, 2011, 22(1): 44−54.
[6]Gomez E, Perez-Pascual D, Fernandez L, et al.Construction and validation of a GFP-based vector for promoter expression analysis in the fish pathogen Flavobacterium psychrophilum. Gene,2012, 497(2): 263−268.
[7]He W, Guo Z, Wen Y, et al. Alginate-graft-PEI as a gene delivery vector with high efficiency and low cytotoxicity. J Biomater Sci Polym Ed, 2012,23(1/4): 315−331.
[8]Tan Q, Huang ZD, Wang LF. Study on isolation and culture of rat bone marrow mesenchymal stem cells. J Tradit Chin Med Univ Hunan, 2011, 31(7):74–76 (in Chinese).谭琦, 黄政德, 王立凤. 大鼠骨髓间充质干细胞分离和培养方法的研究. 湖南中医药大学学报,2011, 31(7): 74−76.
[9]Rampersad SN. Multiple applications of Alamar Blue as an indicator of metabolic function and cellular health in cell viability bioassays. Sensors(Basel), 2012, 12(9): 12347−12360.
[10]Schoonen WG, Stevenson JC, Westerink WM, et al. Cytotoxic effects of 109 reference compounds on rat H4IIE and human HepG2 hepatocytes. III:Mechanistic assays on oxygen consumption with MitoXpress and NAD(P)H production with Alamar Blue. Toxicol In Vitro, 2012, 26(3):511−525.
[11]He GA, Luo JX, Zhang TY, et al. Improved chick chorioallantoic membrane technique—incubation without air chamber. Acta Sci Nat Univ Sunyatseni, 2003, 42(2): 126–128 (in Chinese).贺国安, 罗进贤, 张添元, 等. 改进的鸡胚绒毛尿囊膜技术——无气室孵育法. 中山大学学报自然科学版, 2003, 42(2): 126−128.
[12]Xu Y, Zhao YK, Bi MG, et al. Quantitation of angiogenesis in chick chorioallantoic membrane using Image-Pro Plus software. Chin J Compar Med, 2007, 17(12): 745–747 (in Chinese).许扬, 赵英凯, 毕明刚, 等. Image-Pro Plus图像分析软件定量鸡胚尿囊膜血管新生面积的方法.中国比较医学杂志, 2007, 17(12): 745−747.
[13]Reizis A, Hammel I, Ar A. Regional and developmental variations of blood vessel morphometry in the chick embryo chorioallantoic membrane. J Exp Biol, 2005, 208(Pt13):2483−2488.
[14]Akimenko MA, Johnson SL, Westerfield M, et al.Differential induction of four msx homeobox genes during fin development and regeneration in zebrafish. Development, 1995, 121(2): 347−357.
[15]Westerfield M, Doerry E, Kirkpatrick AE, et al.An on-line database for zebrafish development and genetics research. Semin Cell Dev Biol, 1997,8(5): 477−488.
[16]Amin MR, Kurosaki M, Watanabe T, et al. A comparative study of MIB-1 staining indices of gliomas measured by NIH Image analysis program and conventional manual cell counting method.Neurol Res, 2000, 22(5): 495−500.
[17]Schneider CA, Rasband WS, Eliceiri KW. NIH Image to ImageJ: 25 years of image analysis. Nat Methods, 2012, 9(7): 671−675.
[18]Thomas CE, Ehrhardt A, Kay MA. Progress and problems with the use of viral vectors for gene therapy. Nat Rev Genet, 2003, 4(5): 346−358.
[19]Bacalocostantis I, Mane VP, Goodley AS, et al.Investigating polymer thiolation in gene delivery.J Biomater Sci Polym Ed, 2013, 24(8): 912−926.
[20]Tian H, Chen J, Chen X. Nanoparticles for gene delivery. Small, 2013, 9(12): 2034−2044.
[21]Ribatti D. The chick embryo chorioallantoic membrane in the study of tumor angiogenesis.Rom J Morphol Embryol, 2008, 49(2): 131−135.
[22]Tufan AC, Satiroglu-Tufan NL. The chick embryo chorioallantoic membrane as a model system for the study of tumor angiogenesis, invasion and development of anti-angiogenic agents. Curr Cancer Drug Targets, 2005, 5(4): 249−266.
[23]Ayalasomayajula SP, Ashton P, Kompella UB.Fluocinolone inhibits VEGF expression via glucocorticoid receptor in human retinal pigment epithelial (ARPE-19)cells and TNF-alpha-induced angiogenesis in chick chorioallantoic membrane(CAM). J Ocul Pharmacol Ther, 2009, 25(2):97−103.
[24]Richardson M, Singh G. Observations on the use of the avian chorioallantoic membrane (CAM)model in investigations into angiogenesis. Curr Drug Targets Cardiovasc Haematol Disord, 2003,3(2): 155−185.
[25]Wilting J, Christ B, Bokeloh M, et al. In vivo effects of vascular endothelial growth factor on the chicken chorioallantoic membrane. Cell Tissue Res, 1993, 274(1): 163−172.
[26]Jin S, Sarkar KS, Jin YN, et al. An in vivo zebrafish screen identifies organophosphate antidotes with diverse mechanisms of action. J Biomol Screen, 2013, 18(1): 108−115.
[27]Serbedzija GN, Flynn E, Willett CE. Zebrafish angiogenesis: a new model for drug screening.Angiogenesis, 1999, 3(4): 353−359.
