谷氨酸棒状杆菌的谷氨酸分泌模式初探
2013-10-30姚辉张建华毛忠贵
姚辉,张建华,毛忠贵
1(江南大学工业生物技术教育部重点实验室,江苏 无锡,214122)
2(江南大学生物工程学院,江苏 无锡,214122)
1957 年Kinoshita 等发现并分离了谷氨酸棒杆菌(Corynebacterium glutamicum),开启了微生物发酵法生产谷氨酸的新时代[1]。有研究表明,谷氨酸棒杆菌在正常生长条件下不分泌谷氨酸,只有通过下面4种措施才能诱导谷氨酸分泌:(1)生物素亚适量[2-3];(2)添加表面活性剂[4];(3)添加青霉素[5];(4)利用甘油或油酸营养缺陷型菌株发酵[6-7]。虽然研究人员对于如何诱导谷氨酸分泌已有较清楚的认识,但是对于谷氨酸分泌的机理却一直没有定论。
关于谷氨酸的分泌目前有以下3 种假定模式:“泄漏”模式[2]、“载体功能逆转”模式[8]及“特殊载体系统”模式[9-10]。这3 种假定模式是从细胞膜的组成、载体蛋白等方面研究谷氨酸的分泌。目前,与“泄漏”模式相关的生物素“亚适量”发酵法是生产谷氨酸的主要发酵方法,该方法通过生物素的浓度控制菌体的生长与谷氨酸的分泌。生物素是生物细胞必需微量营养因子,它的8 种同分异构体中只有D-(+)-生物素具有生物活性,生物素主要是作为某些酶的辅酶,如乙酰-CoA 羧化酶、丙酮酸羧化酶、丙酰-CoA 羧化酶、β-甲基巴豆酰-CoA 羧化酶等,这些酶可以催化羧基的脱落、转移和固定;此外生物素还参与碳水化合物、脂肪、蛋白质和核酸的代谢,并且还对基因的表达产生影响。
自然界中的生物素大都以游离状态存在,但也有部分通过戊酸支链和蛋白质中赖氨酸的ε-氨基共价结合的方式存在[11]。生物素检测主要有微生物法、生物法、仪器分析法和亲和分析法等方法[12]。微生物法检测限较高,但特异性不强并且繁琐耗时;生物法只能检测生物能够利用的生物素;仪器分析法简单、快速,但不能区分生物素和生物素的代谢类似物;亲和分析法精确性高、检测限低、省时,并可对复杂的样品进行有效分析[11]。由于谷氨酸发酵液中生物素极微量,约5 ~10 μg/L[13],对检测限要求极高,且会受到发酵液中蛋白质、色素等成分的干扰,导致直接测定发酵液中生物素浓度的难度较大。糖蜜、玉米浆中所含生物素在发酵过程中是等量分配到每个细胞的[14],因此作者通过控制其添加量来调节初始生物素含量,同时测定培养过程中的菌体干重,计算单位干重菌体占有生物素的量,以此来间接表示发酵过程中生物素的浓度,称之为名义生物素浓度,单位是μg/g DCW。本文通过研究发酵过程中名义生物素浓度对胞内外谷氨酸浓度变化,探讨生物素对谷氨酸棒杆菌分泌谷氨酸的影响机制以及触发谷氨酸分泌的生物素“亚适量”域值,探求其对生产的指导意义。
1 实验材料与方法
1.1 实验材料
1.1.1 菌种
谷氨酸棒杆菌Corynebacterium glutamicumS9114,江南大学发酵与生态工学实验室保藏,-40℃保藏于石蜡管中。
1.1.2 培养基
保藏培养基(g/L):牛肉膏10,蛋白胨10,NaCl 5,琼脂20,pH 7.0 ~7.2。
活化培养基(g/L):葡萄糖1,牛肉膏10,蛋白胨10,酵母膏5,NaCl 5,琼脂20,pH 7.0 ~7.2。
种子培养基(g/L):葡萄糖50,糖蜜15,玉米浆50,H3PO40.64,K2HPO43.2,MgSO40.4,pH 7.0 ~7.2。葡萄糖、糖蜜、玉米浆根据实验需要有所变动。
发酵培养基(g/L):葡萄糖160,糖蜜1.5,玉米浆6,Na2HPO41,KCl 2.2,MgSO41。
生物素测定培养基(g/L):分析纯葡萄糖145,MgSO40.65,K2HPO41.6,KCl 0.3,FeSO4、MnSO4各0.002,pH 7.0。
1.2 实验方法
1.2.1 生物素测定方法
微生物法[15]。
1.2.2 胞内谷氨酸测定方法
于2mL 离心管中依次加入21%高氯酸溶液300 μL,硅油500 μL(相对密度1.07;KF-54;Shin-etsu Chemical Industry Co. Ltd. ,Tokyo),发酵液500 μL,离心(64 000 ×g,5 min,4℃),含有菌体的高氯酸层经超声破碎、中和后测定胞内的谷氨酸[16]。细胞质容积约为1.6 μL/mg DCW[10]。
1.2.3 菌体培养
将一新鲜斜面洗入2L 种子培养基中,33℃,pH 7.0,转速按照溶氧要求自动调节,培养至葡萄糖耗尽。
1.3 检测方法
谷氨酸、葡萄糖采用SBA-40D 生物传感分析仪测定,吸光度采用721 可见分光光度计测定。
2 实验结果
2.1 生物素测定
采用微生物法测定了糖蜜、玉米浆中生物素的含量,其标准曲线如图1,实验得到糖蜜和玉米浆生物素添加回收率分别为102.4%、118.7%。经生物素添加回收率实验校正,糖蜜中生物素含量为2 561 ±148 μg/kg,玉米浆中生物素含量为652 ±24 μg/kg。发酵过程中的菌体干重通过绘制菌体吸光度与菌体干重标准曲线来测定,标准曲线如图2,从R2=0.985可以看出菌体干重和菌体吸光度有着良好的线性关系。
2.2 生物素浓度对C. glutamicum S9114 培养的影响
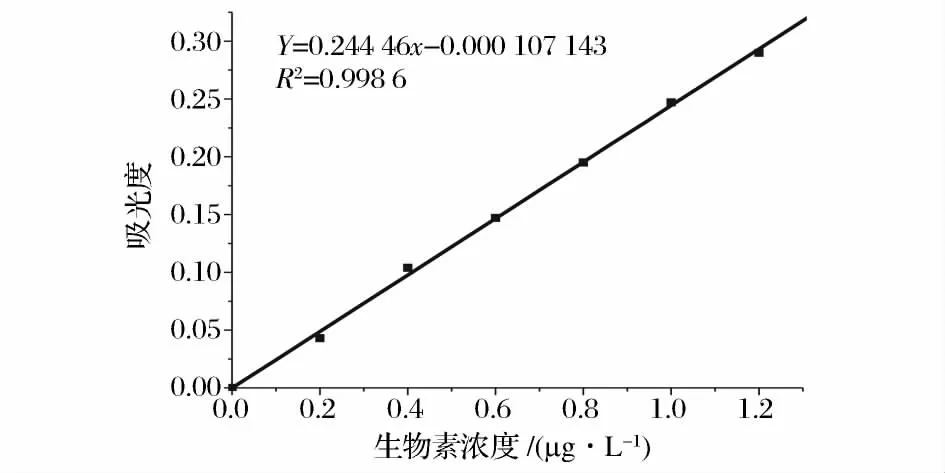
图1 生物素标准曲线Fig.1 Biotin standard curve
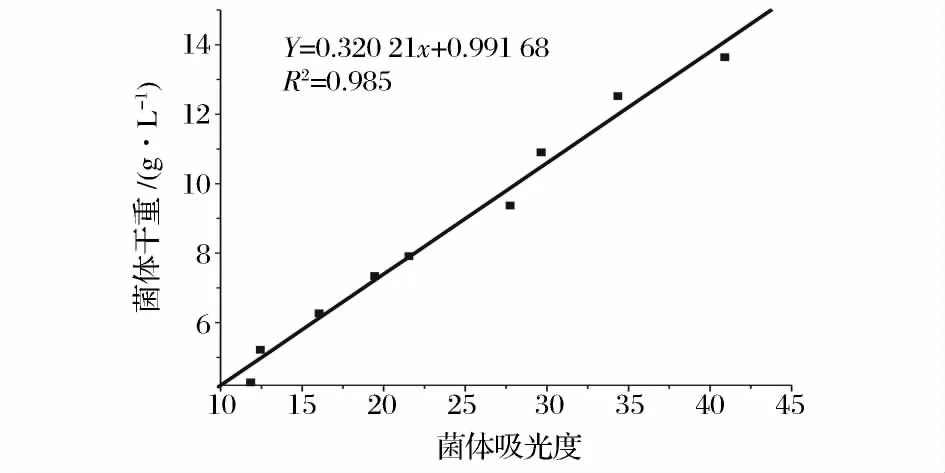
图2 菌体干重标准曲线Fig.2 Dry cell weight standard curve
研究中发现,谷氨酸棒状杆菌在种子培养阶段就开始在胞内合成谷氨酸。通过控制发酵培养基中糖蜜和玉米浆的添加量,使初始生物素浓度分别为20、46、69 μg/L,发酵通过流加氨水调节pH,直至葡萄糖消耗完全时结束发酵。实验考察了初始生物素浓度对胞内谷氨酸、胞外谷氨酸、生物素及菌体吸光度进行监测,结果见图3。
图3a、b、c 表明,菌体生长与生物素密切相关,初始生物素浓度越高,菌体生长越快,且最终菌体量也越高。
胞内谷氨酸浓度变化趋势为,在培养初始阶段胞内谷氨酸浓度很低,大概0 ~4 g/L。之后逐渐升高,在第12 h 左右达到最高点35 ~60 g/L(图3a:60 g/L、b:49 g/L、c:35 g/L)。初始生物素浓度越高,胞内谷氨酸浓度峰值就越低。之后胞内谷氨酸浓度开始逐渐下降,这是由于胞内谷氨酸开始向胞外分泌所致,最后胞内谷氨酸浓度维持在某一稳定水平20 ~40 g/L(图3a:40 g/L、b:20 g/L、c:23 g/L)。
亚适量法谷氨酸正常发酵中,最后产量通常120 g/L 左右,但胞内谷氨酸最高浓度大约在60 g/L 左右,胞外谷氨酸浓度远高于胞内谷氨酸浓度,显然“泄漏”模式不能解释谷氨酸的分泌。
初始生物素水平不会影响谷氨酸开始分泌的时间,检测到胞外谷氨酸时胞内谷氨酸约为32 ~47g/L(图3a:47g/L、b:42g/L、c:32g/L),对应的名义生物素浓度约为2.0 ~2.29 μg/g DCW(图3a:1.97 μg/g DCW、b:2.03 μg/g DCW、c:2.29 μg/g DCW)。可知,检测到胞外谷氨酸时的对应的名义生物素浓度集中在某一范围内,推测谷氨酸的分泌很可能是由生物素控制。

图3 初始生物素浓度对C. glutamicum S9114 培养的影响Fig.3 The effect of initial biotin concentration on C. glutamicum S9114
2.3 生物素“名义亚适量”浓度
控制起始生物素浓度在16 ~69 μg/L,共进行6 批次发酵试验,根据胞内、胞外谷氨酸浓度变化,统计得到的生物素“名义亚适量”浓度如表1 所示。所以谷氨酸发酵中触发谷氨酸分泌的“名义生物素亚适量”浓度范围在1.97 ~2.29 μg/g DCW。

表1 不同初始生物素水平下生物素“名义亚适量”浓度Table 1 The“nominal biotin-limitation”concentration under different initial biotin concentration
2.4 添加生物素对谷氨酸分泌的影响
为了验证生物素在谷氨酸分泌中所起的作用,进行了在正常发酵产生谷氨酸的条件下添加生物素实验,结果见图4。

图4 添加生物素对谷氨酸分泌的影响“→”添加生物素时间Fig.4 The effect of supplement biotin on glutamic acid secretion
图4 中,起始生物素浓度约为16 μg/L,可以看出,在0 ~8 h 的发酵过程中,发酵结果正常,胞内谷氨酸初始浓度39 g/L,这时胞内谷氨酸并未向外分泌,但由于谷氨酸的合成使得胞内谷氨酸浓度略有升高,之后由于胞内谷氨酸向胞外分泌,使胞内谷氨酸浓度下降并维持在36 g/L 左右。在第4h 时检测到胞外谷氨酸,此时胞内谷氨酸浓度35 g/L,对应的生物素浓度1.99 μg/g DCW,与2.3 中所述生物素亚适量范围一致。在第8h时再次添加20 μg/L 生物素,使发酵液中生物素浓度由1.04 μg/g DCW 瞬间上升到2.34μg/g DCW。添加生物素后胞外谷氨酸便不再增加,一直维持在11 ~12 g/L,但胞内谷氨酸逐渐从36g/L 上升到61 g/L,并且菌体进入到第2 个对数生长期,这一实验现象再次表明,生物素是控制谷氨酸分泌的关键因素,当生物素浓度在亚适量范围内时胞内谷氨酸才会向胞外分泌。
3 讨论
谷氨酸的分泌机理到目前为止还不是很清楚,本文研究了生物素对胞内、胞外谷氨酸及对谷氨酸分泌等几方面的影响,从而达到对谷氨酸分泌模式进行初探的目的。
在2.2 不同生物素水平实验中,测得胞内谷氨酸浓度范围在0 ~60 g/L,而在正常的谷氨酸发酵后期谷氨酸浓度通常在120 g/L,胞外谷氨酸浓度远高于胞内谷氨酸浓度,如果谷氨酸的分泌是“泄漏”模式,那么此时谷氨酸应从胞外向胞内泄漏,但这明显与事实不符。所以,“泄漏”模式不能解释谷氨酸的分泌。并且在实验中,检测到胞外谷氨酸时的名义生物素浓度集中在1.97~2.29 μg/g DCW,推测谷氨酸的分泌很可能是由生物素控制的。
经统计得到“名义生物素亚适量”浓度范围在1.97~2.29 μg/g DCW,且在2.4 的实验中测得谷氨酸分泌时的名义生物素浓度为1.99 μg/g DCW,在“名义生物素亚适量”浓度范围内。之后向发酵液中添加生物素,使瞬时名义生物素浓度升高至2.34 μg/g DCW,高于“名义生物素亚适量”浓度范围,此时谷氨酸的分泌停止。这直接证明了谷氨酸分泌受生物素浓度控制。所以本文提出谷氨酸分泌的一个新的假定模式:“生物素浓度触发式分泌”模式,即在亚适量法谷氨酸发酵中,当生物素丰富时,谷氨酸不向胞外分泌;而当生物素“亚适量”时,胞内的谷氨酸开始向胞外分泌,如图5。

图5 谷氨酸分泌模式图Fig.5 Glutamic acid secretion mode
4 结论
(1)“泄漏”模式不能解释谷氨酸的分泌。在谷氨酸正常发酵后期胞外谷氨酸浓度通常为120 g/L,而胞内谷氨酸浓度最高为60 g/L 左右,胞内谷氨酸浓度远远低于胞外谷氨酸浓度,此时胞内谷氨酸不能向外泄漏。
(2)生物素“亚适量”是触发谷氨酸分泌的关键因素。本文通过生物素添加实验直接证明生物素的浓度可以控制谷氨酸的分泌,并测得“名义生物素亚适量”浓度范围在1.97 ~2.29 μg/g DCW。
(3)谷氨酸发酵培养基中的生物素初始含量会随糖蜜和玉米浆来源、批次的不同出现波动,进而影响谷氨酸发酵性能和稳定性。通过实验,发现谷氨酸棒状杆菌生物素“名义亚适量”的范围通常在1.97 ~2.29 μg/g DCW,并且在谷氨酸正常发酵中菌体量是稳定在某一范围内。只要测定不同来源、批次的糖蜜和玉米浆中生物素的含量,然后根据发酵液中菌体量和生物素“名义亚适量”范围,折合成初始糖蜜、玉米浆添加量,这样可以较方便地控制谷氨酸发酵。
[1] Kinoshita S,Udaka S,Shimono M.Studies on the amino acid fermentation Part I.Production ofL-glutamic acid by various microorganisms[J]. Journal of General Microbiology,2004,50(6):331 -43.
[2] Shiio I,Otsuka S,Takahashi M.Effect of biotin on the bacterial formation of glutamic acid I.Glutamate formation and cellular permeability of amino acids [J]. J Biochem,1962,51(1):56 -62.
[3] Clement Y,Laneelle G.Glutamate excretion mechanism inCorynebacterium glutamicum:triggering by biotin starvation or by surfactant addition[J]. Journal of General Microbiology,1986,132(4):925 -929.
[4] Takinami K,Yoshii H,Tsuri H,et al.Biochemical effects of fatty acid and its derivatives onL-glutamic acid fermentation.Part III .Biotin-Tween 60 relationship in the accumulation ofL-glutamic acid and the growth ofBrevibacterium lactofermentum[J]. Agric Biol Chem,1965,29(1):351 -359.
[5] Nara T,Samejima H,Kinoshita S.Effect of penicillin on amino acid fermentation [J]. Agric Biol Chem,1964,28(1):120 -124.
[6] Nakao Y,Kikuchi M,Suzuki M,et al.Microbial production of glutamic acid by glycerol auxotrophs.I.Induction of glycerol auxotrophs and production ofL-glutamic acid from nparaffins[J]. Agricultural Biology and Chemistry,1972,36(3):490 -496.
[7] Kitano K,Sugiyama Y,Kanzaki T.L-Glutamate fermentation with acetic acid by an oleic requiring mutant.II.Inhibitory factors against the extracellular accumulation ofL-glutamate[J]. Journal of Fermentation,Technology 1972,50(4):182 -191.
[8] Clement Y,Escoffier B,Trombe MC,et al.Is glutamate excreted by its uptake system inCorynebacterium glutamicumA working hypothesis[J]. Journal of General Microbiology,1984,130(10):2 589 -2 594.
[9] Christian H,Reinhard K.Evidence for an efflux carrier system involved in the secretion of glutamate byCorynebacterium glutamicum[J]. Arch Microbiology,1989,151(4):342 -347.
[10] Marcella G,Christian H,Reilhard K.Carrier-mediated glutamate secretion byCorynebacterium glutamicumunder biotin limitation [J]. Biochimica et Biophysica Acta,1992,1112(1):115 -123.
[11] John O N,Dionyssis S I,Gregory P E.Analytical techniques for determining biotin[J]. Journal of Chromatography A,2000,881(1):331 -343.
[12] Yuo-Sheng Chang,Chwen-Huey Wu,Re-Jiin Chang. Determination of biotin concentration by a competitive enzyme-linked immunosorbent assay (ELISA)method[J].1994,29(3):321 -329.
[13] 张立德. 谈谈谷氨酸发酵[J]. 发酵科技通讯,2000,29(3):14 -16.
[14] 邱立友. 生物素亚适量辨析[J]. 发酵科技通讯,1997,26(1):17 -18.
[15] 刁立兰. 谷氨酸发酵中生物素含量的测定及控制[D]. 青岛:山东轻工业学院,2008:1 -71.
[16] Ayaaki Ishizaki,Koh Yamamoto,Yoshifumi Furuta.A new method for the accurate and rapid determination of the concentrations of intracellular metabolites in cells during fermentation[J]. Biotechnology Techniques,1995,9(6):409 -412.
