大肠杆菌O157:H7 的免疫捕获PCR 快速检测
2013-10-30陈艳朱小清方水琴郭慧琴刘箐
陈艳,朱小清,方水琴,郭慧琴,刘箐
1(上海理工大学医疗器械与食品学院,上海,200093)
2(上海慧耘生物科技有限公司,上海,200437)
由肠出血性大肠埃希菌O157:H7 引起的肠道感染性疾病已经成为全球关注的公共卫生问题。大肠杆菌O157:H7 感染能引起出血性结肠炎(HC),阑尾炎和结肠穿孔等严重胃肠道并发症[1],严重的可引起血栓性血小板紫癜(TTP)和溶血性尿路综合症(HUS)等全身性并发症,其中3% ~5%的HUS 病人死亡,约有12% 的HU S 病人有严重的后遗症[2]。而且人的感染剂量极低,摄入50 ~100 个活菌就可引起发病[3]。
目前肠出血性大肠埃希菌O157:H7 的常用检测方法包括传统平板分离培养和生理生化鉴别法、ELISA 法、PCR 法、荧光定量PCR 法等[4-6]。生化方法耗时耗力,而且容易漏检自然变异株。血清学方法抗体依赖国外进口检测成本太高,且O157:H7 抗血清与很多细菌有交叉凝集现象[4]。本实验将抗原抗体反应高特异性和PCR 反应高敏感性结合起来,首先免疫富集细菌,之后直接进行PCR 扩增,省略了核酸提取过程,所有反应在同一PCR 管里进行,操作简便,大大提高了检测灵敏度和准确性,同时降低了检测成本,是一种非常实用的肠出血性大肠杆菌O157:H7 快速检测技术。
1 材料与方法
1.1 实验材料
1.1.1 菌株
大肠杆菌O157:H7 ATCC 82346、金黄色葡萄球菌ATCC 27660、鼠氏伤寒沙门氏菌ATCC 22956、肠炎沙门氏菌ATCC 13076、单增李斯特菌ATCC 43251、小肠结肠炎耶尔森氏菌ATCC 23715、福氏志贺氏菌ATCC 12022、宋内氏志贺氏菌ATCC 25931、痢疾志贺氏菌ATCC 51329 、乙型溶血性链球菌ATCC 10373、阪崎肠杆菌ATCC 29004,副溶血性弧菌ATCC 17802 均为本公司保藏的标准菌株。
1.1.2 试剂
抗体:肠出血性大肠杆菌O157:H7 单克隆抗体(3 mg/mL)由本公司自主制备并纯化,单克隆抗体杂交瘤号是EC-Mab-D3;羊抗兔HRP-TgG,购买自上海励瑞生物科技有限公司;牛血清白蛋白,购买自亚科生物科技有限公司。
大肠杆菌O157:H7 的ELISA 试剂盒为本公司自主生产。
培养基:普通营养肉汤(NB)等培养基购买自国药集团。
分子生物学试剂:10 × PCR Buffer、dNTPs、TaqDNA 聚合酶等分子生物学试剂,购买自宝生物科技有限公司;rfbF 基因引物由生工合成。
无水Na2HPO4,无水KH2PO4,NaCl 等化学试剂,购买自上海凌峰化学试剂有限公司。
1.2 研究方法
1.2.1 细菌培养
肠出血性大肠杆菌O157:H7 标准菌株和对照菌株标准菌株分别在普通营养肉汤(副溶血性弧菌培养基需加入3%的NaCl,乙型溶血性链球菌培养基需加入7%的全血)中37 ℃摇床(150 r/min)培养18 ~24 h。通过平板计数法得到菌液的浓度(CFU/mL)。
1.2.2 免疫捕获方法的构建
1.2.2.1 抗体包被PCR 管制备IC-PCR 管
用包被液稀释出血性大肠杆菌O157:H7 单克隆抗体(3 mg/mL),使得单抗的浓度为10 μg/mL,将稀释好的单克隆抗体每管50 μL 加入PCR 管中,4℃过夜包被。免疫捕获出血性大肠杆菌O157:H7。
4℃过夜包被后取出并将PCR 管中的液体扣出,再加入PBST(0.1M,pH7.4)洗涤,洗涤时轻微震荡,重复洗涤2 ~3 次,洗涤完成后尽量叩干管内残存洗涤液。加入过夜培养的大肠杆菌O157:H7(普通营养肉汤为阴性对照),37℃孵育2h,取出,用PBST(0.1M,pH7.4)洗涤,重复洗涤2 ~3 次,洗涤完成后尽量叩干管内残存洗涤液。
1.2.2.2 PCR 扩增大肠杆菌O157:H7 的rfbF 基因[7]
在1.2.2.1 步骤得到的PCR 管中加入PCR 体系:10 ×PCR Buffer 5 μL;dNTP(2.5 mmol/L)2 μL;TaqDNA 聚合酶(5U/L)1 μL;正向引物(10 μmol/L)2 μL,引物5’-att gcg ctg aag cct ttg-3’;反向引物(10 μmol/L)2 μL,引物5’-cga gta cat tgg cat cgt g-3’;加入ddH2O 双蒸水补足至50 μL(反应体系为50 μL)。
PCR 的反应程序参数为:95℃预变性5 min,用于裂解菌体;35 个循环(95℃变性15 s;55℃退火30 s;72℃延伸1 min),72℃再延伸5 min,4℃保温;扩增产物用1.5%的琼脂糖凝胶电泳来检测目标条带并且紫外投射成像分析。
1.2.3 免疫捕获PCR 检测出血性大肠杆菌O157:H7 特异性
将目的菌株大肠杆菌O157:H7 和对照菌株金黄色葡萄球菌、鼠氏伤寒沙门氏菌、肠炎沙门氏菌、单增李斯特菌、小肠结肠炎耶尔森氏菌、福氏志贺氏菌、宋内氏志贺氏菌、痢疾志贺氏菌、乙型溶血性链球菌、阪崎肠杆菌培养过夜,然后在实验步骤1.2.2.1 所制备的IC-PCR 管中加入各种培养过夜菌株的菌液,进行免疫捕获和PCR 扩增检测,步骤如1.2.2.2 和1.2.2.3。
1.2.4 免疫捕获PCR、直接PCR、ELISA 检测出血性大肠杆菌O157:H7 灵敏度比较
1.2.4.1 免疫捕获PCR 检测出血性大肠杆菌O157:H7 灵敏度
将培养过夜大肠杆菌O157:H7 平板计数,用生理盐水将其稀释至1.04 ×108~1.04 ×10 CFU/mL,各取200 μL 菌液加入制备好的IC-PCR 管中,进行免疫捕获和PCR 扩增检测。同时设置阴性对照。
1.2.4.2 直接PCR 检测出血性大肠杆菌O157:H7灵敏度
肠出血性大肠杆菌O157:H7 标准菌株培养18 h后,稀释菌液,菌液浓度梯度为:1.04 ×108~1.04 ×10 CFU/mL。每个梯度各取5 μL 菌液进行直接PCR扩增,生理盐水设为阴性对照。
1.2.4.3 ELISA 检测出血性大肠杆菌O157:H7 灵敏度
将肠出血性大肠杆菌O157:H7 多克隆抗体包被到ELISA 板上,4℃过夜,次日洗掉残液,用PBST 洗3次拍干,用3%的的BSA 封闭(200 μL/孔),37℃封闭1 h,用PBST 洗3 次,拍干,各个孔中加入过夜培养的稀释梯度的大肠杆菌菌液(108~103CFU/mL,100 μL/孔),以肉汤作为阴性对照,37℃孵育1 h,用PBST 洗3 次,然后各孔加入100 μL 的酶标抗体,37℃温育1 h,加入TMB 显色液,,然后加入终止液,用酶标仪450 nm 测定各孔吸光值,计算P/N 值,如果P/N≥2.1,则为阳性。
1.2.5 免疫捕获PCR 检测出血性大肠杆菌O157:H7 食品模拟带菌
采用的食样为牛奶、酸奶、香肠、果汁、鸡蛋、蛋糕。按照国标GB/T4789.36 -2008《食品卫生微生物学检验 大肠埃希氏菌O157:H7/NM 检验》处理样品,然后用不同浓度的出血性大肠杆菌O157:H7 纯菌液人工污染样品,,菌液的浓度依次为:1.04 ×108~1.04 × 102CFU/mL,最后分别进行免疫捕获和PCR 扩增检测,步骤如1.2.2.2 和1.2.2.3,设置空白对照。
2 结果分析
2.1 免疫捕获PCR 方法特异性的验证
实验中采用了10 种非特异性菌株来验证此方法的特异性。从图1 中看出,泳道1 和2 出血性大肠杆菌O157:H7 扩增出499bp 左右的rfbF 基因片段,泳道9 宋内氏志贺氏菌出现了非特异性扩增条带,其他对照菌株均无目的片段出现,可见该IC-PCR 方法对大肠杆菌O157:H7 有较好的特异性。
2.2 免疫捕获PCR、ELISA、直接PCR 检测灵敏度比较
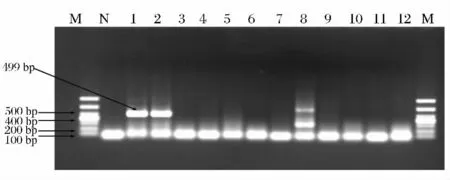
图1 IC-PCR 实验特异性验证Fig.1 Specific experiment of IC-PCR
表1 为ELISA 双抗夹心法检测大肠杆菌O157:H7 灵敏度结果,当菌浓度低于105CFU/mL 时,P/N<2.1,菌浓度达到105CFU/mL 时,P/N 值为2.67,大于2.1,所以ELISA 双抗夹心法检测大肠杆菌O157:H7 灵敏度达到105CFU/mL;图2 为直接PCR检测大肠杆菌O157:H7 的灵敏度检测的结果,图中泳道1 -4 号可见特异性目标条带出现,片段大小为499bp,并且可以看到亮度依次减弱。5 ~8 泳道和阴性对照未见特异性条带。实验结果显示,出血性大肠杆菌O157:H7 纯菌液直接PCR 检测的灵敏度为1.04 ×105CFU/mL,每反应体系细菌数为520CFU。图3 为免疫捕获PCR 方法检测大肠杆菌O157:H7的灵敏度,图中泳道1 ~7 号可见特异性目标条带出现,片段大小为499bp,并且可以看到亮度依次减弱。8 泳道和阴性对照未见特异性条带,由此推测ICPCR 检测大肠杆菌O157:H7 纯菌液检测限的灵敏度可达到1.04 ×102CFU/mL,每反应体系细菌数为20CFU。但在具体实验过程中,有时候检测限会达到1.04 ×104CFU/mL,实验结果显示免疫捕获PCR 方法检测大肠杆菌的灵敏度是ELISA 方法和直接PCR方法灵敏度的103倍。
多次重复实验显示IC-PCR 检测灵敏度为102~104CFU/mL,多次重复实验显示,菌落计数的误差、食品样品的影响、操作的误差等,是造成检测灵敏度波动的主要原因。

表1 ELISA 法检测大肠杆菌O157:H7 灵敏度结果Table 1 Results of detection of Escherichia coli O157:H7 by ELISA

图2 直接PCR 检测灵敏度验证Fig.2 Sensitivity of the detection method using direct PCR
2.3 食品样品模拟带菌检测
食品样品采用了牛奶,酸奶,蛋糕,鸡蛋,果汁,香肠。实验结果如图4 所示,图中A(1)、B(1)、C(1)、D(1)、E(1)、F(1)所示,可以看出直接PCR 检测大肠杆菌O157:H7 食品样本模拟带菌的灵敏度可达到1.04 ×105~1.04 ×106CFU/mL,每反应体系细菌数为5 ×102~5 ×103CFU。而图中A(2)、B(2)、C(2)、D(2)、E(2)、F(2)所示,可以看出免疫捕捉PCR 检测食品样本模拟带菌的灵敏度可达到1.04 ×103~1.04 ×104CFU/mL,每反应体系细菌数为2 ×102~2 ×103CFU。大肠杆菌O157:H7 食品样本模拟带菌免疫捕获PCR 比直接PCR 灵敏度至少提高了10 倍。

图3 免疫捕获PCR 检测灵敏度验证Fig.3 Sensitivity of the detection method using IC-PCR

图4 食品样品模拟带菌免疫捕获PCR 实验研究Fig.4 Results of bacteria detection in food samples
3 讨论
IC-PCR 技术集合了固相免疫反应和PCR 技术的优点,因而既提高了检测特异性,又具有极高的灵敏度[8]。相比于直接PCR,IC-PCR 的PCR 管上包被特异性抗体,样品中的出血性大肠杆菌O157:H7 被特异性抗体识别捕获富集,之后进行PCR 扩增,致病菌经过免疫学、分子生物学2 种检测技术的双重检测,确保了检测的准确性,避免PCR 检测中的假阳性。另外该技术具有较高灵敏度,此方法省略了DNA 的提取过程,不仅方便省时,而且降低了DNA提取过程中的细菌损失,PCR 管壁上的单克隆抗体捕捉并富集了样品中的出血性大肠杆菌O157:H7,间接提高了模板量,而在普通的PCR 实验中,没有免疫富集的步骤,加入纯菌液直接扩增的模板量有限,因此检测灵敏度会低于IC-PCR1-2 个数量级,因此IC-PCR 对于微量病原的检测,具有一定的优势。
本实验中由于计数等存在实验操作问题,有时灵敏度达到103CFU/mL。食样检测发现,不同的食品模拟带菌,检测灵敏度可达到(103~104)CFU/mL,是直接PCR 的100 倍左右,不同样品本身,对IC-PCR的灵敏度,具有一定的影响。另外实验采用10 种其他常见食源性致病菌作为对照菌株,检测结果都为阴性,只有大肠杆菌为阳性,证明了该检测方法具有较高特异性。
综上所述,IC-PCR 是一种廉价、高效、灵敏、快速的检测技术,全部试验可在3 h 内完成,致病菌经过免疫识别、PCR 双重检测,确保了检测结果的可靠性,适合食品安全监管部门、食品企业实施血性大肠杆菌O157:H7 的快速检测鉴定。
[1] 孙洋. 肠出血性大肠杆菌O157 快检方法的研究[D].吉林大学,2007.
[2] 朱文冠,薛素强,洪洁心,等. 多重PCR 方法检测大肠杆菌O157:H7 的初步研究[J]. 中国人兽共患病学报,2006,22 (5):428 -432.
[3] Altekruse S,Cohen M,Swerdlow D. Emerging foodborne diseases[J].Emerging Infectious Diseases,1997,3 (3):285.
[4] 郑桂丽,廖绍安,李钏华,等. 大肠杆菌O157 特异基因的PCR 检测方法[J]. 中国卫生检验杂志,2006,15(10):1 183 -1 185.
[5] 邬国军,陈淑珍. 免疫PCR 技术研究进展[J]. 国外医学:临床生物化学与检验学分册,2000,21 (5):260 -261.
[6] Sano T,Smith C L,Cantor C R. Immuno-PCR:very sensitive antigen detection by means of specific antibody-DNA conjugates[J].Science-NEW YORK Then Washington-DC,1992:120 -120.
[7] SNT 1869 -2007. 食品中多种致病菌快速检测方法:PCR 法[S].
[8] 黄杰,李金明. 免疫PCR 技术及其应用研究进展[J].国际检验医学杂志ISTIC,2006,27 (8).
