小麦胚芽蛋白钙络合物的制备及结构表征*
2013-10-30刘凤茹曹漪王莉王韧陈正行
刘凤茹,曹漪,王莉,王韧,陈正行
(江南大学粮食发酵工艺与技术国家工程实验室,江苏 无锡,214122)
钙是人体内不可或缺的矿物质成份,不仅参与骨骼的新陈代谢,而且还是维持人体正常生理活动所必须的,如调节神经传导、肌肉收缩,维持血液凝固,提供细胞活动能量等[1]。钙制剂的发展分为3 代,包括以无机盐为主(碳酸钙、氯化钙等)的第1 代、以有机酸盐为主(乳酸钙、葡萄糖酸钙等)的第2 代和以有机酸螯合钙源为主(天门冬酸钙等)的第3 代钙产品[2]。近年研究人员提出了一个新的有机微量元素的可能吸收机理——小肽吸收理论。金属离子和小肽螯合后,完整的肽作为矿物质的配体通过肽转运机制进入粘膜细胞,一方面提高了肽的利用率,同时加快了以螯合态存在的金属离子在消化道经过胃及小肠中离子吸收部位时的吸收速度[3]。小肽理论的提出和发展,推动了第4 代小肽金属螯合物的研制进程,开发具有特定活性和运载钙离子能力的小肽络合物有着广阔的发展空间。
乳及乳制品是富含钙的食物,被作为公认的优质钙来源,如酪蛋白磷酸肽(casein phosphopeptides,CPPs)有利于促进肠道钙的吸收,主要依据是CPP 结构中的磷酸丝氨酸残基[-Sex(p)-]成簇存在且带负电荷,在小肠的离子吸收部位(pH7 ~8 的环境),能以配体形式有效地与钙形成可溶性络合物,抑制不溶性沉淀的形成,最终可因游离钙的浓度提高而促进钙的被动吸收[4];研究还发现,一些不含有磷酸丝氨酸残基的蛋白或肽也具有络合钙离子和促进其吸收的作用,如大豆蛋白[5]、乳清蛋白[6]、低值鱼蛋白[1]、猪血蛋白[7]等。报道称这些肽与钙离子的络合能力可能与肽段的分子量、氨基酸组成、氨基酸序列以及羧基含量等有关[8]。然而有部分人群对牛奶和大豆过敏,目前研究较多的蛋白大部分都是动物蛋白,因此,开发新的质高价廉的植物蛋白资源钙制剂势在必行。
小麦胚芽作为小麦籽粒的生命源泉,是整个麦粒营养价值最高的部分。麦胚蛋白含有8 种必须氨基酸,比例合适,数量充足,有很好的氨基酸平衡,是一种完全蛋白质[9]。麦胚蛋白中还蕴涵着许多具有生物活性的氨基酸序列,这些肽段上带负电荷的氨基酸、含有羟基侧链的氨基酸(Thr、Ser)、具有游离羧基的氨基酸以及某些特殊氨基酸(His、Lys、Arg)侧链等易与钙离子结合形成稳定的容易被吸收和利用的金属离子络合物[10]。因此,本研究以小麦胚芽蛋白为原料,采用不同蛋白酶酶解后将其与钙进行络合反应制备第四代钙复合物。
1 材料与方法
1.1 材料与设备
1.1.1 材料
小麦胚芽由河南漫天雪食品有限公司提供。
主要试剂:碱性蛋白酶(Acalase)、复合蛋白酶(Protamex)、风味蛋白酶(Flavourzyme)、中性蛋白酶(Neutrase)和木瓜蛋白酶(Papain)(诺维信酶制剂公司);标准蛋白Marker(Bio-rad 公司);Tris(百灵威科技有限公司);其余试剂均为国产分析纯。
1.1.2 主要仪器与设备
SHA-B(A)水浴恒温振荡器,金坛市荣华仪器制造有限公司;UV-2800 型紫外可见分光光度计,尤尼柯上海仪器有限公司;冷冻干燥机,美国LABCONCO公司;BECKMAN Coulter Avanti J-26 XP 高速冷冻离心机,美国贝克曼公司;Mini-PROTEAN 小型垂直电泳仪,美国Bio-rad 公司;Agilent 1100 HPLC,美国安捷伦科技有限公司;Nicolet Nexus 470 FT-IR 傅里叶红外光谱仪,美国Thermo Electron 公司)。
1.2 实验方法
1.2.1 麦胚蛋白钙离子络合物的制备
(1)小麦胚芽蛋白的提取:小麦胚芽用正己烷脱脂3 遍,脱脂麦胚与去离子水按质量比1∶10 混合搅拌,再加入3%的NaCl 搅拌30 min,用1 mol/L NaOH调节浆液的pH 到9.5,搅拌1h 后在2 420 g 下离心20 min,然后用1 mol/L HCl 调节上清液的pH 到4.0,9 680 g 下离心20 min,沉淀物水洗3 次后调节pH 到7.0 即为麦胚分离蛋白(WGPI),冷冻干燥后4℃保存。
(2)小麦胚芽蛋白的酶水解:称取一定量的麦胚蛋白与去离子水配成5%的溶液,酶与底物比率为2%,分别在每种酶的最佳水解条件下进行酶解(Acalase:50℃,pH 8.0;Protamex:50℃,pH 6.5;Flavourzyme:50℃,pH 7.0;Neutrase:50℃,pH 7.0;Papain:55℃,pH 7.0),并记录5h 内酶解进程中的水解度变化。
(3)小麦胚芽蛋白酶解物的钙离子络合:称取0.1g 麦胚蛋白,加5 mL 20 mmol/L 的Tris-HCl(pH 7.8)溶液,再加0.5mL 0.2 mol/L 的CaCl2溶液,用漩涡振荡器混合均匀,在恒温振荡水浴锅中40℃下反应1 h,8 000 r/min 离心10 min,上清液中加入30 mL 无水乙醇静置沉淀,8 000 r/min 离心10 min,沉淀50℃下烘干并称重,最后用0.01 mol/L 的EDTA滴定。以上每个实验数据均重复3 次。
1.2.2 pH-Stat 测定水解度

其中,B:消耗碱量;Nb:碱的摩尔浓度;α:麦胚分离蛋白氨基的平均解离度,与温度和pH 值有关;Mp:被水解蛋白的质量(g);htot:每克蛋白质底物具有的肽键毫摩尔数(麦胚蛋白htot=8.3)。
1.2.3 麦胚蛋白钙离子络合物钙含量的测定
网页设计与制作作为中职计算机专业的主要课程,是社会发展中最热门的一门专业,目的就是让学生掌握关于网页设计的技能,为今后的网页设计奠定基础。如表1所示。
按照“GB/T 5009.92 -2003,食品中钙的测定”中EDTA 滴定法测定络合物中钙含量,以每克蛋白中钙的毫克数(mg/g)来表示。
1.2.4 十二烷基磺酸钠聚丙烯酰胺凝胶电泳( SDSPAGE)
SDS-PAGE 是根据Laemmli[11]的方法在12%分离胶和5%浓缩胶的不连续缓冲系统中进行。蛋白质样品溶解再0.125 mol/L Tris-HCl 缓冲液(pH 为6.8)中,含1% (w/v)SDS,2%的(v/v)2-巯基乙醇(2-ME),5% (v/v)甘油和0.025% (w/v)溴酚蓝,电泳前在沸水中加热5min;每个泳道上样量为10 μL,电泳在恒定电流20mA 下运行约3 h;分离胶用0.25%的考马斯亮蓝R-250(溶于50%的甲醇水溶液中)进行染色,然后在7.5%乙酸中脱色。
1.2.5 氨基酸组分分析
麦胚蛋白酶解物的氨基酸组分测定根据Yang[12]等人的方法略作改动,用6 mol/L 的HCl 在110℃下水解22 h 后,在Agilent 1100 氨基酸分析仪上进行分析。定量方法:采用外标法定量。
1.2.6 麦胚蛋白酶解物的分子量分布
分子量分布是根据Zhuang[13]等人的方法采用凝胶过滤色谱柱(TSK 凝胶G2000 SWXL 7.8 mm×300 mm)在Agilent 1100 HPLC 系统中进行测定。流动相V(乙腈)∶V(水)∶V(三氟乙酸)=30∶70∶0.1),流速0.5 mL/min,30℃下220 nm 处监测。所使用的标准品是三肽GGG (Mr 189)、四肽GGYR (Mr 451)、杆菌肽(Mr 1450)、抑肽酶(Mr 6500)和细胞色素C(Mr 12500)。
将样品配制1 mg/mL 溶液后,以去离子水做参比对仪器进行基线扫描,用UV-2800 紫外可见分光光度计扫描测定190 ~800 nm 吸光度值的变化,波长扫描间隔2 nm,以波长与吸光度值绘制该样品的光谱曲线。
1.2.8 麦胚蛋白钙络合物的红外分析
将含有约1%样品的溴化钾粉末用玛瑙研钵磨细后压片,采用Nicolet Nexus 470 型傅立叶红外光谱仪分析,扫描波数范围为4 000 ~400 cm-1,扫描32次,分辨率为4 cm-1。
2 实验结果与讨论
2.1 小麦胚芽蛋白的酶解进程
图1 显示了碱性蛋白酶(Acalase)、复合蛋白酶(Protamex)、风味蛋白酶(Flavourzyme)、中性蛋白酶(Neutrase)和木瓜蛋白酶(Papain)以小麦胚芽分离蛋白为底物酶解5h 的水解度变化趋势。在酶解的最初30 min 之内,5 种蛋白酶的酶解速度均较快,水解度显著升高;1 h 后木瓜蛋白酶、中性蛋白酶和风味蛋白酶的水解速度明显减缓,逐渐趋于恒定,最大水解度分别为10.4%、5.7%和4.5%;碱性蛋白酶和复合蛋白酶水解速度一直呈上升趋势,水解后期稍有减缓,最大水解度分别为22.4%和21.1%,这个结果与Zhu[14]的报道一致。由此可见,碱性蛋白酶和复合蛋白酶均易水解麦胚蛋白,且前者的水解程度略高,而风味酶的水解效果最差。

图1 小麦胚芽蛋白酶解进程曲线Fig. 1 The enzymolysis process curve of wheat germ protein
2.2 麦胚蛋白水解物与钙离子络合反应
不同水解时间的麦胚蛋白水解物与钙离子络合的情况如图2 所示。图2a 揭示了蛋白水解产物结合钙离子的能力,碱性蛋白酶各个酶解时间的产物均具有较高的钙络合能力,除了木瓜蛋白酶水解产物络合钙能力随着酶解时间的延长而降低,其余蛋白酶均随酶解时间延长而增加,络合能力由强到弱依次为:碱性蛋白酶>复合蛋白酶>木瓜蛋白酶>中性蛋白酶>风味蛋白酶;图2b 表明随着水解时间延长络合物得率略有提高,但不显著,得率最高的是碱性蛋白酶水解液,其次是复合蛋白酶、木瓜蛋白酶、中性蛋白酶、风味蛋白酶。另外,随着碱性蛋白酶水解液的水解度(水解时间延长)逐渐提高,钙离子键合能力增强,且水解度为21.5%时钙的结合量达到最大值18 mg/g 蛋白,之后键合能力略有下降。这主要是因为蛋白水解程度提高,蛋白质酶切片段增多,暴露出更多的活性位点,但水解进一步加深后,蛋白酶加剧了活性片段的水解,从而降低了具有键合能力的活性位点数。综上分析,碱性蛋白酶具有更高的麦胚蛋白水解活性,是制备高键合钙能力水解液的最适合酶类,且水解程度达到一定范围时(DH在21.5%附近)具有最高的钙离子键合能力。

图2 麦胚蛋白钙络合物的钙络合量及得率Fig. 2 The calcium content and yield of wheat germ protein-calcium complex (WGP-Ca)
2.3 进行络合反应的麦胚蛋白水解物电泳分析
图3 为麦胚蛋白与不同酶水解产物的电泳图谱,可以看出不同酶对麦胚蛋白的水解情况是显著不同的。图3f 将麦胚中的4 种蛋白按Osborne 分类法分别提取出来与WGPI 对比发现,WGPI 包含了清、球、醇溶和谷蛋白,且主要为清蛋白和球蛋白,相对分子质量范围主要分布在15 ~100 kDa,有4 个明显的区域带:50 kDa、32 ~34 kDa、28 kDa 和14 ~17 kDa,还有3 个高分子量亚基,分别是100 kDa、80 kDa 和70 kDa 以及1 个低分子量亚基20 kDa;麦胚清蛋白亚基丰富,分布均匀,相对分子质量范围主要分布在14 ~100 kDa 之间;球蛋白主要包括4 个明显的区域带:50 kDa、32 kDa、28 kDa 和17 kDa。
图3a 和图3e 的谱带变化最为明显,在图3a 中水解0.5h 时,碱性蛋白酶将麦胚蛋白中的高分子量亚基迅速降解,只剩34 kDa 和<17 kDa 两个明显的区域以及少量的47 kDa、20 kDa 和18 kDa 条带;随后碱性蛋白酶将麦胚蛋白亚基逐渐全部水解成分子量在15 kDa 以下的小分子肽;图3e 中,木瓜蛋白酶在0.5h 内就将麦胚蛋白分子量降解到15 kDa 以下,其水解速度之快显而易见,但这对于获得高键合钙离子肽并非是有利的,这已从图2 中获得证实;图3c 中风味蛋白酶对麦胚蛋白的水解程度不明显,水解时间的改变也没有影响蛋白水解,这与图1 中水解度的研究结果相一致;图3d 中中性蛋白酶对麦胚蛋白水解略好于风味蛋白酶,但蛋白水解液的主要谱带区域没有发生显著变化;图3b 中复合蛋白酶主要水解麦胚蛋白的高分子量亚基,100 kDa 和80 kDa 首先被水解,然后依次水解70 kDa 和50 kDa,最后产物中主要含有34 kDa 和<17 kDa 两个明显的区域谱带。
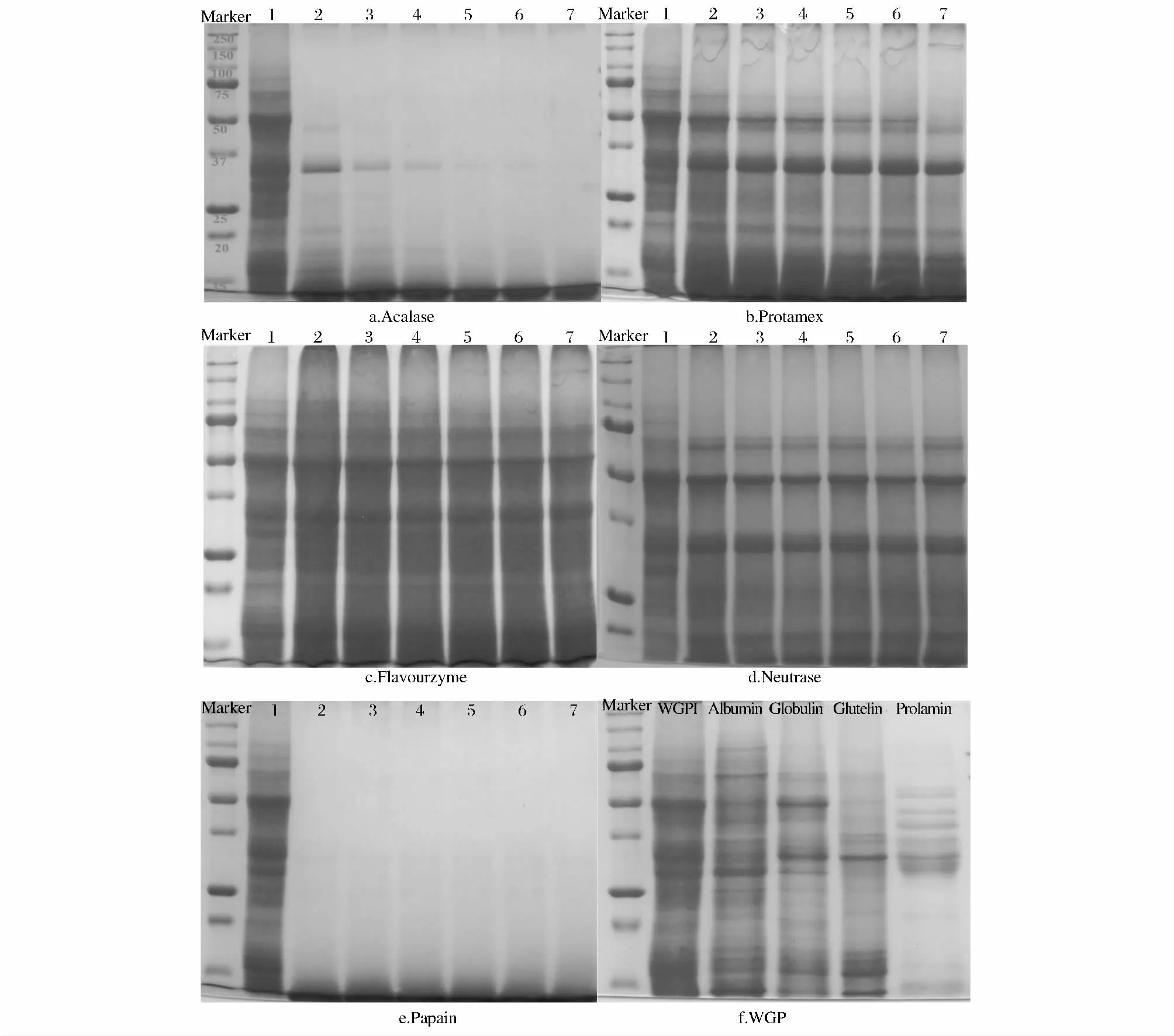
图3 不同反应时间麦胚蛋白水解液电泳图Fig. 3 The electrophoresis pattern of wheat germ protein hydrolysates at different enzymatic time
结合图2 的结果得出,麦胚分离蛋白中100、80、70、50、32 ~34 kDa 亚基的水解与钙离子键合能力密切相关。复合蛋白酶、风味蛋白酶和中性蛋白酶对麦胚蛋白中50 及32 ~34 kDa 两个主要的谱带区域水解很少或几乎不水解,显著影响了这3 种水解产物的钙离子键合能力;碱性蛋白酶和木瓜蛋白酶均能成功地水解麦胚分离蛋白中所有亚基,但木瓜蛋白酶水解物亲和钙离子能力远小于碱性蛋白酶水解物,这主要是因为碱性蛋白酶是由地衣芽孢杆菌发酵而得,是一种内切酶,催化部位为丝氨酸;而木瓜蛋白酶属于内肽酶,具有较宽的底物特异性,作用于蛋白质中L-精氨酸、L-赖氨酸、甘氨酸和L-瓜氨酸残基羧基参与形成的肽键,可能破坏了活性肽段的氨基酸序列,从而降低了亲和钙离子能力。
2.4 麦胚蛋白水解物氨基酸组分分析
随着酶解反应的进行麦胚蛋白逐渐被水解成小肽和氨基酸,不同酶解产物中的氨基酸组分比例变化如表1 所示。数据显示碱性蛋白酶酶解后主要组分是Glu、Arg、Asp、Val 和Leu;复合蛋白酶酶解后主要组分是Glu、Arg 和Asp;风味蛋白酶酶解后主要组分是Glu、Arg、Asp 和Gly;中性蛋白酶酶解后主要组分是Glu、Arg、Asp 和Gly;木瓜蛋白酶酶解后主要组分是Glu、Arg 和Asp;可见,在各种酶解产物中Glu、Arg、Asp 和Gly 在总氨基酸中都占有较高比例,但碱性蛋白酶酶解物中Thr、Val、Phe、Leu 和Ile 的比例均高于其他酶解产物,这些氨基酸大部分属于疏水性氨基酸,表1 还显示了碱性蛋白酶酶解物的总疏水性氨基酸比例在所有酶解产物中最高。因此,可以得出水解物中Glu、Arg、Asp 和Gly 与键合钙离子能力密切相关,且疏水性氨基酸含量也起到了重要作用。

表1 麦胚蛋白水解物氨基酸组分含量分析(%)Table 1 The analysis of amino acid composition proportion in wheat germ protein hydrolysates
2.5 碱性蛋白酶酶解物分子量分布
在碱性蛋白酶最佳酶解工艺条件下制备麦胚蛋白酶解液,经离心和3、5、10 kDa 的超滤膜过滤后,通过高效液相凝胶色谱法对各截留组分进行分子量分布的测定,结果如表2 所示。表2 表明P2 和P3 组分键合钙离子能力显著高于P1 和P4 组分,这主要是因为在P1 组分中<500 kDa 的蛋白含量高达56.65%,其中主要是氨基酸等小分子物质,而P4 组分中含有10.51%的蛋白分子量>5000kDa 的大分子蛋白,由此可见,蛋白分子量太小(<500 kDa)或是太大(>5 000 kDa)均不利于键合钙离子;具有高键合钙离子能力的P2 和P3 组分中500 ~2 000 kDa 范围的蛋白分子比例分别达到39.22%和37.79,>5 000 kDa 和<500 kDa 的部分分别低于2%和50%,即分子量主要分布在2000 kDa 以下的酶解物具有更高的钙离子键合能力,该测定结果与大部分关于钙螯合肽的研究结果[6,15]相符,为其进一步的分离纯化打下了很好的基础。
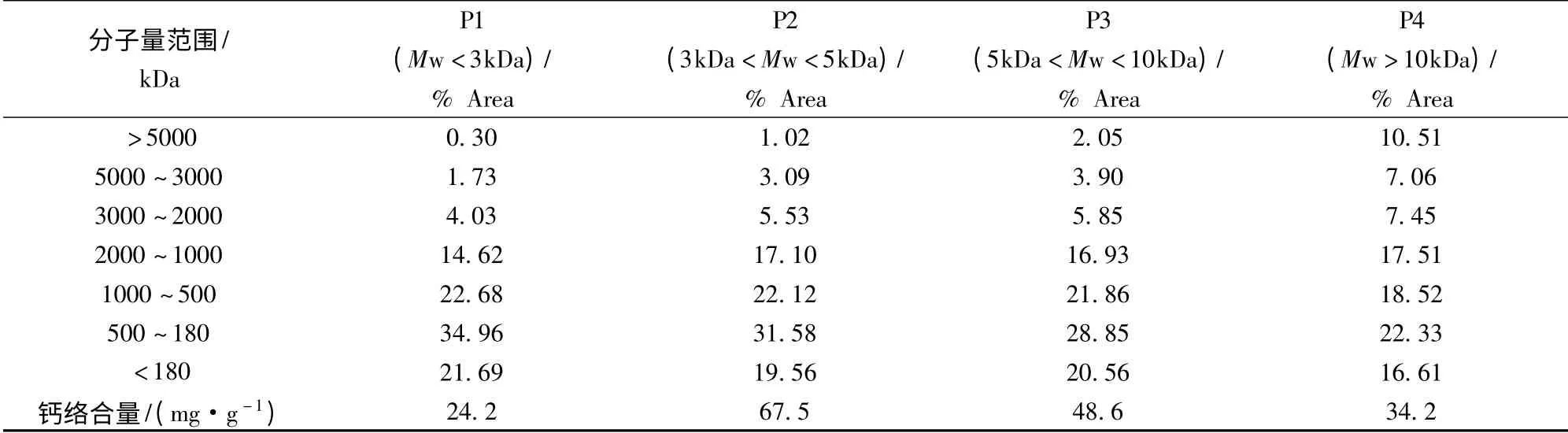
表2 碱性蛋白酶酶解物经分子截留后各部分的分子量分布Table 2 The molecular weight distribution of alkaline protease hydrolysates after ultrafiltration membrane retention
2.6 麦胚蛋白钙络合物全波长扫描
一般来说,蛋白(肽)的吸收主要集中在190 ~325 nm 这个范围。从图4 中小麦胚芽蛋白钙络合物的近紫外区光谱可知,麦胚蛋白肽在约216 nm 处有强吸收峰,这是肽键的特征吸收峰,在260 nm 附近处也有一个较强吸收峰,一般为蛋白中Phe 残基的吸收峰;与麦胚蛋白相比,络合物中此两峰消失,且络合物的最大吸收峰高度显著增高、增宽,位置向长波方向移动了,说明Ca2+与麦胚蛋白中的酰胺键发生了作用,形成了基态络合物。一般络合物的生成会使其配位体对光吸收性能发生改变[16],这是因为麦胚多肽与钙结合后相应原子的价电子跃迁不同的反映,证明了它们之间发生了配合反应,此结果与Yu[17]报道的胶原蛋白钙复合物的结果相类似。综合比较可得出WGP-Ca 是一种不同于麦胚多肽的新物质。
2.7 麦胚蛋白钙络合物红外分析
由氨基酸的红外光谱可见,在特征区,—NH2的吸收峰在3 025 cm-1发生红移,移动到了3 204 cm-1,说明水解蛋白中的—NH 键发生了明显的化学反应;在指纹区,C = O 的吸收峰红移至1 628 cm-1,—COO—的吸收峰在1 450 cm-1消失。比较两图可知,氨基酸中的—NH2、—COOH 的吸收峰均发生了移动,说明它们均参与反应;而且在2 100 cm-1处的一个较强的吸收峰消失了,这与日本特许公报[18]中介绍的α-氨基酸在2 100 cm-1处有一特征峰,络合之后该峰就消失的报道一致,所以可判断该产品是多肽钙的络合物。

图4 小麦胚芽蛋白钙络合物的全波长扫描图谱Fig.4 The fullwavelength scan pattern of wheat germ protein-Calcium complex

图5 小麦胚芽蛋白钙络合物的红外光谱Fig.5 The infrared spectroscopy of wheat germ protein-Calcium complex
3 结论
小麦胚芽蛋白碱性蛋白酶水解产物能与钙离子发生键合反应形成肽钙络合物,碱性蛋白酶是水解麦胚蛋白的最佳催化剂,首先作用于麦胚蛋白的高分子量亚基上,逐渐水解中低分子量亚基,最终水解成15 kDa 以下的小分子肽;具有高键合钙离子能力的水解产物中含有特定的氨基酸组分和高比例的疏水性氨基酸,且分子量在2 000 Da 以下的小肽易与钙发生键合反应;全波长扫描和红外图谱表明肽段上的氨基和羧基均参与了键合反应,并生成了新的物质。麦胚肽钙络合物在胃肠道中的稳定性及释放情况还有待后续研究。
[1] Jeon S J,W -G Kim,K B Song. Isolation of a Calciumbinding Substance from Anchovy[J]. Journal of the Korean Society for Applied Biological Chemistry,2010,53(4):516 -518.
[2] 曾敏莉,周远大. 钙制剂的现状及发展趋势[J]. 儿科药学杂志,2004,10(3):16 -18.
[3] 苏纯阳,董仲华,香红星. 微量元素氨基酸(小肽)螯合物的研究应用进展[J]. 饲料工业,2002,23(1):15 -18.
[4] Miquel E,Farré R. Effects and future trends of casein phosphopeptides on zinc bioavailability [J]. Trends in Food Science & Technology,2007,18(3):139 -143.
[5] Bao X L. A study of the soluble complexes formed during calcium binding by soybean protein hydrolysates [J].Journal of Food Science,2008,73(3):C117 -C121.
[6] Rui X. Calcium binding of peptides derived from enzymatic hydrolysates of whey protein concentrate[J]. International Journal of Dairy Technology,2009,62(2):170 -173.
[7] Lee S H,Song K B. Article isolation of a calcium-binding peptide from enzymatic hydrolysates of porcine blood plasma protein[J]. Journal of the Korean Society for Applied Biological Chemistry,2009,52(3):290 -294.
[8] Nemirovskiy O V,Gross M L. Intrinsic Ca < sup >2 +</sup > affinities of peptides:application of the kinetic method to analogs of calcium-binding site III of rabbit skeletal troponin C[J]. Journal of the American Society for Mass Spectrometry,2000,11(9):770 -779.
[9] 袁道强,王丹丹,扶庆权. 小麦胚蛋白的研究及应用进展[J]. 粮食与饲料工业,2007(2):9 -11.
[10] Ho Y P. Relative calcium ‐ binding strengths of amino acids determined using the kinetic method [J]. Rapid Communications in Mass Spectrometry,2007,21(6):1 083 -1 089.
[11] Laemmli U K. Cleavage of structural proteins during the assembly of the head of bacteriophage T4 [J]. Nature,1970,227(5259):680 -685.
[12] Yang B. Amino acid composition,molecular weight distribution and antioxidant activity of protein hydrolysates of soy sauce lees [J]. Food Chemistry,2011,124(2):551 -555.
[13] Zhuang Y. Antioxidant and melanogenesis ‐ inhibitory activities of collagen peptide from jellyfish (Rhopilema esculentum)[J]. Journal of the Science of Food and Agriculture,2009,89(10):1 722 -1 727.
[14] Zhu K,Zhou H,Qian H. Antioxidant and free radicalscavenging activities of wheat germ protein hydrolysates(WGPH)prepared with alcalase[J]. Process Biochemistry,2006,41(6):1 296 -1 302.
[15] Jung W -K,Kim S -K. Calcium-binding peptide derived from pepsinolytic hydrolysates of hoki (Johnius belengerii)frame[J]. European Food Research and Technology,2007,224(6):763 -767.
[16] 张祥麟. 络合物化学[M]. 北京:冶金工业出版社,1979:17 -65.
[17] Yu Y,D Fan. Characterization of the Complex of Humanlike Collagen with Calcium[J]. Biological Trace Element Research,2012,145(1):33 -38.
[18] 中本一雄著. 黄德如,汪仁庆译. 无机和配合物的红外和拉曼光谱[M]. 北京:化学工业出版社,1991:258 -265.
