外源性Wnt3a持续作用对小鼠胚胎干细胞Wnt/β-catenin信号通路的调控作用
2013-10-30金静君林芳张韬陈泳陈金烟王坤韩俊永薛士杰
金静君 林芳 张韬 陈泳 陈金烟 王坤 韩俊永 薛士杰
胚胎干细胞(embryonic stem cell,ESC)是从囊胚期的内细胞团(inner cell mass,ICM)和早期胚胎的原始生殖细胞(primordial germ cell,PGC)中分离得到的一种在体外具有高度增殖能力和多向分化潜能的细胞,多能性的ESC可以分化成体内三个胚层的所有细胞类型[1]这一特性使它成为令人感兴趣的一个研究热点。ESC临床广泛应用的最急需解决的问题是向特异性治疗的细胞型分化时效率不高,有时混杂有其他胚层细胞,解决这一问题的一个对策是必须了解相关信号通路在ESC自我更新和增殖的机制。Wnt通路在ESC的自我更新及分化中已显示其重要性,尤其是通过原条(primitive streak,PS)形成来诱生中胚层[2-4],进化保守的Wnt信号通路是中胚层细胞形成的关键通路之一。本研究目的是利用单层培养中的ESC Wnt通路的激活,通过相关蛋白和转录因子的表达,阐述Wnt/β-catenin信号通路在ESC自我更新和细胞增殖所起的作用。
材料和方法
一、材料
1.细胞株:小鼠ESC ES-E14TG2a由中国科学院干细胞库提供,建株自129/Ola雄性小鼠。
2.试剂及仪器:DMEM高糖培养基、青链霉素、0.25﹪胰酶购自美国Hyclone公司;胎牛血清(FBS)、非必需氨基酸(NEAA)、2-巯基乙醇购自美国GIBCO公司;白血病抑制因子(LIF)购自Millipore公司ESGRO;Anti-Ribbi IgG(whole molecule)-FITC 购自Transgen Biotech公司;RNA提取试剂盒购自美国Invitrogen公司;逆转录试剂盒购自TAKARA公司;荧光定量PCR试剂盒购自美国Thermo公司。多功能酶标仪Synergy2为美国BIO-TEK 公司产品;流式细胞仪贝克曼库尔特FC-500为美国贝克曼库尔特公司产品;荧光定量PCR扩增仪ABI7500为美国应用生物系统公司产品;倒置相差荧光显微镜IX71为日本奥林巴斯公司产品。
二、方法
(一)细胞培养:小鼠胚胎成纤维细胞(mouse embryonic fibroblast, MEF)的制备及培养参见参考文献[5]。小鼠ESC ES-E14TG2a培养于1﹪gelatin预铺的6孔板上,以同系小鼠的灭活成纤维细胞(MEF)为滋养层细胞,15﹪FBS、1mmol/L glutamine, 1mmol/L NEAA,0.1mmol/L 2-巯基乙醇和1000 U/ml LIF的高糖DMEM培养液中,置于37℃,5﹪CO2、饱和湿度培养箱中培养。细胞每天换液,每隔2~3 d以0.25﹪胰酶-EDTA消化传代。
(二)ESC生物学特性鉴定
1.ESC碱性磷酸酶(AP)表达的检测:ESE14TG2a细胞接种于铺有MEF细胞的六孔板中,待细胞密度为80﹪,吸出细胞培养液,用PBS润洗2~3次,用固定液PFA固定1~2 min,吸出固定液用PBS洗2次,吸出PBS再用TBST润洗2次,准备碱性磷酸酶溶液:溶液A、溶液B、溶液C = 50 μl、12.5 μl、437.5 μl,吸弃 TBST 溶液 ;加入足量的染色试剂使染色液能够覆盖孔底,室温避光放置15~20 min,吸出染色液用PBS缓冲液润洗1次,最后存于PBS溶液中,显微镜下观察,胞浆中棕黑色颗粒为酶活性所在位置。
2.ESC的细胞周期检测:收集ES-E14TG2a细胞 ;用 PBS 洗涤细胞 1次(离心 500 ×g,5 min)收集并调整细胞浓度为1 × 106/ml,取1 ml单细胞悬液;制备的单细胞悬液离心后,去除上清,在细胞中加入体积分数为70﹪冷乙醇500 μl固定(2 h至过夜),4℃保存,染色前用PBS洗去固定液 ;加入 100 μl RNase A 37℃水浴 30 min ;再加入 400 μl PI染色混匀,4℃避光 30 min ;FACS 检测,计数10 000个细胞,激发波长488 nm,吸收波长610 nm,以联机专用软件分析测定各时相细胞比例,计算反映增殖活力的增殖指数PrI,计算公式为PrI =(S+G2+M)﹪。
(三)Wnt3a持续作用激活Wnt/β-catenin信号通路
ES-E14TG2a细胞在经0.1﹪明胶包被的60 mm培养皿上密度达到70﹪~ 80﹪,加入含有Wnt3a(100 ng/ml)的干细胞完全培养液37℃、5﹪CO2、饱和湿度连续培养21 d,隔天换液,每2~3 d传代。
1.细胞免疫荧光:将Wnt3a连续培养21 d与空白培养21 d的ES-E14TG2a细胞做细胞爬片,用4﹪的甲醛固定20~30 min,PBS洗1次;0.5﹪Triton X-100-PBS液室温作用5 min,PBS洗1次;1﹪BSA室温孵育30 min,PBS洗2次;1:250稀释的 Anti-β-catenin抗体 37℃孵育1 h,PBS冲洗3次;1:100稀释的Anti-Ribbit IgG-FITC 37℃避光孵育30 min,PBS冲洗2次;DAPI避光染色作用3~5 min,PBS洗2次;用抗淬灭的封片剂封片;荧光显微镜下观察。
2.Western-Blotting:收集Wnt3a连续培养21 d与空白培养21 d的ES-E14TG2a细胞,用RIPA强裂解液提取细胞总蛋白,10﹪ SDS-PAGE蛋白电泳后,转印至PVDF膜上,封闭缓冲液(5﹪BSA-PBS)4℃过夜,用含5﹪ BSA缓冲液1:1000稀释Anti-β-catenin抗体,将膜置于一抗溶液中,4℃过夜,弃去一抗溶液,用TBS-T缓冲液洗膜3次,每次10 min;用5﹪ BSA缓冲液1:5000稀释Goat Anti-Ribbit-HRP,然后将膜置于二抗中,37℃摇床孵育1 h;去掉二抗溶液,用TBS-T缓冲液洗膜5次,每次10 min;曝光、显影、定影。
3. Real-time PCR检测WNT信号下游靶标基因表达情况:WNT信号通路激活过程中,分别收集 0、7、14、21 d的细胞做 Real-time PCR,检测WNT下游靶标基因的表达情况。细胞总RNA的提取及逆转录分别按Invitrogen公司和TAKARA公司提供的试剂盒说明书操作,相对定量按Thermo公司试剂盒说明书操作,使用的仪器为ABI 7500荧光定量PCR扩增仪,使用primer5.0设计引物如表1,实验结果通过2-△△Ct法进行相对表达水平分析。
(四)统计学分析方法
采用SPSS 13.0统计软件包处理数据,通过2-△△Ct法得到的基因相对表达水平用± s表示,Pitx2、Frizzled、Sox17、Oct4四种靶标基因不同时间比较采用完全随机F检验,并用LSD法进行两两比较。以P< 0.05为差异有统计学意义。

表1 Real-time PCR扩增引物序列
结 果
一、ES-E14TG2a细胞的AP染色:取传代培养的ES-E14TG2a细胞,固定后进行AP染色,显微镜下观察,未分化细胞为染成棕黑色的AP阳性细胞(图1),可见AP染色呈强阳性,表明传代培养的ES-E14TG2a细胞维持未分化状态。
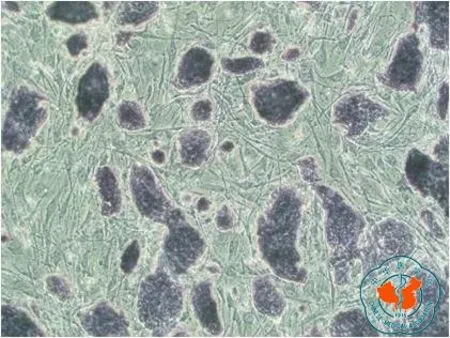
图1 第5代ES-E14TG2a细胞碱性磷酸酶活性(AP染色×100)
二、ES-E14TG2a细胞的细胞周期:细胞周期结果表明(图2),ES-E14TG2a细胞维持良好的生长状态,增殖迅速,PrI为58.7﹪,很少发生凋亡。
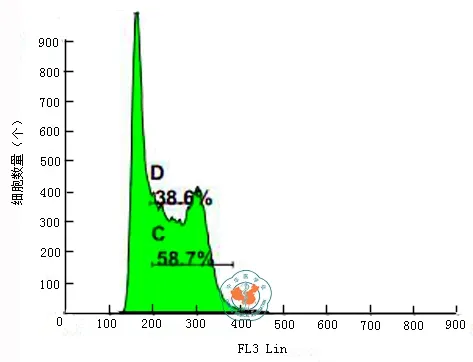
图2 流式细胞仪测定ES-E14TG2a细胞周期
三、β-catenin蛋白的细胞免疫荧光:ESE14TG2a的MEF经Wnt3a连续培养21 d后β-catenin蛋白的细胞荧光明显较强(图3b),而对照组中的荧光强度较弱(图3a),说明ES-E14TG2a细胞经Wnt3a连续培养21 d后细胞内β-catenin蛋白没有被降解而是在胞内大量积累。

图3 ES-E14TG2a细胞β-catenin 的免疫细胞化学检测(免疫荧光×100)
四、Western Blotting:Wnt3a连续培养21 d后ES-E14TG2a细胞内β-catenin蛋白水平明显比对照组增加,图4中Western Blotting结果可以看出,Wnt3a连续培养21 d的β-catenin蛋白条带B明显比空白对照的蛋白条带A粗。
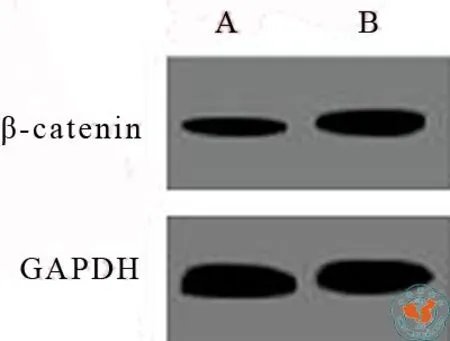
图4 WB检测ES-E14TG2a细胞内β-catenin蛋白水平
五、Wnt/β-Catenin信号通路下游靶标基因的表达:Pitx2、Frizzled、Sox17、Oct4是 Wnt/β-Catenin信号通路下游靶标基因,从表2可以看出ES-E14TG2a细胞经wnt3a培养7 d后WNT信号下游靶标基因的表达量均有所上升,且继续培养到14、21天Pitx2、Frizzled、Sox17的表达量持续增加,与对照组比较有显著性差异(F值在222.757~7217.083间,P均<0.01);而连续培养21 d后Oct4基因的表达量有所下降。
讨 论
建系的ESC能在体外长期培养并保持未分化状态,是具有最大的增殖潜能和全能发育特性的全能(totipotent)干细胞[6-7]。ESC在长期体外培养过程中可能出现分化等异常改变,不利于ESC维持未分化状态和保持全能分化潜能,进而对试验结果产生影响。因此建立稳定的培养体系,对所采用的ESC进行生物学特性鉴定是开展ESC体外造血发育研究的基础和前提。本研究所采用的MEF滋养层细胞培养体系,多次传代后AP试验显示强阳性,细胞仍维持未分化状态;细胞周期试验显示能保持快速增殖特性。表明本实验室的培养体系培养的ES-E14TG2a细胞可满足ESC体外造血发育研究工作的要求。
表2 Wnt/β-Catenin信号通路下游靶标基因的表达(±s)
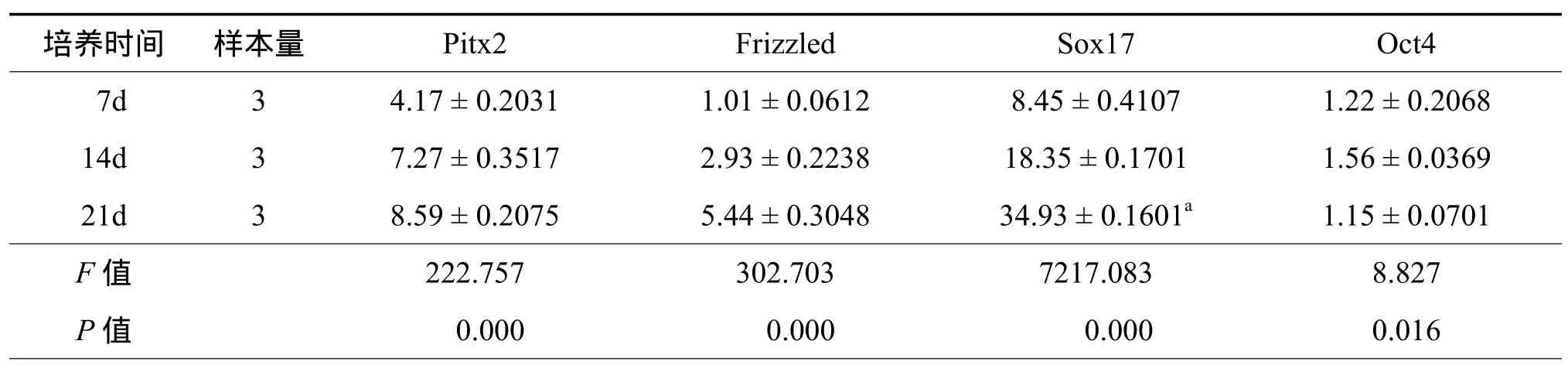
表2 Wnt/β-Catenin信号通路下游靶标基因的表达(±s)
培养时间 样本量 Pitx2 Frizzled Sox17 Oct4 7d 3 4.17 ± 0.2031 1.01 ± 0.0612 8.45 ± 0.4107 1.22 ± 0.2068 14d 3 7.27 ± 0.3517 2.93 ± 0.2238 18.35 ± 0.1701 1.56 ± 0.0369 21d 3 8.59 ± 0.2075 5.44 ± 0.3048 34.93 ± 0.1601a 1.15 ± 0.0701 F 值 222.757 302.703 7217.083 8.827 P 值 0.000 0.000 0.000 0.016
基因表达分析和原基分布图提示中胚层和内胚层至少有部分是从原肠胚形成时分离出来的双重潜能中内胚层细胞(bipotent mesendodermal)[8-9]派生而来。经典Wnt信号的激活在前原肠胚形成胚胎即可检测到,然后一直贯穿原条(PS)形成,到原肠胚形成,因此进化保守的Wnt信号通路是中胚层形成及PS引导的关键通路。实验证实小鼠缺乏Wnt3配体、β-catenin或Lrp5/6受体不会形成PS或中胚层[10-11],这一点也证明了该通路在胚胎发育中的重要性。Wnt通路在ESC的自我更新及分化中已显示其重要性[12-13],尤其是通过PS形成来诱生中胚层。经典Wnt通路中的一个重要分子β-catenin的稳定性是由GSK-3β通过磷酸化及随后的β-catenin降解来进行调控[14-15]。Wnt通路激活时,GSK-3β被抑制,未被磷酸化的β-catenin呈稳定非降解状态并进入细胞核激活Wnt调控基因的转录。本研究是用含重组Wnt3a(100 ng/ml)的干细胞培养液连续培养ES-E14TG2a小鼠ESC 21 d,然后再通过细胞免疫荧光染色、Western Blotting观察经Wnt3a连续培养21 d后细胞内β-catenin蛋白是否在胞内大量积累,同时以Real-time PCR检测WNT信号下游靶标基因表达情况。
本实验用细胞荧光及Western Blotting检测经Wnt3a连续培养21 d后ES-E14TG2a细胞中β-catenin蛋白的含量,发现与未经Wnt3a处理的ES-E14TG2a细胞相比β-catenin蛋白在细胞内的含量明显增加,说明ES-E14TG2a小鼠ESC经Wnt3a连续培养21 d后经典的Wnt/β-catenin信号通路可能被激活,通过Wnt3a蛋白与跨膜受体Frizzled结合,将胞外信号传递给胞内散乱蛋白,激活的散乱蛋白能促进GSK-3β等物质磷酸化,使β-catenin蛋白从轴蛋白上脱落,破坏了蛋白降解复合体,使得β-catenin蛋白不能被降解,从而大量游离的β-catenin蛋白在胞质中聚集。细胞内积累的β-catenin蛋白会进入细胞核启动下游基因的表达,通过相对定量发现Pitx2、Frizzled、Sox17、Oct4这些WNT信号的下游靶标基因在ES-E14TG2a细胞经Wnt3a连续培养21 d的过程中表达量均有不同程度的增加,进一步说明WNT信号在诱导的过程中处于被激活的状态,其中Pitx2、Sox17为中胚层标志基因,其表达量的增加说明Wnt信号通路的激活可以促进ESC向中胚层发育,Oct4基因对ESC自我更新和全能性的维持具有核心的调控作用,Oct4的高表达对克隆的形成具有促进作用[16],由于21 d时检测到的Oct4基因的表达量有所降低,说明该细胞的未分化潜能有所下降,因此不考虑更长时间的诱导。
综上,Wnt3a长期持续作用于培养中的ESC,调控激活 Wnt/β-catenin信号通路,从而启动向造血祖细胞群体的分化,无疑对小鼠ESC向中胚层干或祖细胞高效增殖这一理论提供了证据,为研究造血发育及干细胞自我更新、分化机制提供很好的模型。
1 Keller G. Embryonic stem cell differentiation: emergence of a new era in biology and medicine[J]. Genes Dev,2005,19(10):1129-1155.
2 Ogawa K, Nishinakamura R, Iwamatsu Y, et al. Synergistic action of Wnt and LIF in maintaining pluripotency of mouse ES cells Shimosato[J]. Biochem Biophys Res Commun, 343(1):159-166.
3 Lindsley RC, Gill JG, Kyba M, et al. Canonical Wnt signaling is required for development of embryonic stem cell-derived mesoderm[J]. Development, 133(19),3787-3796.
4 Gadue P, Huber TL, Paddison PJ, et al. Wnt and TGF-beta signaling are required for the induction of an in vitro model of primitive streak formation using embryonic stem cells[J].Proc Natl Acad Sci USA, 2006, 103(45):16806-16811.
5 徐兰,刘敏英.小鼠胚胎干细胞的培养—饲养层的制是[J].细胞生物学杂志, 2009, 32(2):291-292.
6 Evan M, Kaufman MH. Establishment in culture of plurpotental cells from mouse embryos[J]. Nature, 1981,292(9):154-156.
7 Martin GR. Isolation of a Pluripotent cell lines from early mouse embryos culture in medium conditioned by teratocarcinoma stem cell [J].Proc Natl Acad Sci USA,1981, 78(12):7634-7638.
8 Kimelman D, Griffin KJ. Vertebrate mesendoderm induction and patterning[J]. Curr Opin Genet Dev, 2000,10(4): 350-356.
9 Rodaway A, Patient R. Mesendoderm: an ancient germ layer?[J]. Cell, 2001, 105(2): 169-172.
10 Huelsken J, Vogel R, Brinkmann V, et al. Requirement for beta-catenin in anterior-posterior axis formation in mice[J].J Cell Biol, 148(3):567-578.
11 Kelly OG, Pinson KI, Skarnes WC. The Wnt co-receptors Lrp5 and Lrp6 are essential for gastrulation in mice[J].Development, 2004,131(12), 2803-2815.
12 Dravid G, Ye Z, Hammond H, et al. Defining the Role of Wnt/β-Catenin Signaling in the Survival, Proliferation, and Self-Renewal of Human Embryonic Stem Cells[J]. Stem Cells, 2005, 23(10), 1489-1501.
13 Cai L, Ye Z, Zhou BY, et al. Promoting human embryonic stem cell renewal or differentiation by modulating Wnt signal and culture conditions[J]. Cell Res, 2007, 17(1):62-72.
14 Gregorieff A, Clevers H. Wnt signaling in the intestinal epithelium: from endoderm to cancer[J]. Genes Dev, 2005,19(8):877-890.
15 Gordon MD, Nusse R. Wnt signaling: multiple pathways,multiple receptors, and multiple transcription factors[J]. J Biol Chem. 2006, 281(32):22429-22433.
16 刘娜,陆敏.胚胎干细胞自我更新相关信号转导途径及信号分子[J].科学通报, 2005, 50(7):623-628.
