伏格列波糖胶囊治疗2型糖尿病的多中心、随机、双盲、平行对照临床试验
2013-10-25叶龙彬苗红宁光刘志民刘伟刘超王长江
叶龙彬 苗红 宁光 刘志民 刘伟 刘超 王长江
(1. 上海医药集团股份有限公司中央研究院 上海 201203;2. 上海交通大学医学院附属瑞金医院 上海200025;3. 上海长征医院 上海 200003;4. 上海交通大学医学院附属仁济医院 上海 200001;5. 南京医科大学第一附属医院 南京 210029;6. 安徽医科大学第一附属医院 合肥 230022)
伏格列波糖(voglibose)是一种新型口服降糖药,它是从放线菌培养液中发现的氨基糖类似物,属于α-葡萄糖苷酶抑制剂,能竞争性抑制小肠黏膜表面的双糖类水解酶,进而延缓碳水化合物的消化和吸收,改善餐后高血糖,同时不伴有内源性胰岛素分泌的增加。伏格列波糖片由日本武田制药公司开发研制,于1994年在日本批准上市,1999年在我国上市,商品名为倍欣[1]。据国内外临床资料表明,该药起效迅速,降糖效果好,不良反应(尤其是低血糖)少且程度较轻,是一种安全有效的降糖药物[2]。本试验经国家食品药品监督管理局批准(2004L00410),以伏格列波糖片为对照,对国产伏格列波糖胶囊治疗2型糖尿病开展了多中心临床研究,为临床合理用药提供试验依据。
1 材料、对象与方法
1.1 试验设计
本试验采用多中心、随机、双盲双模拟、平行对照的试验设计,该方案获得上海交通大学医学院附属瑞金医院伦理委员会批准。
1.2 受试者选择
1)入选标准: 2型糖尿病患者(1997年ADA标准),病程6个月以上;入选时年龄18~65岁,男女均可;受试者接受饮食治疗、运动治疗或磺酰脲类降血糖药物治疗3个月以上,药物剂量稳定1个月以上;受试者入选时空腹血糖≥7.0 mmol/L但<11.0 mmol/L;育龄期妇女必须有有效的避孕措施;自愿参加并签署知情同意书。
2)排除标准:孕妇、哺乳期或计划在试验期内妊娠的妇女;受试者在首次服用本药前3个月内服用了其他试验药物;受试者收缩压>180 mmHg或舒张压>100 mmHg;严重的心脏病、心肌梗塞、不稳定心绞痛、慢性心功能不全,心电图显示有左心室肥厚者;有明确的肝脏疾病,丙氨酸氨基转移酶(ALT)高于正常上限2倍;有慢性肾脏疾病,血肌酐高于正常上限1.5倍;有严重的糖尿病慢性并发症;正在用胰岛素治疗者;有酗酒或有吸毒史者;对α-糖苷酶抑制剂类药物有过敏史;合并使用影响糖代谢的药物,如糖皮质激素等;有明显消化吸收障碍的慢性肠功能紊乱者,以及其它内分泌疾病:如甲状腺机能亢进、皮质醇增多症、肢端肥大症等;受试者血白细胞计数<4.0×109/L或血小板计数<90×109/L;筛选期间前后2次空腹血糖水平差值超过2.5 mmol/L(毛细血糖)。
3)退出和剔除标准:对本药过敏或不能耐受者;因不良事件或其它原因停止服用试验药物者;未按试验要求服用试验药物,依从性<80%或>120%者;治疗中出现空腹血糖(毛细血糖)>13.5 mmol/L(间隔5 d,连续2次);病人不合作,不遵守饮食控制,不按计划完成随访计划,随意更改口服降血糖药物者;试验过程中受试者出现ALT大于2倍正常上限(1周内连续2次)。
1.3 试验药物
伏格列波糖胶囊,规格:0.2 mg/粒,批号:20051011,上海三维制药有限公司生产并提供;伏格列波糖片,规格:0.2 mg/片,批号:050802,天津武田药品有限公司生产,上海医药集团股份有限公司提供;伏格列波糖胶囊和片剂模拟剂,外观、形状和大小、包装及内容物外观与原药无差异,组分按原配方,不含有效成分,上海医药集团股份有限公司提供。
1.4 分组与给药方法
按方案要求需240例受试者(试验组与对照组各120例),分5个中心完成。由SAS统计软件包,按照1∶1的比例用区组随机化方法产生随机数并生成药物编号1~240。符合入选标准的患者按进入试验的顺序,依次获得药品编号和相应的药品,该药品编号在整个试验过程中保持不变。
清洗期(2周):由内分泌医师和营养师对病人进行饮食及运动指导,原用磺脲类降糖药物治疗者治疗方案不变,不用影响血糖的其他药物。
药物治疗期(12周):试验组口服1粒伏格列波糖胶囊+1片伏格列波糖片模拟剂,每日3次;对照组口服1粒伏格列波糖胶囊模拟剂+1片伏格列波糖片,每日3次,均为餐前即刻口服,服药后立即进餐,连续服药12周。
1.5 观察与评价指标
主要疗效评价指标:餐后2 h血糖、糖化血红蛋白(HbAlc)。次要疗效评价指标:餐后1 h血糖、空腹血糖、血脂。安全性指标:患者用药依从性分析、生命体征、不良事件、肝肾功能、血常规、尿常规、心电图检查。
分别于服药后的第2、4、8、12周随访,记录有效性及安全性的指标变化。
1.6 统计分析方法
由泰格医药科技有限公司采用SAS 8.2统计分析软件完成。所有的统计检验均采用双侧检验,P值小于或等于0.05将被认为所检验的差别有统计意义。
1)两组可比性比较:对于人口学资料,受试者基本数据进行两组可比性比较,采用FAS数据集,统计检验方法采用x2检验或Fisher精确检验、t检验、非参数统计方法或CMH分析方法。
2)疗效评价:本研究对主要疗效指标作等效性检验,采用协方差分析模型,以基线值为协变量,采用95%可信区间的方法:可信区间在临床专业认可的范围内,判断为等效,否则为非等效。
差值的95% CI=(µ试验组-µ对照组)±1.96×合并标准误差。
两组下降值的差值的95%CI的范围在-δ~δ之间,可认为试验组与对照组相比为等效(δ=0.4)。
试验组和对照组其它计量资料采用考虑中心效应的方差分析模型。分类、等级资料采用考虑中心效应的CMH方法。
3)安全性评价:主要采用统计描述的方法,逐例分析不良事件的程度,持续时间与药物的关系,转归。逐例分析实验室数据治疗前后异常的转换,必要时用x2作统计检验。
2 结果
2.1 总体完成情况
本次研究共纳入239例受试者,在试验期间因各种原因脱落或剔除的病例15例;其中试验组3例,对照组11例。其中纳入全分析集(Full Analysis Set,简称FAS)分析的病例试验组118例,对照组119例;纳入符合方案集(Per-protocol Set,简称PPS)分析的试验组116例,对照组108例;纳入安全集(Safety Set,简称SS)分析的试验组118例,对照组119例。
2.2 入选者人口学资料
试验组和对照组的性别、年龄、体重、BMI、血压、心率的均值相近,差异无统计学意义;两组在吸烟、饮酒人数的分布上亦相近,无显著性差异(P>0.05)。
2.3 疗效评价
2.3.1 治疗前主、次要疗效指标各基础值比较
试验组和对照组治疗前空腹血糖(毛细血管)、餐后1 h血糖(毛细血管)、餐后2 h血糖(毛细血管)、空腹血糖(静脉)、餐后1 h血糖(静脉)、餐后2 h血糖(静脉)、HbAlc等基础值,两组间无显著性差异,表明两组具有良好的可比性(表1)。
2.3.2 主要疗效指标(FAS集)
2.3.2.1 餐后2 h血糖
用药12周后,试验组和对照组的餐后2 h血糖(毛细血管)和餐后2 h血糖(静脉)均有明显下降,2组治疗前后组内比较差异均有统计学意义(P<0.001);组间差异均无统计学意义(P>0.05)。
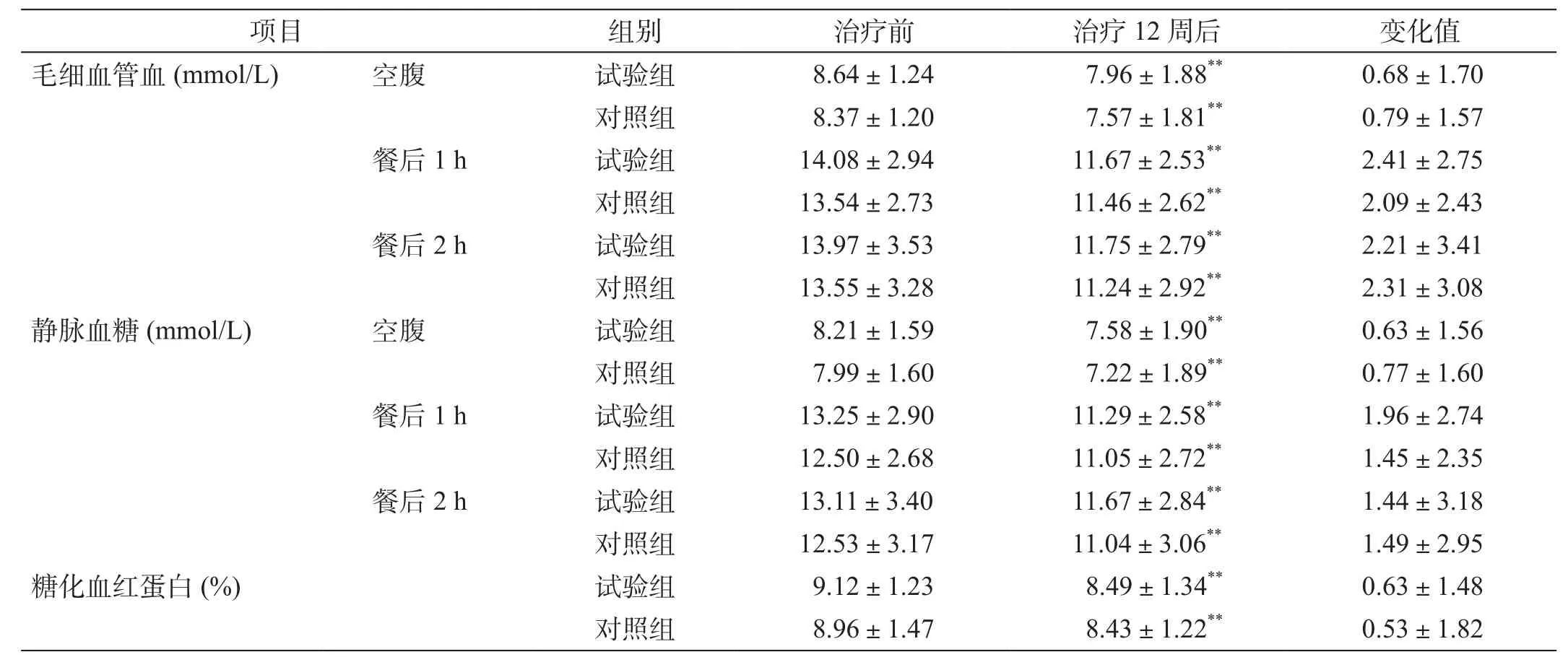
表1 两组治疗前后血糖和糖化血红蛋白的比较
2.3.2.2 糖化血红蛋白
用药12周后,试验组和对照组的HbAlc均有明显下降,2组治疗前后组内比较差异有统计学意义(P<0.001);组间差异无统计学意义(P>0.05)。2组HbAlc下降值的等效性检验(等效界值取0.4)结果显示,经HbAlc基线校正后,2组下降值的差值为-0.0355%(95%CI:-0.3574~0.2864),试验组和对照组等效。
2.3.3 次要疗效指标(FAS集)
2.3.3.1 空腹血糖
用药12周后,试验组和对照组的空腹血糖均有明显下降,2组治疗前后组内比较差异均有统计学意义(P<0.001);组间差异均无统计学意义(P>0.05)。
2.3.3.2 餐后1 h血糖
用药12周后,试验组和对照组的餐后1 h血糖(毛细血管)和餐后1 h血糖(静脉)均有明显下降,2组治疗前后组内比较差异均有统计学意义(P<0.001);组间差异均无统计学意义(P>0.05)。
2.4 安全性评价
本临床试验中共出现2例严重不良事件,分别为尿路感染和缺血性肠炎各1例。试验组为0,对照组为1.68%,两组总严重不良事件的发生率无显著性差异(P>0.05),各严重不良事件的发生率也无显著性差异(P>0.05)。
试验中共有2例患者因不良事件而退出试验,其中试验组0例;对照组2例,主要为腹胀、头昏、缺血性肠炎。
试验中共发生不良反应17例,试验组发生不良反应10例(8.47%);对照组有7例不良反应(5.88%)。两组不良反应发生率无统计学差异(P>0.05)。试验组较常见的不良反应有便干(0.85%)、恶心(1.69%)、乏力(0.85%)、腹泻(2.54%)、腹胀(3.39%)、排气多(0.84%)、头晕(2.54%)、胀气(2.54%)等。对照组较常见的不良反应为大便次数多(0.84%)、腹泻(3.36%)、腹胀(3.36%)、口干(0.84%)、排气多(0.84%)、头昏(0.84%)等。
试验组和对照组虽均有少部分病人血、尿常规、肝肾功能、心电图检测结果出现轻度异常,但研究者判断只有2例总胆红素升高可能与试验药物有关,其余均与试验药物没有因果关系。
3 讨论
伏格列波糖是一种α-葡萄糖苷酶抑制剂,其作用机理是竞争抑制小肠黏膜麦芽糖酶、异麦芽糖酶、糖苷酶等,使双糖向单糖分解减少,导致D-葡萄糖形成减少,对胰腺的α-淀粉酶作用弱,口服后可延缓淀粉和蔗糖的消化吸收,从而降低血糖,尤其是对餐后高血糖的控制,小剂量的本品即能使血糖曲线峰值降低且较平坦,且胃肠道反应轻。
本试验结果显示,每日餐前即刻服用0.2 mg的伏格列波糖可有效降低2型糖尿病人的空腹及餐后血糖,显著降低HbA1c,其降血糖作用在第2周即已显效,12周时达到最大疗效。伏格列波糖胶囊组的空腹及餐后血糖下降值与伏格列波糖片组比较无显著性差异。参考国外文献[3-5]的等效性检验方法,计算两组HbA1c下降值的差值的95%可信区间,按等效界值δ=0.4判断,可以认为伏格列波糖胶囊的疗效与伏格列波糖片等效。两组的不良反应发生率比较也无显著性差异,不良反应主要表现为腹部胀满、排气增加等,一般出现在最初用药的几周内,并逐渐减轻,大多数患者可以耐受,无需停药,这与其他文献报道一致。
总之,伏格列波糖胶囊与伏格列波糖片具临床等效性,均能够明显降低血糖,特别是餐后血糖,从而明显改善HbAlc,是安全有效的治疗2型糖尿病的药物。
[1] 王家驰. 新一代α-糖苷酶抑制剂——伏格列波糖(倍欣)[J]. 中国糖尿病杂志, 1999, 7(2): 63-64.
[2] 王吉影, 顾耀, 徐乃馨, 等. 阿卡波糖和伏格列波糖治疗2型糖尿病的比较[J]. 同济大学学报(医学版), 2001,22(2): 32-35.
[3] Quattrin T, Bélanger A, Bohannon NJ, et al. Efficacy and safety of inhaled insulin (Exubera) compared with subcutaneous insulin therapy in patients with type 1 diabetes:results of a 6-month, randomized, comparative trial[J].Diabetes Care, 2004, 27(11): 2622-2627.
[4] Skyler JS, Weinstock RS, Raskin P, et al. Use of inhaled insulin in a basal/bolus insulin regimen in type 1 diabetic subjects: a 6-month, randomized, comparative trial[J].Diabetes Care, 2005, 28(7): 1630-1635.
[5] Home PD, Jones NP, Pocock SJ, et al. Rosiglitazone RECORD study: glucose control outcomes at 18 months[J].Diabetic Med, 2007, 24(6): 626-634.
