山矾科山矾属植物化学成分及药理活性研究概况
2013-10-25谢朋飞邹录惠黄桂坤袁经权
谢朋飞,邹录惠,邱 莉,黄桂坤,袁经权,2*
1广西医科大学药学院,南宁530021;2广西药用植物研究所,南宁 530023
山矾科(Symplocaceae)为双子叶植物,多为落叶或常绿落叶灌木或乔木,生于海拔1000 m以下丘陵、荒坡、灌木丛中。山矾科仅有山矾属Symplocos 1属,在全世界共有约300种,分布于热带和亚热带地区。该属植物在我国有约125余种,资源丰富,主要分布在我国长江以南地区。山矾属部分植物果实、枝叶和根均可供药用,主要具有清热解毒、理气止痛、止血生肌等作用[1,2]。
近年来,经药理活性筛选发现山矾属部分植物具有很好的降血糖、调血脂及抗肿瘤活性,成为新药研究人员关注热点之一。本文旨在综述国内外山矾属植物化学成分与药理活性研究情况,以备研究参考。
1 化学成分
山矾属植物中含有多种化学成分,主要含有三萜及其苷类,还有黄酮类、木脂素及其苷类、生物碱类、甾醇及其苷类、酚类、环烯醚萜苷类等成分。对山矾属植物化学成分的研究报道始见于1968年[3],此后,国内外学者对该属植物进行了大量的化学成分研究。
1.1 三萜及其苷类
三萜类皂苷是近年来山矾属植物化学成分研究热点,苷元主要为五环三萜,母核骨架主要为齐墩果烷型、乌苏烷型及羽扇烷型,A/B/C环为反式骈合排列;C-12位常有双键;C-8位、C-10位有β-CH3取代,C-14位有α-CH3取代;C-3位多有羟基或羰基取代。C-3位及C-28位多见苷化,糖链常见组成为葡萄糖醛酸、葡萄糖、及呋喃型阿拉伯糖。其具体内容见表1和图1。

表1 山矾属中的三萜及其苷类Table 1 Triterpenoids from the Genus Symplocos

51 9β,25-cyclo 3β-O-(β-D-glucopyranosyl)-echynocystic acid S.paniculata [18]52 30-ethyl 2α,16α-dihydroxy 3β-O-(β-D-glucopyranosyl)hopan-24-oic acid S.paniculata [18]53 2α,3β,19α,23-tetrahydroxy-12-oleanen-28-oic acid 28-β-D-glucopyranosyl ester S.caudata [19]54 2α,3β,19α,23-tetrahydroxy-12-ursen-28-oic acid 28-β-D-glucopyranosyl ester S.caudata [19]55 2α,3β,19α,23,24-pentahydroxyl-12-oleanen-28-oic acid 28-β-D-glucopyranosyl ester S.caudata [19]56 2α,3β,19α,23,24-pentahydroxyl-12-ursen-28-oic acid 28-β-D-glucopyranosyl ester S.caudata [19]57 3β,17β-dihydroxy-28-nor-12-oleanen-16-one 3-O-β-D-galactopyranosyl(1→2)-﹛ α-L-arabinopyranosyl-(1→3)-[α-L-arabinofuranosyl(1→4)]-β-D-glucuronopyranoside ﹜S.caudata [19]58 3-O-[β-D-glucopyranosyl]-28-O-[α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranosyl]maslinic acid S.lancifolia [20]59 3-O-[β-D-glucopyranosyl]-28-O-[α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranosyl]arjunlic acid S.lancifolia [20]60 3-O-[β-D-glucopyranosyl]-28-O-[α-L-rhamnopyranosyl-(1→2)-β-D-glucopyranosyl]asiatic acid S.lancifolia [20]61 2α,3β,11α,23-tetrahydroxyurs-12-en-28-oic acid S.lancifolia [20]
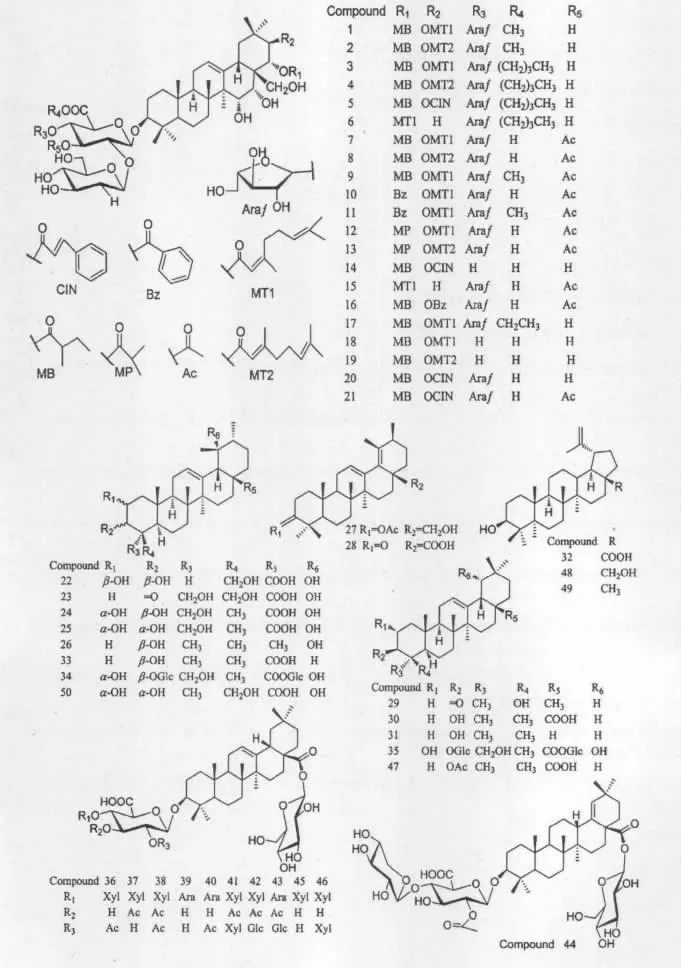
图1 山矾属中三萜及其苷类化合物结构Fig.1 Structures of Triterpenoids from the genus Symplocos
1.2 木脂素及其苷类
Ogiyama等[21]首先报道从 S.lucida 中分离得到一些木脂素类,如 Symplocosigenol;Hiroyuki等[22]从S.lucida的叶子中分离得到木脂苷类(-)-Pinoresinol β-D-glucoside 和 β-D-glucosideof(-)-Pinoresinol monomethylether。Huo等[24]从 S.caudata 根中分离鉴定出四个光学异构体的木脂素糖苷(75~78),木脂素内酯糖苷(67,79),苯丙糖苷(80,81),见表2及图2。

表2 山矾属中的木脂素及其苷类化合物Table 2 Lignans from the Genus Symplocos

图2 山矾属木脂素及其苷类化合物结构Fig.2 Structures of Lignans from the genus Symplocos
1.3 黄酮及其苷类
近年来,国内外学者对山矾属植物中黄酮及其衍生物类研究较少,本文综述的黄酮类主要在1996年以前发现,主要有黄酮醇苷(84-90,97),黄烷衍生物黄烷3-醇及其苷(91-95,98)和二氢查耳酮苷(96,99-102)等,见表3,结构见图3。

表3 山矾属中黄酮类化合物Table 3 Flavonoids from the Genus Symplocos

96 Phlorizin S.spicata [9]97 Rhamenetin-3-O-β-D-galactosyl-4-O-β-D-galactopyranoside S.spicata [27]98 5,7,4'-Trihydroxyflavan-3,4-diol 3-O-β-D-glucopyranoside S.spicata [3]99 Confusoside S.microcalyx [28]100 Trilobatin S.microcalyx [28]101 Vacciniifolin S.vacciniifolia [29]102 Sieboldin S.vacciniifolia [29]103 flavone3',4',5',6-tetramethoxy7-O-β-D-glucopyranosyl(1→3)β-D-glucopyranoside S.paniculata [18]

图3 山矾属黄酮及其苷类化合物结构Fig.3 Structures of Flavonoids from the genus Symplocos
1.4 酚类
Jiang等[23]从 S.caudata 根部位得到酚类物质(1S,2R)-1-(4'-O-β-D-Glucopyranosy 1-3'-methoxyphenyl)-2-(4"-hydroxy-3"-methoxyphenyl)-1,3-propanediol(112)和 3,4-Dime thoxyphenol-β-D-apiofuranosyl-(1→6)-β-D-glucopy-ranoside(113);Ahmad等[32]从S.racemosa植物的皮中分离得到两个新的酚苷SymconosideA(116)和 Symconoside B(117)。其具体内容见表4和图4。

表4 山矾属中酚类化合物Table 4 Phenols from the Genus Symplocos

117 Symconoside B S.racemosa [32]118 symplocuronic acid S.racemosa [33]119 sympocemoside S.racemosa [33]120 salirepin S.racemosa [33]

图4 山矾属酚类化合物结构Fig.4 Structures of Phenols from the genus Symplocos
1.5 其他类型化合物
环烯醚萜苷类:Isoe Y 等[34]首先从 S.glauca中得到了Verbenalin(121);Junko等[35]学者运用液质联用仪从S.glauca叶中分离鉴定了化合物6-Dihydroverbenalin(122)。生物碱类:Ishida 等[16]学者从S.setchuensis中分离得到一种具有抑制H9淋巴细胞HIV复制作用的物质Harman(123),并进行了相关衍生物的制备及药理活性试验;Tschesche等[36]从S.celastrinea Mart植物的皮中分离到山矾碱Caaverine(124)。类固醇类:Frotan 等[37]在 S.spicata中分离到类固醇 α-spinasterol(125);Semwal等[18]报道在S.paniculata茎中分离鉴定了三个甾体类化合物 androst-5(6)-ene 17-one 3β-O-(β-D-glucopyranoside);9β,19-cyclo24-methylcholan-5,22-diene3β-O-{β-D-glucopyranosyl(1→6)α-L-rhamnopyranoside};32,33,34-trimethyl– bacteriohopan-16-ene 3-O-β-D-glucopyranoside(126 ~ 128);Huo等[25]在S.caudata根中得到一个新的脑苷类化合物1-O-β-D-glucopyranosyl-(2S,3S,4R,8Z,12E)-2-N-[(2'R)-2'-hydroxyheptacosanoyl]-8,12-docosadiene-1,3,4-triol(129);Kumar 等[38]从 S.paniculata 叶的石油醚(68~80°)部位得到豆甾醇,羽扇豆醇及28碳的烃类化合物。其结构见图5。

图5 山矾属其他类型化合物Fig.5 Other type of compounds from the genus Symplocos
2 药理活性
2.1 抗血纤维蛋白溶解活性
1989 年,Rashmi等[9]报道了 S.racemosa 植物树皮醇提物具有很好的抗纤维蛋白溶解活性,并通过体外抗尿激酶的血纤维板实验证实Symposide(91)和其苷(-)-Epiafzelechin(92)两个黄烷类物质为活性化合物。
2.2 抗菌抗炎活性
Khan 等[39]对 S.cochinensis植物的根、茎、叶醇提物及其石油醚、二氯甲烷、乙酸乙酯部位的抗菌活性进行了筛选,结果显示上述粗提物部位均具有广谱的抗菌活性;Devmurari等[40]对 S.racemosa Roxb树皮醇提物及石油醚提取物进行抗菌活性评价发现其醇提物具有很好的抗菌活性;Kambhoja等[41]发现S.racemosa树皮醇提物具有很好的抗炎活性。Vadivu 等[42]对 S.cochinensis叶的甲醇提取物进行体内外抗炎活性筛选,研究发现该提取物能显著提高人红细胞膜的稳定性和减少角叉菜胶引起的大鼠脚趾水肿。Castellon等[20]从 S.lancifolia叶中分得三萜类化合物(58~61),并对其进行抗菌活性筛选发现其对革兰氏阳性菌和葡萄球菌有较强活性而对大肠杆菌和绿脓杆菌作用较弱。Frotan等[37]在S.spicata中分离到类固醇α-spinasterol(125),并发现其对角叉菜胶引起的大鼠脚趾炎症有疗效。
2.3 抗HIV活性
Ishida等[16]报道 S.setchuensis茎乙醇提取物能有效抑制H9淋巴细胞HIV复制(EC50<20 mg·mL-1,TI>5),随后采用活性跟踪的方法从该部位分离鉴定了两个具有较好的活性的单体化合物Matairesinol(66)(IC50=21.9 μM,EC50=2.0 μM,TI=11.0)和 Harman(123)(IC50=111.5 μM,EC50=10.7 μM,TI=10.4)。
2.4 抗肿瘤活性
山矾属植物中的三萜类成分具有显著的抗肿瘤活性。庾石山课题组发现S.chinensis根乙醇提取物的乙酸乙酯部位和正丁醇部位具有抗肿瘤活性,并通过活性追踪方法分离鉴定了乌苏烷型化合物2β,3β,19α,24-Tetrahydroxy-23-norurs-12-en-28-oic acid(22),并发现其对小鼠黑色素瘤细胞B16(IC50=0.068 μM)和人胃癌细胞 BGC-823(IC50=0.025 μM)具有较强的抑制作用,而对小鼠黑色素瘤细胞B16-BL6(IC50=0.26 μM)和人肾癌细胞 Ketr-3(IC50=0.35 μM)抑制作用相对较弱[8]。Tang 等[4]对6个从S.chinensis植物根中分得的三萜类化合物进行体外抗肿瘤活性筛选,发现Symplocososide C(3)对人肠癌细胞 HCT-8(IC50=2.86 μg·mL-1)抑制作用较强;Symplocososide F(6)对HCT-8(IC50=4.04 μg·mL-1),人胃癌细胞 BGC-823(IC50=7.29 μg·mL-1)有抑制作用;Symplocososide A(1)对人肺癌细胞A549(IC50=0.67 μg·mL-1),人口腔癌KB(IC50=1.72 μg·mL-1)抑制作用较强,并且,值得注意的是:Symplocososide A(1)水解衍生物能选择性抑制KB,其抑制率超过对正常细胞33倍。Bhuvan等[43]研究发现 S.racemosa正丁醇及乙酸乙酯部分均表现出很强的细胞毒性,并呈剂量依赖性抑制细胞增殖,其中,正丁醇部分对人白血病细胞HL-60(IC50=27.18 μg·mL-1),HeLa 细胞(IC50=22.86 μg·mL-1)细胞毒性较强,而乙酸乙酯部分对其作用较弱 IC50分别为 117.08 μg·mL-1,137.15 μg·mL-1。
2.5 抑制磷酸二酯酶(PDEs)活性
Ahmad 等[12,30]从 S.racemosa 中分得酚苷类物质,并发现其能有效抑制蛇毒磷酸二酯酶Ⅰ的活性,其中,化合物Benzoyl salireposide(104)显示出较强的活性(IC50=171 μM),而化合物 Symplomoside(107)活性较弱(IC50=998 μM)。Choudhary 等[44]研究发现化合物Benzoyl salireposide(104)和Salireposide(105)能明显抑制人核苷酸内焦磷酸酶/磷酸二酯酶Ⅰ,IC50分别为90 μM 和 383 μM,其作用机制尚待进一步研究,但其对于治疗关节炎疾病具有很大的药用潜力。
2.6 抗氧化活性
Vijayabaskaran等[45]通过DMBA诱导大鼠急性肝损伤模型对S.racemosa醇提物护肝及抗氧化活性进行评价,发现其具有很好的护肝活性,并推测可能原因是S.racemosa醇提物在肝细胞内发挥抗氧化作用。Sunil等[46,48]研究发现 S.cochinchinensis叶甲醇提取物在体内外均显示出很好的抗氧化活性,具有较强的清除 DPPH、Hydroxyl、Nitric oxide等自由基活性及抑制脂质过氧化作用。
2.7 降血糖、调血脂活性
Sunil等[47]研究发现 S.cochinchinensis叶的正己烷提取物对高脂饮食-低链脲霉素诱导的Ⅱ型糖尿病模型大鼠有疗效,模型组大鼠经该提取物分别以250 mg·Kg-1和500 mg·Kg-1治疗28 d后其血糖水平分别下降了17.04%和42.10%,模型组大鼠血浆及肝脏总胆固醇TC,甘油三酯TG及游离脂肪酸FAF水平明显降低,而肝糖原显著增加。Sunil等[48]进一步对 S.cochinchinensis树皮甲醇提取物进行降血糖、调血脂活性研究,发现经该提取物治疗的模型组大鼠血清中TC、TG、及低密度脂蛋白胆固醇LDL-C水平明显降低,而高密度脂蛋白胆固醇HDLC水平显著增加。Sunil等[49]通过建立Triton WR-1339诱导高脂血症大鼠模型和高脂饮食诱导的高脂血症大鼠模型对S.cochinchinensis叶降血脂活性进行评价,研究发现S.cochinchinensis叶正己烷部分(250 mg·Kg-1和500 mg·Kg-1)相比于乙酸乙酯及甲醇部分显示出更好的降血脂活性,而且正己烷部分能明显降低高脂饮食模型组大鼠血浆和肝脏血脂水平。
3 结语
本文系统综述了山矾属植物化学成分及药理活性的研究概况,为进一步开发利用该属植物药用资源提供参考。山矾属植物民间药用价值多样,国内外学者仅对该属少数植物进行了化学和药理学研究,部分阐明其民间药用理论基础。此外,相关文献报道对该属部分植物的生物活性研究仅进行了体外初步筛选,因此,有必要参照其民间药用价值对其进行针对性的现代药理活性实验及作用机制研究,以期从该属植物开发出现代药物。我们应该重视山矾属植物在抗肿瘤、抗HIV、抑制PDEs活性方面的研究,特别是近期发现该属植物S.cochinchinensis粗提物在降血糖、调血脂方面具有很好的活性,有待进一步研究开发。在今后的研究中应注重山矾属植物资源活性评价及其他药用部位中的活性组分研究,阐明其药用物质基础及机制,并以活性追踪方法对该属植物化学成分进行分离分析;深入研究山矾属植物中主要抗肿瘤活性成分三萜类的构效关系,进行结构修饰和结构改造,以期寻找到高效、低毒和高特异性的抗肿瘤先导化合物。
1 Editorial Committee of Chinese Herb(国家中医药管理局中华本草编委会).Chinese Herb(中华本草).Shanghai:Shanghai Science and Technology Press,1999.146.
2 Guo XZ(郭晓庄).A Dictionary of Poisonous Chinese Herbal Medicines(有毒中草药大辞典).Tianjin:Tianjin Science and Technology Translation Publishing Company,1992.223.
3 Naintara V,et al.A review of leucoanthocyanidin chemistry is presented.Univ Allahabad Stud(ChenSect),1968,32.
4 Tang MJ,et al.Cytotoxic Triterpenoid Saponins from Symplocos chinensis.J Nat Prod,2004,67:1969-1974.
5 Fu GM,et al.Five New Cytotoxic Triterpenoid Saponins from the Roots of Symplocos chinensis.Planta Med,2005,71:666-672.
6 Fu GM,et al.Cytotoxic Oxygenated Triterpenoid Saponins from Symplocos chinensis.J Nat Prod,2006,69:1680-1686.
7 Zhao J,Yu SS.Two new triterpenoid saponins from Symplocos Chinensis.J Asian Nat Prod Res,2005,7:791-797.
8 Li XH,et al.Bioactive triterpenoids from Symplocos chinensis.J Asian Nat Prod Res,2003,5:49-56.
9 Rashmi D,et al.Symposide,a new antifibrinolytic glycoside from Symplocos racemosa Roxb.Indian J Chem Sect,1989,28B:982-983.
10 Ali M,et al.Investigations of medicinal plants.Part14.Triterpenoids from Symplocos racemosa bark.Phytochemistry,1990,29:3601-3604.
11 DeSilva LB,et al.The chemical constituents of Symplocos racemosa Roxb.J Nat Sci Counc Sri Lanka,1979,7:1-3.
12 Ahmad VU,et al.Phenolic glycosides from Symplocos racemosa:natural inhibitors of phosphodiesterase I.Phytochemisty,2003,63:217-220.
13 Lin LC,et al.Studies on the constituents of Symplocos lancifolia.Chin Pharm J,1996,48:441-449.
14 Hinguchi R,et al.Triterpenoid saponins from the stem bark of Symplocos spicata.Phytochemistry,1982,21:907-910.
15 Pierre WT,et al.Acetylated glucuronide triterpene bidesmosidic saponins from Symplocos glomerata.Phytochemistry,2004,65:741-750.
16 Ishida J,et al.Anti-AIDS agents.46.Anti-HIV activity of Harman,an anti-HIV principle from Symplocos setchuensis,and its derivatives.J Nat Prod,2001,64:958-960.
17 Na MK,et al.Inhibition of Protein tyrosine phosphatase 1B by Ursane-type triterpenes isolated from Symplocos paniculata.Planta Med,2006,72:261-263.
18 Semwal RB,et al.Chemical constituents from the stem bark of Symplocos paniculata Thunb.with antimicrobial,analgesic and anti-inflammatory activities.J Ethnopharmacol,2011,135:78-87.
19 Jiang JS,et al.A new nortriterpenoid saponinfrom the roots of Symplocos caudata Wall.J Asian Nat Prod Res,2011,13:276-280.
20 Castellon ILA,et al.Triterpenoid saponins from Symplocos lancifolia.J Nat Prod,2011,74:163-168.
21 Ogiyama K,Kondo T.Studies on the Chemical Constituents of Bark of Symplocos lucida SIEB.et ZUCC.VI.On the Configuration of Symplocosigenol.Nippon Mokuzai Gakkaishi,1965,11:65.
22 Hiroyuki I,et al.lignan glucosides of Symplocos lucida.Yakugaku Zasshi,1973,93:44-46.
23 Jiang JS,et al.New Phenolics from the Roots of Symplocos caudata WALL.Chem Pharm Bull,2005,53:110-113.
24 Huo CH,et al.Neolignan glycosides from Symplocos caudate.Phytochemistry,2008,69,788-795.
25 Huo CH,et al.New neolignan glycosides and a new cerebroside from Symplocos caudate.Chem Nat Compd,2010,46:343-347.
26 Tschesche R,et al.Symplocoside,a flavanol glycoside from Symplocos uniflora.Phytochemistry,1980,19:1825-1829.
27 Tiwari RD,Tripathi HL.A new flavonol glycoside from the leaves of Symplocos spicata.Phytochemistry,1976,15:833.
28 Hiroshi M,et al.Isolation,determination and synthesis of confusoside,a minor dihydrochalcone glycoside from Symplocos microcalyx Hay.Shoyakugaku Zasshi,1985,39:312-315.
29 Ling TJ,et al.Dihydrochalcones from Symplocos vacciniifolia.Chin Chem Lett,2004,15:1182-1184.
30 Ahmad VU,et al.Phosphodiesterase-Inhibiting Glycosides from Symplocos racemosa.Helv Chim Acta,2004,87:67-72.
31 Abbasi MA,et al.Phosphodiesterase and thymidine phosphorylase-inhibiting salirepin derivatives from Symplocos racemosa.Planta Med,2004,70:1189-1194.
32 Ahmad VU,et al.Phenolic Glycosides from Symplocos racemosa.Z Naturforsch B,2005,60:1101-1104.
33 Ahmad VU,et al.New salirepin derivatives from Symplocos racemosa.J Asian Nat Prod Res,2007,9:209-215.
34 Isoe Y.Abstracts of papers,24th annual meeting of the chemical society of Japan,1977.1801.
35 Junko I,et al.Identification of a new minor iridoid glycoside in Symplocos glauca by thermospray liquid chromatographymass spectrometry.J Chromatogr,1990,515:503-508.
36 Tschesche R,et al.Uber 2 Alkaloide aus der rinde von Symplocos celastrinea mart.Tetrahedron,1964,20:1435-1447.
37 Frotan MH,et al.Pharmacological investigations on α-spinasterol isolated from Symplocos spicata.Indian J Pharmacol,1983,15:197-201.
38 Kumar N,Jangwan JS.Phytoconstituents of Symplocos paniculata(Leaves).J Cur Chem Pharm Sc,2012,2:76-80.
39 Khan MR,et al.Antimicrobial activity of Symplocos cochinensis.Fitoterapia,2001,72:825-828.
40 Devmurari VP.Antibacterial evaluation and Phytochemical screening of Symplocos racemosa Roxb.Int J PharmTech Res,2010,2:1359-1363.
41 Kambhoja S,Keshava MKR.Phytochemical and pharmacological studies on bark of Symplocos racemosa Roxb.Iran J Pharm Res,2004,3(2):44-44.
42 Vadivu R,Lakshmi KS.In vitro and in vivo anti-inflammatory activity of leaves of Symplocos cochinensi(Lour)Moore ssp laurina.Bangladesh J Pharmacol,2008,3:121-124.
43 Bhuvan RP,et al.Potent in vitro anticancer activity of Symplocos racemosa Bark.Rom J Biol Plant Biol 2009,54:135-140.
44 Choudhary MI,et al.Phenolic glyscosides,a new class of human recombinant nucleotide pyrophosphatase phosphodiesterase-1 inhibitors.Bioorg Med Chem,2004,12:5793-5798.
45 Vijayabaskaran M,et al.Hepatoprotective and antioxidant activity of Symplocos racemosa bark extract on DMBA induced hepatocellular carcinoma in rats.Int J Curr Trends Sci Tech,2010,1:147-158.
46 Sunil C,Ignacimuthu S.In vitro and in vivo antioxidant activity of Symplocos cochinchinensis S.Moore leaves containing phenolic compounds.Food Chem Toxicol,2011,49:1604-1609.
47 Sunil C,et al.Antidiabetic effect of Symplocos cochinchinensis(Lour.)S.Moore.in type 2 diabetic rats.J Ethnopharmacol,2011,134:298-304.
48 Sunil C,et al.In vitro antioxidant,antidiabetic and antilipidemic activities of Symplocos cochinchinensis(Lour.)S.Moore Bark.Food Chem Toxicol,2012,50:1547-1553.
49 Sunil C,et al.Hypolipidemic activity of Symplocos cochinchinensis S.Moore leaves in hyperlipidemic rats.J Nat Med,2012,66:32-38.
