沙苑子黄酮类化合物的响应面法优化提取及其清除DPPH自由基能力
2013-10-25张清安范学辉张志琪
张清安,范学辉,刘 梅,张志琪
1陕西师范大学食品工程与营养科学学院;2陕西师范大学体育学院;3陕西师范大学化学化工学院,西安 710062
沙苑子(Semen Astragali Complanati)为豆科植物扁茎黄芪(Astragalus complanatus R.Br.)干燥成熟的种子,在历代本草中曾以大沙苑、蔓黄芪等名称入药[1];由于含有丰富的酚类、萜类、多糖、铁、锌等功能成分,使其成为开发功能食品的良好原料。对于沙苑子的研究主要集中在药理作用[2]和化学成分方面[3]。而对于沙苑子中黄酮类物质的提取,除了作者所在课题组已开展过相关研究外[4,5],庞来祥[6]、于猛[7]、刘银芳[8]和李洪娟[9]等也分别采用乙醇溶液为提取剂、或采用正交设计或超声辅助手段研究了沙苑子总黄酮的提取工艺;但尚未见到采用甲醇为提取溶剂、响应面法优化超声辅助提取工艺并对提取物清除DPPH自由基能力进行研究的报道。
鉴于不同的提取溶剂和方法会直接影响提取物的成分、含量和活性,因此本文在提取温度、时间、料液比、原料粒度大小及溶剂浓度等单因素实验基础上,直接以提取物吸光度(采用提取物溶液的吸光度作比较可以简化实验步骤、减少原料及试剂用量)为评价指标,采用响应面分析法对沙苑子中黄酮类化合物的超声辅助提取工艺进行了优化;并在此基础上研究了提取物对DPPH自由基的清除能力,以期为有效利用和开发沙苑子提供理论依据和技术支撑。
1 材料与仪器
1.1 主要设备
TU-1810紫外可见分光光度仪,北京普析通用仪器有限责任公司;KQ3200B超声波清洗器,昆山市超声仪器有限公司;JA2003N电子天平,上海精密科学仪器有限公司;101型电热鼓风干燥箱,北京科伟永兴仪器有限公司;Alphal-4真空冷冻干燥机,德国christ公司;FW400A高速万能粉碎机,北京科伟永兴仪器有限公司。
1.2 原料与试剂
沙苑子:购于西安市西北药材市场,经王炳利教授鉴定为为豆科植物扁茎黄芪(Astragalus complanatus R.Br.)干燥成熟的种子。取适量沙苑子经粉碎后,分别过 20、40、60、80、100、120、140、160 目筛子,将所得沙苑子粉用石油醚回流8 h脱脂后晾干备用。
甲醇、石油醚购自天津市东丽区天大化学试剂厂;DPPH(二苯代苦味酰肼基自由基)购自Sigma公司。
2 实验方法
2.1 最佳吸收波长及溶剂极性对提取率的影响
分别精确称取140目沙苑子粉11份各1.000 g于三角瓶中,再分别对应加入体积分数为100%、90%、80%、70%、60%、50%、40%、30%、20%、10%和0%的甲醇提取溶液30 mL,封口膜密封后在50℃条件下超声(超声功率120 W,频率40 kHz,下同)30 min,过滤定并容至50 mL,从中吸取1 mL滤液再定容至10 mL,进行扫描(550 nm~190 nm),并测定最大吸收波长处的吸光度。
2.2 吸光度与沙苑子黄酮类提取物浓度间的换算关系
称取一定数量的沙苑子粉用60%甲醇溶液提取,滤液于真空旋转蒸发器中浓缩后冷冻干燥,备用。
称取一定量冻干物,用60%甲醇在超声作用下充分溶解并定容,再将其稀释配成一系列体积分数的待测溶液,在2.1所确定最大吸收波长处测定吸光度,将吸光度y与黄酮类提取物浓度x(mg/mL)进行线性回归得:Y=4.4219X+0.0448,相关系数R2为0.9902。因此,在以下面试验中仅以吸光度就可以快速比较沙苑子黄酮的提取率。
2.3 单因素试验
2.3.1 粒度大小
分别准确称取 20、40、60、80、100、120、140、160目沙苑子粉1.000 g于三角瓶中,并分别加入一定体积甲醇提取溶剂超声30 min,后将提取液过滤定容。取样并于2.1所确定吸收波长处测定吸光度。
2.3.2 液料比、提取温度和提取时间
按照上述操作方法,分别研究甲醇提取液为10、15、20、25、30、35、40、45 mL(提取温度和时间固定);或提取温度分别为 20、30、40、50、60、70、80 ℃(提取时间和料液比固定);或提取时间分别为10、20、30、40、50、60、70、80、90 min(料液比和温度固定)时对黄酮类物质提取率的影响。
2.4 响应面法优化提取工艺参数
综合前面单因素试验所得结果,选取对沙苑子黄酮提取液吸光度有较大影响的四个因素为研究参数,并以提取液吸光度为响应值(指标值),做四因素三水平BBD优化试验。响应面分析所用二次多项式公式为:
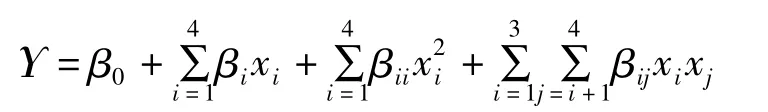
β0、βi、βii、βij分别代表常数项、一次项、二次项及交互项的系数,xi和xj代表独立变量。实验所得响应值用 Design-Expert7.1.3 Trial(State-Ease,Inc.,Minneapolis MN,USA)软件进行处理以获得二次项模型,并对拟合模型进行统计学检验分析。
2.5 沙苑子黄酮类提取物对DPPH自由基的清除能力
2.5.1 反应时间的确定
将优化条件下提取物配制成一定浓度溶液,取0.10 mL待测液加入3.90 mL浓度为10-4mol/L DPPH由自基甲醇溶液中,迅速摇匀后在515 nm条件下对其进行时间扫描,以确定合适的反应时间。
2.5.2 反应中加入提取物浓度的确定和清除DPPH自由基能力测定
分别取各浓度待测样品溶液0.10 mL加入3.90 mL DPPH自由基溶液中,迅速摇匀并于室温下反应30 min,测定其在515 nm下的吸光度以计算对DPPH的清除率。清除率按下面公式计算:
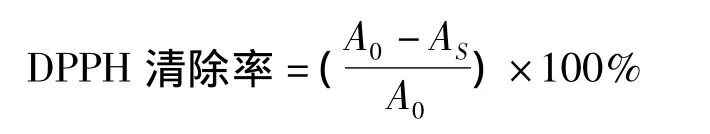
式中:As为反应物加入DPPH中30 min后体系的吸光度;
A0为0 min时DPPH溶液自身的吸光度。
3 结果与分析
3.1 吸收波长及溶剂极性对提取率的影响
由图1(a)~(b)沙苑子甲醇提取液扫描曲线可以看出,提取液在350 nm、266 nm和219 nm左右处均有吸收峰和重现性,但考虑到266 nm是沙苑子黄酮类物质的特定吸收波长[10],所以选择266 nm作为沙苑子甲醇提取液的最佳测定波长。

图1 沙苑子黄酮类化合物甲醇提取液全波长扫描曲线图(a)和三次平行扫描三维图(b)Fig.1 Full scan UV spectrum(a)and three-dimension combined UV spectrum(b)of methanol extracts

图2 甲醇浓度对沙苑子黄酮类提取率的影响图(a)和全波长扫描组合图(b)Fig.2 Effect of methanol concentration on extraction yield(a)and overlaid UV spectra(b)
由图2(a)可以看出,甲醇浓度为30%时沙苑子黄酮类化合物提取液吸光度最大,之后吸光度逐渐下降。虽然30%甲醇提取液吸光度最大,但提取液浑浊、杂质(糖类、蛋白质等)含量也较高,造成假吸收现象,同时也会给过滤带来困难;所以综合考虑选用60%甲醇作为提取溶剂。由图2(b)可以看出,提取液的吸收波长并未随溶剂极性改变而发生大的转移,说明用吸光值衡量提取率是可行的。
3.2 单因素实验结果
3.2.1 粒度大小对沙苑子黄酮类化合物提取率的影响

图3 粒度大小对沙苑子黄酮类化合物提取率的影响Fig.3 Effect of particle size on extraction yield of flavones
由图3可知,随着沙苑子粉粒度减小(目数增大),甲醇提取液吸光度也随着增大,主要原因是粒度越小与提取溶剂接触越充分。但考虑到粒度太小,提取液混浊、非目标提取物增多且不易过滤,所以选取沙苑子粒度为40、80、120目为响应面分析用的三个水平值。
3.2.2 提取温度对沙苑子黄酮类化合物提取率的影响
从图4可以看出,温度从20℃升高到50℃过程中沙苑子提取液的吸光度也随之升高,但超过50℃后增加不明显且有下降趋势(80℃时有所增高,原因不明),而且温度过高也不易操作控制,综合考虑响应面分析时选30、40、50℃为三个温度水平。
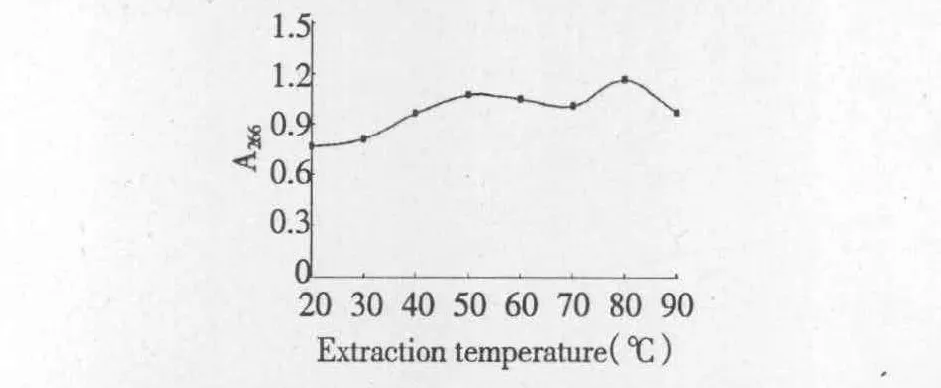
图4 提取温度对沙苑子黄酮类化合物提取率的影响Fig.4 Effect of extraction temperature on extraction yield of flavones
3.2.3 提取时间对沙苑子黄酮类化合物提取率的影响
由图5可知随着提取时间的延长,提取液吸光度也逐渐增大,但超过50 min后增加幅度不大,考虑到超声时间过长可能会造成化学破坏效应而且不利于节能,所以选取30、40、50 min为响应面优化的三个水平。
3.2.4 液料比对沙苑子黄酮类化合物提取率的影响
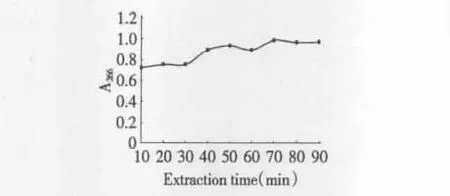
图5 提取时间对沙苑子黄酮类化合物提取率的影响Fig.5 Effect of extraction time on extraction yield of flavones

图6 液料比对沙苑子黄酮类化合物提取率的影响Fig.6 Effect of solvent-to-sample ratio on extraction yield of flavones
由图6可知,在液料比为10∶1到25∶1之间时,吸光度逐渐增大,在25∶1~50∶1之间时有所下降但不明显;虽然适当增大液料比有利于提取,但会加大溶剂回收的工作量,所以响应面分析时液料比水平范围选为 20∶1、25∶1、30∶1。
3.3 响应面法优化沙苑子黄酮类化合物的提取工艺
3.3.1 响应面分析因素的选取及分析方案
表1和表2分别为根据单因素试验结果所确定的各因素水平范围、编码和响应面分析方案及结果。
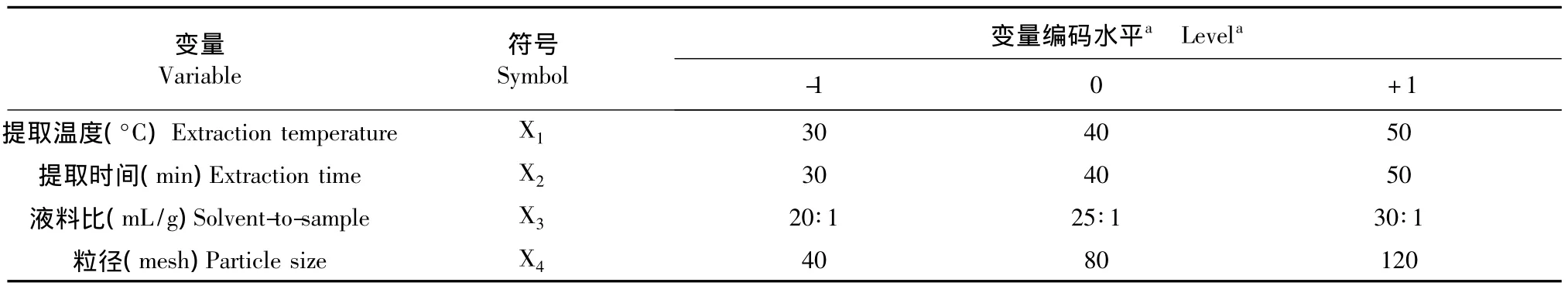
表1 响应面试验因素水平及编码表Table 1 Levels and factors for response surface methodology

表2 响应面分析方案和实验结果表Table 2 Design and results for response surface methodology

2 1 0 0 1 0.802 3 0 1 0 1 1.012 4 1 0-1 0 0.784 5 0 0-1 1 1.011 6 0 0 1-1 0.856 7-1 0 0 -1 0.681 8 0 0 0 0 0.910 9 0 0 0 0 0.933 10 -1 0 -1 0 0.686 11 0 0 1 1 0.981 12 -1 -1 0 0 0.655 13 1 0 1 0 0.856 14 -1 1 0 0 0.546 15 0 -1 0 1 0.886 16 0 0 0 0 0.922 17 0 -1 0 -1 0.755 18 0 0 -1 -1 0.755 19 0 1 1 0 0.954 20 1 1 0 0 0.605 21 0 1 -1 0 0.627 22 1 0 0 -1 0.551 23 0 0 0 0 0.923 24 -1 0 0 1 0.719 25 0 0 0 0 0.928 26 -1 0 1 0 0.856 27 0 0 0 0 0.926 28 0 0 0 0 0.929 29 0 -1 -1 0 0.792 30 1 -1 0 0 0.582 31 0 -1 1 0 0.737
3.3.2 响应面二次回归模型建立及分析
由表 3 可看出,β3、β4、β11、β22和 β23分别在 P <0.01或P<0.05水平上显著,说明他们对应的变量对响应值(或回归模型)有极显著或显著影响;而其它变量影响不显著(P>0.05)。经回归拟合的多项式模型为:
Y=0.92+0.003083X1+0.000167X2+0.049X3+0.096X4+0.033X1X2-0.025X1X3+0.053X1X4+0.096X2X3+0.054X2X4-0.033X3X4-0.19+0.12+0.009911-0.018
由表3还可看出,模型P<0.0001,相关系数R2=0.9247,调整系数R2=0.8588,表明模型能充分反映所选变量之间的关系,测定值和预测值间有良好的相关度。6.61%的变异系数说明模型具有良好的重现性,可以将该拟合模型用于优化甲醇提取沙苑子黄酮类的工艺参数。

表3 回归模型方差分析和显著性检验Table 3 Estimated regression coefficients and analysis of variance(ANOVA)for the model
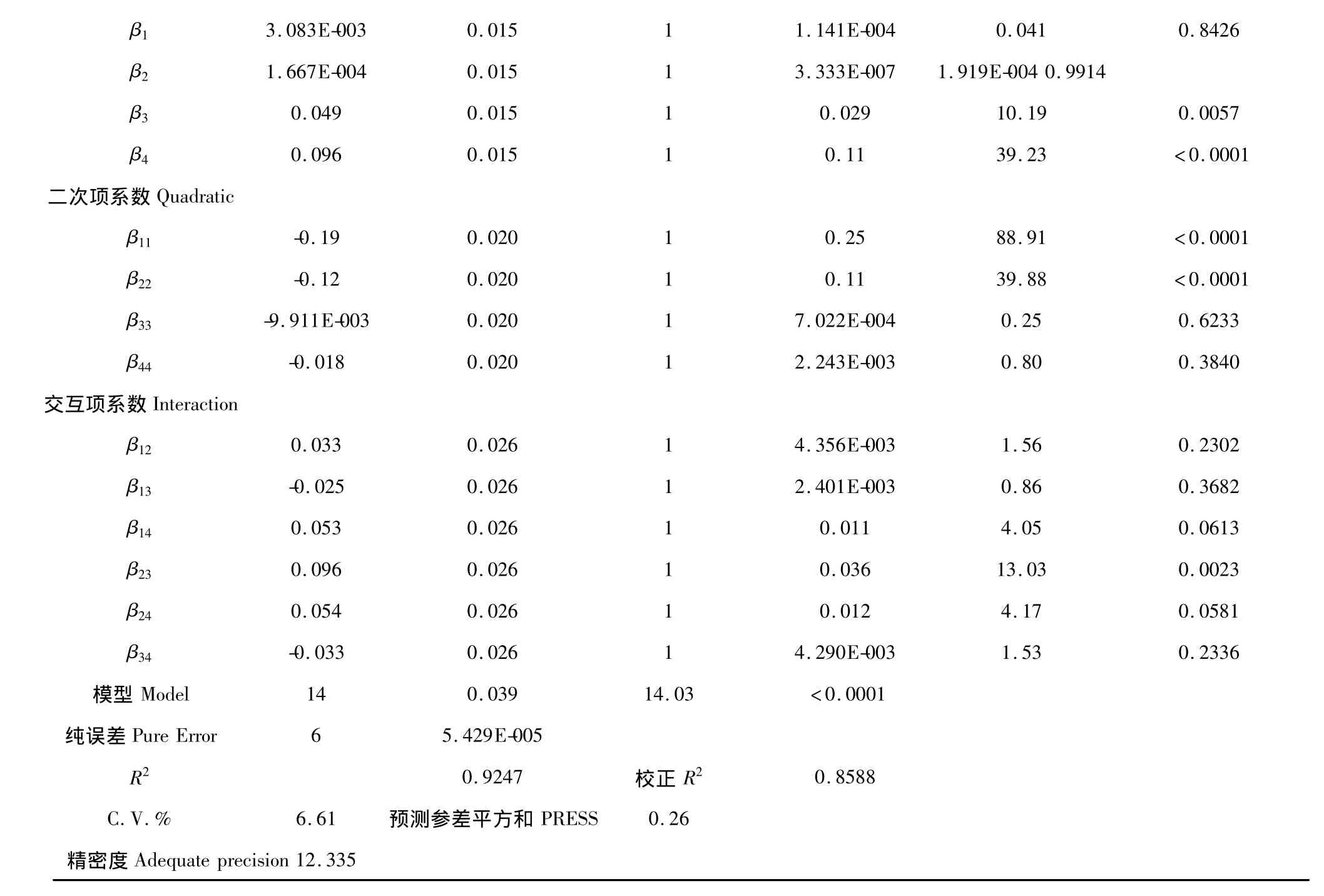
β1 3.083E-003 0.015 1 1.141E-004 0.041 0.8426 β2 1.667E-004 0.015 1 3.333E-007 1.919E-004 0.9914 β3 0.049 0.015 1 0.029 10.19 0.0057 β4 0.096 0.015 1 0.11 39.23 <0.0001二次项系数Quadratic β11 -0.19 0.020 1 0.25 88.91 <0.0001 β22 -0.12 0.020 1 0.11 39.88 <0.0001 β33 -9.911E-003 0.020 1 7.022E-004 0.25 0.6233 β44 -0.018 0.020 1 2.243E-003 0.80 0.3840交互项系数Interaction β12 0.033 0.026 1 4.356E-003 1.56 0.2302 β13 -0.025 0.026 1 2.401E-003 0.86 0.3682 β14 0.053 0.026 1 0.011 4.05 0.0613 β23 0.096 0.026 1 0.036 13.03 0.0023 β24 0.054 0.026 1 0.012 4.17 0.0581 β34 -0.033 0.026 1 4.290E-003 1.53 0.2336模型 Model 14 0.039 14.03 <0.0001纯误差Pure Error 6 5.429E-005 R2 0.9247 校正R2 0.8588 C.V.% 6.61 预测参差平方和PRESS 0.26精密度Adequate precision 12.335
3.3.3 沙苑子黄酮类化合物提取工艺条件的确定
对回归方程求偏导数,解四元一次方程组,得出4个变量的最优试验点(X1、X2、X3、X4)的水平代码值分别为 0.137、0.644、1.000、1.000,通过水平转换公式,得出实际最优工艺参数为提取温度为X1=41.37℃,提取时间X2=46.44 min,液料比为X3=30∶1,沙苑子粒度X4=120目。根据实际将工艺参数调整为 42 ℃、47 min、30∶1、120 目。按此优化条件进行3次平行实验结果吸光度为0.9879 ±0.0003(n=3),与模型预测值1.0745间没有显著差异,说明优化模型及结果可靠。经转换1 g沙苑子用60%甲醇提取可得106.64 mg黄酮类提取物,提取率为 10.66% 。与同类文献报道相比[6,8,9],本实验提取率为最高。

图7 甲醇提取物清除DPPH自由基的时间扫描图Fig.7 Absorption evolution of DPPH reacted with methanol extracts
3.4 提取物清除DPPH自由基实验结果
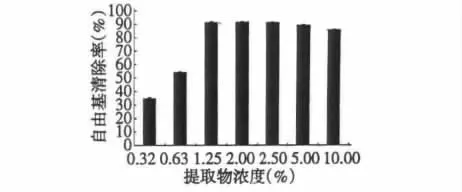
图8 不同浓度提取物对DPPH自由基的清除率Fig.8 DPPH scavenging ratio of different concentrations of methanol extracts
DPPH是一种人工合成的稳定自由基,其醇溶液呈紫色,在515 nm处有强吸收,当还原性物质加入DPPH自由基中时,其吸光度变小,因而可用对DPPH的清除率简便、准确评价还原性物质的抗氧化能力;但不同文献中对该方法比色条件的选择差异较大,因此本实验对反应时间进行了研究。由图7可知,提取物加入DPPH溶液中后,前15 min左右其吸光度下降非常迅速(从最初1.012下降到0.138),反应30 min后基本趋于稳定,因此本实验采用30 min作为反应测定时间。
由图8可以看出,在低浓度情况下(低于2.0%),提取物浓度与自由基清除率呈正相关,且提取物浓度为2.00%时清除率最高,为91.20%;当浓度大于2.50%时,随着浓度的升高清除率却有所下降,可能原因是反应体系中自由基已被耗尽而提取物仍有剩余,而提取物本身在515 nm处也有一定吸收所致。因此,测定沙苑子甲醇提取物对DPPH自由基清除效果时,提取物浓度在2.00%以内较为合适。
4 结论
沙苑子甲醇提取物在266 nm处有最大吸光值;各因素对沙苑子黄酮类物质提取率的影响依次为沙苑子粒度、料液比、提取温度和时间。响应面法优化后的超声辅助提取沙苑子黄酮的工艺参数为:60%甲醇、42℃、47 min、液料比30∶1和120目。按此优化条件进行3次平行实验结果为0.9879±0.0003(n=3),与模型预测值1.0745间没有显著差异,说明优化模型及结果可靠,提取率为10.66%。沙苑子甲醇提取物具有一定的清除DPPH自由基效果,低浓度条件下呈现良好的量效关系,浓度为2%时清除率最高。
1 The Nineth Pharmacopoeia Commission of State food and drug administration(国家食品药品监督管理局第九届药典委员会).Pharmacopoeia of the People's Republic of China(中华人民共和国药典).Beijing:Chinese Medical Science and Technology Press,2010.Vol I.
2 Li CY(刘春宇),Gu ZL(顾振纶),Han R(韩蓉),et al.Protection of flavonoids from Astragalus complanatus seed on acute liver injury induced by carbon tetrachloride and D-galactosamine.Chin Tradit Herb Drugs(中草药),2005,36:1838-1841.
3 Chang YH(常玉华),Zhang QA(张清安).Semen astragali complanati:current and future research on its chemical components.Shaanxi J Agric Sci(陕西农业科学),2011,6:129-131,186.
4 Zhang QA(张清安),Fan XH(范学辉),Zhang ZQ(张志琪),et al.Antioxidant for phenolic extracts from semen astragali complanati.Nat Prod Res Dev(天然产物研究与开发),2012,24:955-958.
5 Zhang QA(张清安),Fan XH(范学辉),Zhang ZQ(张志琪),et al.Ultrasound-assisted extraction technology for flavones from Semen Astragali Complanati optimized by response surface methodology.Sci Tech Food Indus(食品工业科技),2012,33:275-279.
6 Pang LX(庞来祥),Liu Y(刘燕),Liu XM(刘小民),et al.Study on the extraction technology of total flavones from semen astragali complanati.Northwest Pharm J(西北药学杂志),2008,23:214-216.
7 Yu M(于猛),Zhu M(竺梅),Wang YF(王英锋),et al.Study on ultrasonic extraction of complanatoside A from Semen Astragali Complanati and determination.J Capital Normal Univ(首都师范大学学报),2011,32(2):41-44.
8 Liu YF(刘银芳),Wu WQ(吴文倩),Liu CY(刘春宇),et al.Study on the extraction technology of flavones from semen astragali complanati.LiShiZhen Med Mater Med Res(时珍国医国药),2010,21:1401-1402.
9 Li HJ(李洪娟),Sun JF(孙居锋),Dai XP(代现平).Study on ultrasonic extraction of total flavanone from Astragalus complanatus.Hubei Agric Sci(湖北农业科学),2009,48:1479-1480.
10 Gu Y(顾莹),Liu YH(刘永和),Li GG(李国光),et al.Study on chemical constitutes of Semen Astragali Complanati.Northwest Pharm J(西北药学杂志),1997,12:107-109.
