巴戟天配伍维生素C对大鼠运动性肾脏缺血再灌注的保护作用
2013-10-25郭爱民曹建民周海涛
郭爱民,曹建民,周海涛
1中国石油大学(北京),北京102249;2北京体育大学,北京 100084;3北京联合大学生物化学工程学院,北京 100023
随着现代中医药理论的发展、现代药理学理论及现代生物技术的更新,更多的单剂或配伍组方应用于体育实践。中药以其多靶点、多途径作用且几乎不含违禁成分的特点日益显示出其独特的优势,在提高运动员身体机能及缓解疲劳方面取得了一定的成就。
机体在稳定状态下,肾血流量可以通过自身调节机制来维持相对恒定。在剧烈运动时,肾血流在神经和体液因素的影响下发生改变。由于各器官血流量重新分配,使活动器官特别是肌肉的血流量增多,肾血流量急剧下降,并伴随运动过程的持续和强度递增表现的更加明显[1]。肾脏的这种不完全缺血状态形成了“运动性肾缺血”。运动停止后,肾血供应恢复形成运动性肾缺血后的“再灌注”[2]。缺血再灌注损伤过程中,自由基的产生异常增多起着重要作用。研究表明,巴戟天具有提高过氧化物歧化酶活性、降低脂质过氧化物的药理作用[3],维生素C作为体内重要的抗氧化剂,可以有效清除自由基[4]。本文研究巴戟天配伍维生素C对大鼠缺血再灌注肾脏的影响,并探讨二者在缺血再灌注损伤中的作用及其机制,旨在为其临床应用提供理论依据。
1 材料与仪器
1.1 试验动物
清洁级雄性Wistar大鼠100只,42 d龄,平均体重(196.7±12.1)g,北京大学医学部实验动物科学部提供,许可证号SCXK(京)2006-0008。在整个试验过程中,实验室内温度保持在(22±2)℃,相对湿度55%~75%,光照时间随自然变化。所有试验大鼠均以基础饲料(北京大学医学部实验动物科学部提供)和蒸馏水常规饲养,自由饮食。试验时间为63 d,正式训练时间为56 d。
1.2 试验用药
巴戟天(Morindae Officinalis),产自广东肇庆,北京同仁堂购得,批号:100156357,并经天津中瑞药业有限公司高占友高级工程师鉴定。称取巴戟天50 g加7倍水,浸泡90 min后煎30 min,将所得水煎液过滤,再将过滤出的巴戟天加4倍水,煎30 min,将所得水煎液过滤。将2次过滤出的水煎液混合,浓缩到50 mL置于三角瓶内。最后将制备好的所有药液放入4℃冰箱冷冻保存,即为巴戟天煎剂1 g(生药)/mL。
1.3 试剂
血清肌酐(Cr)采用Jaffe苦味酸法测定,血尿素氮(BUN)采用二乙酰-肟法测定,丙二醛(MDA)采用比色法测定;超氧化物歧化酶(SOD),采用黄嘌呤氧化酶法测定,均采用南京建成生物工程研究所提供试剂盒,试剂盒编号20120509,并严格按照使用说明操作。
1.4 仪器
BS224S型电子分析天平(德国赛多利斯);光学显微镜(日本OLYMPUS公司);ALCYON300全自动生化分析仪(美国雅培);756M C型紫外-可见分光光度计(上海精密仪器厂);GL-20G高速冷冻离心机(上海安亭)。
2 试验方法
2.1 动物分组
实验大鼠适应性饲养4 d后,以20 min/d的运动量对其进行为期3 d的筛选,淘汰个别不适应游泳训练者,将剩余大鼠以数字随机分组法分6组:对照组(C组)12只,一般训练组(M组)12只,过度训练组(OM组)24只,巴戟天+过度训练组(MOM组)16只,维生素C+过度训练组(VCOM组)16只,巴戟天+维生素C+过度训练组(MVCOM组)16只进行56 d的游泳训练。训练期间,MOM组、MVCOM组采用专业灌胃器灌胃(ig),每天一次,剂量为1 g/kg,ig体积为5 mL/kg;VCOM组、MVCOM组采用腹腔注射(ip),剂量为100 mg/kg,每天一次,注射体积为0.5 mL(通过预实验获得最佳剂量),其他各组ig等量生理盐水。
2.2 实验方法。
2.2.1 训练及测试方案
C组常规饲养,不加任何干预,平时不运动。M组进行中等强度游泳训练,正式游泳训练8周。每周训练6 d,每天训练1次,第一次下水游20 min,此后逐渐增加,至第1周末时每天游60 min,第2周末时加至每天游90 min,第3周末时加至每天游120 min,此后5周均保持此运动量。其他各组前3周训练安排同M组,第4周起开始安排高强度训练。大鼠进行负重游泳,每次训练至力竭。力竭标准以大鼠下沉后10 s不露出水面为度。第1~3周负0.5%体重,第4周负1%体重,第5周负2%体重,每天训练1次。第6周每天上、下午各训练1次,第7~8周,每天上、下午、夜间各训练1次,均负5%体重。至第8周末,C、M组大鼠,均正常生长,无意外死亡发生。其他各组大鼠因尾部负重,疲劳衰竭不能恢复及训练意外死亡等原因,死亡率较高。OM组、MOM组、VCOM组、MVCOM 组分别剩余14、12、11、13只。各组分别取10只用于实验取材,其他随机剔除。
2.2.2 指标测定
各组大鼠于末次游泳训练24 h后,乙醚适度麻醉,从颈总动脉处取血加入柠檬酸钠溶液抗凝,37℃水浴中30 min后,4℃ 3000 rpm离心10 min,分离制备血清,置-20℃冰箱中保存待查。迅速取双肾,剔除筋膜,置于预冷的生理盐水中洗净血污,肉眼观察肾脏大小,色泽、质地。分离左肾,取肾上极组织0.5 g,用1.5 mL生理盐水在1℃下以12000 r/min研磨制成10%肾组织匀浆;10%甲醛固定肾组织标本,石蜡包埋,制成4 μm厚切片,HE染色,观察组织病理学变化。
2.3 数据统计
采用SPSS12.0软件对所有数据进行处理,数据用平均数±标准差(±s)表示,组间比较采用t检验,多组间比较采用方差分析。以P<0.05为有统计学意义。
3 试验结果
3.1 运动及巴戟天、维生素C对大鼠肾组织的病理改变
Scr和BUN测定后取各组肾组织制作石蜡切片,进行HE染色,光镜下观察组织形态学变化,肾脏病理变化评价参照Pallers标准[5],在400倍光镜下随机选5个视野,每个视野选10个肾小管评分。1、肾小管明显扩张,细胞扁平为1分;2、刷状缘损伤为1分,脱落为2分;3、细胞膜大泡1分,细胞浆空泡1分;4、间质水肿1分;5、肾小管腔内有脱落的坏死细胞未形成管型或碎片为1分,形成管型或碎片为2分。肾小管评分由两名技术员双盲计算,取其平均值。光镜下静止对照组、一般训练组大鼠肾组织结构正常,无淤血、变性和水肿,肾小管管腔内无管型。过度训练组大鼠肾小球有淤血现象,小管上皮细胞水肿、空泡变性、管腔扩张,管腔中有少量的脱落绒毛和上皮细胞,以及各种管型。其他各组组织病理学改变较过度训练组轻,有轻微的小管上皮细胞水肿、空泡变性,管腔扩张现象,无蛋白管型和细胞管型。各组大鼠肾小管Paller[5]评分,静止对照组、一般训练组组间无显著差异(P>0.05),静止对照组、一般训练组明显低于其他组(P<0.01),治疗组显著低于过度训练组大鼠(P<0.05),且均未见肾小球明显病理改变。
表1 各组大鼠肾小管损害评分比较(n=10,±s)Table 1 Tubular damage score in various groups of rats(n=10,±s)

表1 各组大鼠肾小管损害评分比较(n=10,±s)Table 1 Tubular damage score in various groups of rats(n=10,±s)
注:与C组比较,1)表示P<0.05,2)表示P<0.01;与OM组比较,3)表示 P <0.05,4)表示 P <0.01。Note:compared with C group,1)and2)represent P <0.05 and P <0.01,respectively;compared with OM group,3)and4)represent P <0.05 and P<0.01,respectively.
组别Groups肾小管损害评分Tubular damage score(scores/HP)C group 2.49±1.75 M group 2.88±1.524)OM group 12.86±1.892)MOM group 10.24 ± 1.482,3)VCOM group 10.98 ± 1.252,3)MVCOM group 9.53 ± 1.652,3)
3.2 运动及巴戟天、维生素C对大鼠血清BUN和SCr的影响
表2 各组大鼠血清尿素氮和肌酐含量比较(n=10,±s)Table 2 Blood urea nitrogen(BUN)and serum creatinine(SCr)levels in plasma of different groups(n=10,±s)
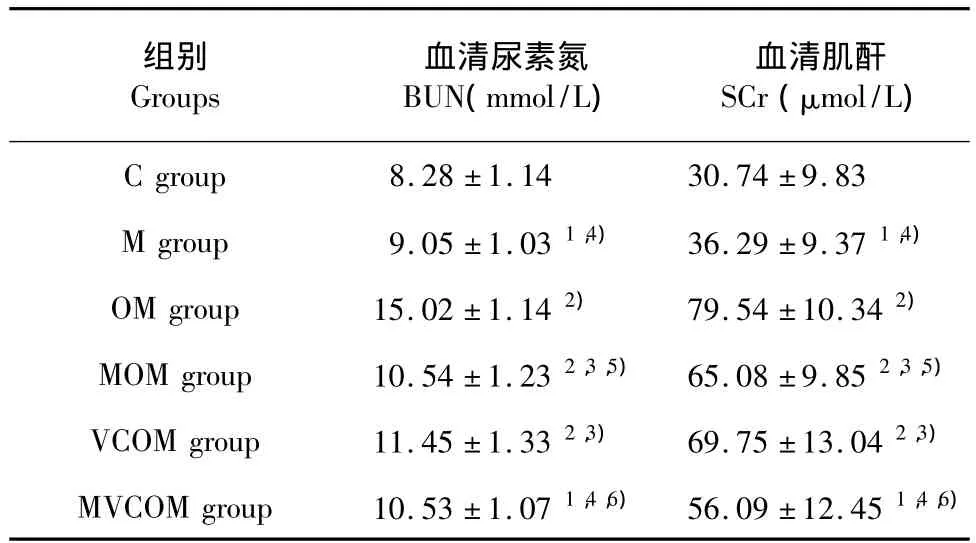
表2 各组大鼠血清尿素氮和肌酐含量比较(n=10,±s)Table 2 Blood urea nitrogen(BUN)and serum creatinine(SCr)levels in plasma of different groups(n=10,±s)
注:与C组比较,1)表示P<0.05,2)表示P<0.01;与OM组比较,3)表示P <0.05,4)表示P <0.01;与VCOM 组比较,5)表示P <0.05,6)表示P<0.01。Note:compared with C group,1)and2)represent P <0.05 and P <0.01,respectively;compared with OM group,3)and4)represent P <0.05 and P<0.01,respectively;compared with VOCM group,5)and6)represent P <0.05 and P <0.01,respectively.
组别Groups血清尿素氮BUN(mmol/L)血清肌酐SCr(μmol/L)C group 8.28±1.14 30.74±9.83 M group 9.05 ± 1.031,4) 36.29 ± 9.371,4)OM group 15.02±1.142) 79.54±10.342)MOM group 10.54 ± 1.232,3,5) 65.08 ± 9.852,3,5)VCOM group 11.45 ± 1.332,3) 69.75 ± 13.042,3)MVCOM group 10.53 ± 1.071,4,6) 56.09 ± 12.451,4,6)
由表2可知:血尿素氮和血清肌酐各组较对照组明显上升,与OM组相比MOM组、VCOM组、MVCOM组明显下降(分别为 P<0.05、P<0.05、P<0.01);与VCOM组相比,MOM组、MVCOM组明显下降(分别为 P<0.05,P<0.01)。
3.3 运动及巴戟天、维生素C对大鼠肾组织匀浆中SOD活性和MDA含量的影响
表3 各组大鼠肾组织匀浆中SOD活性和MDA含量比较(n=10,±s)Table 3 Comparison of SOD activity and MDA content in rat kidney homogenate of each group(n=10,±s)

表3 各组大鼠肾组织匀浆中SOD活性和MDA含量比较(n=10,±s)Table 3 Comparison of SOD activity and MDA content in rat kidney homogenate of each group(n=10,±s)
注:与C组比较,1)表示P<0.05,2)表示P<0.01;与OM组比较,3)表示P <0.05,4)表示P <0.01;与VCOM 组比较,5)表示P <0.05,6)表示P<0.01。Note:compared with C group,1)and2)represent P <0.05 and P <0.01,respectively;compared with OM group,3)and4)represent P <0.05 and P<0.01,respectively;compared with VOCM group,5)and6)represent P <0.05 and P <0.01,respectively.
组别Groups超氧化物歧化酶SOD(U/mgprotmol)丙二醛MDA(U/mgprotmol)C group 105.15±3.27 10.09±1.48 M group 93.33 ± 2.652,3) 17.04 ± 1.622,3)OM group 75.22±1.142) 30.54±1.582)MOM group 84.64 ± 1.532,3,5) 21.08 ± 1.552,3,5)VCOM group 80.19 ± 1.292,3) 25.45 ± 1.442,3)MVCOM group 90.47 ± 1.561,4,6) 15.99 ± 1.351,4,6)
由表3可知:SOD活性各组较对照组明显降低,与OM组相比MOM组、VCOM组、MVCOM组明显上升(分别为 P<0.05、P<0.05、P<0.01);与VCOM组相比,MOM组、MVCOM组明显上升(分别为P<0.05、P<0.01)。MDA含量各组较对照组明显升高,与OM组相比MOM组、VCOM组、MVCOM组明显下降(分别为P<0.05、P<0.05、P<0.01);与VCOM组相比,MOM组、MVCOM组明显降低(分别为 P<0.05、P<0.01)。
4 讨论
肾缺血再灌注(Ischemic reperfusion,I/R)损伤是一个复杂的病理生理变化过程,其具体机制尚未完全阐明。但氧自由基(Oxygen free radicals,OFR)在I/R发生、发展过程中起着至关重要的作用[6]。正常情况下,体内可产生少量自由基,但由于体内具有灭活自由基酶系统,自由基被迅速清除,不产生损伤作用。运动时由于I/R使自由基产生增加,可引发膜脂质过氧化反应,导致膜的液态性、流动性及通透性改变,进而造成膜功能障碍,尤其是线粒体膜的破坏将影响细胞的代谢和机能,并干扰整个器官的生理功能。机体内存在清除自由基、减轻其危害的主要物质是抗氧化酶。SOD是需氧生物体内数千种酶中以氧自由基为底物的唯一酶。其通过催化超氧阴离子形成过氧化氢而清除超氧阴离子,保护机体免受损伤,同时在一定范围内,自由基代谢增强时,SOD会代偿性增加。因此SOD活性的高低是机体抗氧化能力强弱的标志。MDA是细胞脂质过氧化的一种主产物。组织线粒体MDA含量是目前公认的衡量机体自由基代谢的敏感指标[7]。肌酐和尿素氮分别是肌肉和蛋白质的分解代谢产物,主要经血循环从肾脏排除体外,其血中的浓度取决于肾小球滤过能力,当肾脏实质受到损伤,肾小球滤过率降到临界点后,二者的浓度就会明显上升[8]。
实验结果显示,8周的过度训练导致大鼠肾组织组织病理学发生明显改变;血尿素氮、血清肌酐增高[过度训练组(P<0.01)、巴戟天+过度训练组(P<0.01)、维生素C+过度训练组(P<0.01)、巴戟天+维生素C+过度训练组(P<0.05)高于静止对照组];SOD活性降低[过度训练组(P<0.01)、巴戟天+过度训练组(P<0.01)、维生素C+过度训练组(P<0.01)、巴戟天+维生素C+过度训练组(P<0.05)低于静止对照组];MDA含量升高[一般训练组(P<0.05)、过度训练组(P<0.01)、巴戟天+过度训练组(P<0.01)、维生素C+过度训练组(P<0.01)、巴戟天+维生素C+过度训练组(P<0.05)高于静止对照组]。说明过度训练已造成大鼠肾脏运动性缺血“再灌注”损伤,肾功能受到严重损坏。但肾组织组织病理学改变巴戟天+过度训练组、维生素C+过度训练组、巴戟天+维生素C+过度训练组(P<0.05)较过度训练组明显减轻。血尿素氮和血清肌酐含量巴戟天+过度训练组(P<0.05)、维生素C+过度训练组(P<0.05)、巴戟天+维生素C+过度训练组(P<0.01)低于过度训练组;SOD活性,巴戟天+过度训练组(P<0.05)、维生素C+过度训练组(P<0.05)、巴戟天+维生素C+过度训练组(P<0.01)高于过度训练组;MDA含量,巴戟天+过度训练组(P<0.05)、维生素C+过度训练组(P<0.05)、巴戟天+维生素C+过度训练组(P<0.01)低于过度训练组。表明,巴戟天及维生素C可以有效清除自由基,减轻肾脏的缺血缺氧,抑制脂质过氧化作用,提高SOD活性。有效减轻肾脏缺血再灌注损伤,起到保护作用。其机制可能为:1、巴戟天中的主要成分巴戟天多糖对物理的、化学的及生物来源的多种活性氧(ROS)具有清除作用,能减轻脂质过氧化产物丙二醛(MDA)的生成量,提高超氧化物歧化酶(SOD)、谷胱甘肽过氧化物酶(GSH-Px)活性和稳定细胞膜的作用,从而促进大鼠运动缺血再灌注损伤[9];2、巴戟天中富含Vc及Mn等多种微量元素,可以通过减少机体超氧阴离子自由基的生成,而使SOD的消耗相应降低[3]。二方面的联合作用对清除机体自由基、减轻自由基对线粒体膜和肌浆网膜造成损伤起到积极作用;3、维生素C是重要的抗氧化维生素,作为强抗氧化剂可有效清除氧自由基、抑制凋亡级联的启动而减轻细胞、器官的缺血再灌注损伤[10]。此外,3个治疗组间比较,血尿素氮、血清肌酐、MDA含量,巴戟天+过度训练组(P<0.05),巴戟天+维生素C+过度训练组(P<0.01)低于维生素C+过度训练组;SOD活性,巴戟天+过度训练组(P<0.05),巴戟天+维生素C+过度训练组(P<0.01)高于维生素C+过度训练组。提示巴戟天对缺血再灌注损伤肾脏的疗效可能优于维生素C;而二者配伍使用可使血尿素氮,血清肌酐水平含量低于单纯使用巴戟天,使SOD活力增高,提示二者配伍使用可能更有利于缺血再灌注损伤肾脏的保护。
综上所述,巴戟天和维生素C均对肾脏缺血再灌注损伤具有保护作用,可能是通过增强超氧化物歧化酶活性,清除自由基,减轻脂质过氧化作用,进而改善肾脏功能。就疗效而言,二者配伍使用优于二者单独应用,而巴戟天又优于维生素C,但也可能和二者在应用中的剂量大小有关,其剂量和疗效之间的关系,还有待进一步研究。
1 Barclar WF.Review of Medical Physiology.California:Lange Medical Publication.1995:577-580.
2 Heifets M,Davis TA,Tegtmeyer E,et al.Exercise training ameliorates progressive renal disease in rats with subtotal nephrectomy.Kidney Int,1987,32:815-820.
3 Zhu C(朱超),Cao JM(曹建民),Zhou HT(周海涛),et al.Effect of Radix morinda officinalis on the exercise capacity in rats and oxidation resistance of mitochondrial.Chin J Exp Tradit Med Form(中国实验方剂学杂志),2013,19:219-222.
4 Palazzetti S,Rousseau AS,Richard MJ,et al.Antioxidant supplementation preserves antioxidant response in physical training and low antioxidant intake.Br J Nutr,2004,91:91-100.
5 Glaumann B,Trump BF.Studies on the pathogenesis of ischemic cell injury.III.Morphological changes of the proximal pars recta tubules(P3)of the rat kidney made ischemic in vivo.Virchows Arch B Cell Pathol,1975,19:303-323.
6 Wang L(王丽),Mei CL(梅长林).Hypoxia-inducible factor-1α and oxygen free radicals in renal ischemia-reperfusion injury in rats.Chin J Nephrol(中华肾脏病杂志),2006,22:371-373.
7 Chen PJ,Hirata F.The effects of long-term training at various loads on immunity and neuroendocrine responses in rats.J Nat Inst Fit Sport Kanoya Japan,1998,20:19-26.
8 Hong P(洪平),Chen G(陈耿),Li QZ(李清正),et al.Influence of rapid weight loss by different temperature on certain biochemical indexes.Chin Sport Sci(体育科学),2010,30(4):44-48.
9 Liu X(刘霄).The Morinda polysaccharide hypoglycemic and antioxidant effects research.Chin Med Mat(中药材),2009,32:949-951.
10 Korkmaz A,Kolankaya D.The protective effects of ascorbic acid against renal ischemia-reperfusion injury in male rats.Ren Fail,2009,31:36-43.
