p38 MAPK抑制剂SB203580对雨蛙肽诱导的小鼠胰腺组织损伤的影响*
2013-10-25曹明华冯雅静张一真李永渝
徐 菁, 曹明华, 冯雅静, 李 琨, 张一真, 李永渝
(同济大学医学院病理生理教研室,同济大学消化系统疾病研究所,上海 200092)
p38 MAPK抑制剂SB203580对雨蛙肽诱导的小鼠胰腺组织损伤的影响*
徐 菁, 曹明华, 冯雅静, 李 琨, 张一真, 李永渝△
(同济大学医学院病理生理教研室,同济大学消化系统疾病研究所,上海 200092)
目的探讨p38 MAPK抑制剂SB203580(SB)对雨蛙肽(caerulein,CAE)诱导的小鼠离体胰腺组织损伤的影响,并探讨其可能的机制。方法分离小鼠离体胰腺组织后培养4 h,用CAE(10-5mol/L)刺激,加用或不加用SB (10-5mol/L)进行干预,以生理盐水(NS)作为对照。在刺激1 h和4 h后测定胰腺组织活力(MTT)、培养上清液中淀粉酶和脂肪酶活性(生化法)以及白细胞介素6(IL-6)和细胞因子诱导的中性粒细胞趋化因子1(CINC-1)的水平(ELISA法);同时测定胰腺组织中热休克蛋白60(HSP60)和HSP70蛋白水平(ELISA法),并用Western blotting测定胰腺组织p38及磷酸化p38 (p-p38)MAPK蛋白的表达。结果CAE刺激后胰腺组织活力与NS组比较有所下降,尤其在刺激后4 h明显降低(P<0.05);CAE刺激后1 h,离体胰腺组织培养上清液中淀粉酶、脂肪酶、IL-6和CINC-1水平较NS组均明显升高(P<0.05);胰腺组织中HSP60、HSP70、p38及p-p38 MAPK蛋白的表达较NS组有所升高(P<0.05),而SB可不同程度干预CAE引起的这些指标的改变。结论CAE对离体胰腺组织具有损伤作用,SB可减轻CAE造成的胰腺组织的损伤,其机制可能与其对p38 MAPK抑制进而使炎症反应受到抑制有关;HSP60和HSP70的变化是因为炎症反应减轻而使细胞应激程度降低所致,还是失去了p38 MAPK的调控作用所致,还有待进一步研究。
胰腺; p38 MAPK信号通路; 雨蛙肽
p38 丝裂原活化蛋白激酶(p38 mitogen-activated protein kinase, p38 MAPK)信号通路在炎症、细胞分化、细胞凋亡、应激反应方面发挥着重要的调节作用[1]。p38 MAPK最初作为脂多糖(lipopolysaccha-rides, LPS)刺激产生的酪氨酸磷酸蛋白而被鉴定出[2],与其它MAPK信号通路相同,p38 MAPK信号通路也是由一套进化上保守、顺序激活的三级激酶组成[3]。各种细胞外刺激,包括紫外线、生长因子、细胞因子、炎症介质和G蛋白偶联受体的配体等均可激活p38 MAPK[4]。活化后的p38 MAPK可以入核,激活多种转录因子,进而调节各种细胞因子的表达以及细胞凋亡。此外,p38 MAPK还能激活细胞内的一些蛋白激酶,进而激活低分子量的热休克蛋白,参与细胞应激反应[5]。SB203580(SB)是p38 MAPK的特异性抑制剂,许多研究表明它可以抑制炎症性疾病时的炎症介质的表达[6]。本实验通过观测SB对雨蛙肽(caerulein,CAE)诱导的小鼠离体胰腺组织损伤的影响,探讨p38 MAPK信号通路是否参与了该病理过程及其可能的作用机制。
材 料 和 方 法
1动物及分组
体重18~22 g C57BL小鼠20只,雌雄各半,购自第二军医大学实验动物中心。实验前小鼠禁食不禁水16 h,随机将小鼠分为4组(每组小鼠5只):生理盐水对照组(NS组)、CAE处理组(CAE组)、单用SB组(SB组)及CAE+SB组。
2小鼠胰腺组织块的分离和培养
参照Jaffrey等[7]的方法,在无菌条件下,将小鼠断颈处死,迅速取出胰腺组织,将其放入HEPES缓冲液中,仔细清除组织上的血管、系膜及脂肪,再用HEPES缓冲液清洗2遍。将胰腺组织放入1 mL培养液中剪碎至直径小于0.5 mm×0.5 mm×0.5 mm碎片,静置1 min,弃上清,加入新鲜培养液12 mL,混匀后均匀分到24孔培养板上并置于5%CO2培养箱(Thermo Electron)培养。
3小鼠胰腺组织刺激后各项指标的检测
根据前期的实验结果[8],胰腺组织块在培养48 h过程中存活状况及功能状况良好,此次实验选取基础培养4 h后的胰腺组织,用药物进行刺激,CAE终浓度10-5mol/L[8],SB终浓度 10-5mol/L[6],并以NS组作为对照。在药物刺激后1 h、4 h分别收胰腺组织和培养上清,对以下指标进行检测。
3.1胰腺组织活力的检测 用四甲基偶氮唑蓝(MTT)法检测(南京凯基生物科技发展有限公司),同时用蛋白定量试剂盒(BCA,碧云天生物技术研究所)测定胰腺组织中的蛋白量,计算得出每毫克组织蛋白的组织活力,以此来判断组织损伤情况。
3.2检测组织培养上清液淀粉酶、脂肪酶、白细胞介素6(interleukin-6, IL-6)和细胞因子诱导的中性粒细胞化学趋化因子1(cytokine-induced neutrophil chemoattractant 1, CINC-1)的水平 淀粉酶和脂肪酶活性按照相关生化试剂盒(南京建成生物科技有限公司)说明书介绍的步骤检测。IL-6和CINC-1水平按照相关ELISA试剂盒(R&D)说明书介绍的步骤检测。
3.3胰腺组织中热休克蛋白60(heat-shock protein 60,HSP 60)和HSP70水平的检测 HSP60和HSP70的检测按照相关ELISA试剂盒(R&D)说明书介绍的步骤检测,同时用蛋白定量试剂盒(BCA,碧云天生物技术研究所)测定胰腺组织中的蛋白量,计算得出每毫克组织中的相关蛋白含量。
3.4检测胰腺组织中p38 MAPK及p-p38 MAPK蛋白的表达 取胰腺组织加入蛋白裂解液(组成:HEPES 25 mmol/L, EDTA 1 mmol/L, NaCl2150 mmol/L, MgCl210 mmol/L, PMSF 1 mmol/L, 蛋白酶抑制剂10 mg/L, 1%NP-40, 2%丙三醇, pH 7.5),匀浆,使之充分裂解,离心取上清,检测样品蛋白浓度(BCA,碧云天生物技术研究所),之后在等浓度样品中加入5×上样缓冲液(碧云天生物技术研究所),95 ℃煮沸10 min使蛋白变性。之后按照参考文献[9]完成SDS-聚丙烯酰胺凝胶电泳和蛋白转膜操作,上样样品量为40 μg。转膜后用5%脱脂牛奶封闭1 h,TBST洗涤后将NC膜分别与各个Ⅰ抗:p38 MAPK多克隆抗体(Santa Cruz,1∶400稀释),p-p38 MAPK多克隆抗体(Santa Cruz,1∶400稀释)孵育过夜,以GAPDH单克隆抗体(Santa Cruz,1∶1 000稀释)作为内参照。TBST洗膜,室温下与辣根过氧化物酶(HRP)标记的Ⅱ抗(Santa Cruz,1∶5 000稀释)孵育2 h。ECL化学发光法显色,化学发光成像分析仪(ImageQuant LAS 4000)曝光、采集图像。用ImageJ分析蛋白条带的光强度,将p38 MAPK和p-p38 MAPK蛋白与内参照光强度的比值进行半定量分析。
4统计学处理
数据用均数±标准误(mean±SEM)表示,用软件SPSS 13.0进行统计学分析,先用Levene 方法进行方差齐性检验,若样本总体符合方差齐性要求,则对其进行单因素方差分析(ANOVA) ,若样本总体的方差不齐,采用非参数检验(Kruskal-Wallis检验),以P<0.05为差异有统计学意义。
结 果
1离体胰腺组织活力水平的改变
如图1所示,CAE刺激小鼠离体胰腺组织后1 h,胰腺组织的活力与对照组比较稍有降低(P>0.05);CAE刺激4 h后胰腺组织活力明显降低(P<0.05),而CAE+SB组较CAE组明显升高(P<0.05),但较NS组仍较低(P<0.05)。
2培养上清液中淀粉酶和脂肪酶活性的改变
刺激后1 h,与NS组比较,CAE组培养上清液中的淀粉酶和脂肪酶活性明显升高(P<0.05);而CAE+SB组中,两者的活性与CAE相比显著降低(P<0.05),与NS组比较仍处于较高水平(P<0.05);SB组与NS组比较无明显差异(P>0.05),见图2。刺激后4 h与刺激后1 h结果表现趋势一致。

Figure 1. Effects of CAE and SB on the viability of the isolated mouse pancreatic tissues. Mean±SEM.n=5.*P<0.05vsNS group;#P<0.05vsCAE 4 h group.
图1CAE及SB对小鼠离体胰腺组织活力的影响
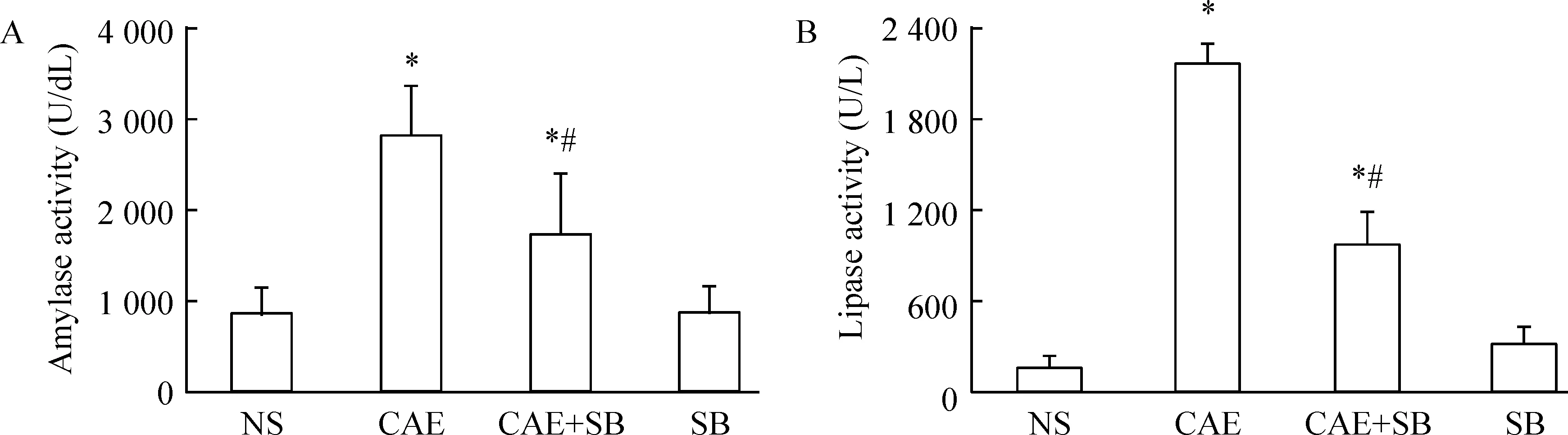
Figure 2. Effects of CAE and SB on amylase (A) and lipase (B) activity in the culture supernatants of the isolated mouse pancreatic tissues. Mean±SEM.n=5.*P<0.05vsNS or SB group;#P<0.05vsCAE group.
图2CAE及SB对离体小鼠胰腺组织培养上清液中淀粉酶和脂肪酶水平的影响
3培养上清液中IL-6和CINC-1活性的改变
刺激后1 h,与NS组比较,CAE组培养上清液中的IL-6和CINC-1活性均明显升高(P<0.05);而CAE+SB组中,IL-6和CINC-1的活性与CAE组相比显著降低(P<0.05),与NS组相比基本相当(P>0.05);SB组与NS组比较无明显差异(P>0.05),见图3。刺激后4 h与刺激后1 h结果表现趋势一致。

Figure 3. Effects of CAE and SB on IL-6 (A) and CINI-1 (B) levels in the culture supernatants of the isolated mouse pancreatic tissues. Mean±SEM.n=5.*P<0.05vsNS or SB group;#P<0.05vsCAE group.
图3CAE及SB对离体小鼠胰腺组织培养上清液中IL-6和CINI-1水平的影响
4胰腺组织中HSP60和HSP70蛋白的表达
刺激后1 h,与NS相比较,CAE组中胰腺组织HSP60和HSP70蛋白表达水平有所升高(P<0.05);而CAE+SB组中,HSP60和HSP70蛋白表达水平与CAE组相比有所降低(P>0.05),与NS组相比基本相当(P>0.05);SB组与NS组比较无明显差异(P>0.05),见图4。刺激后4 h与刺激后1 h结果表现趋势一致。

Figure 4. Effects of CAE and SB on HSP60 (A) and HSP70 (B) protein levels in the isolated mouse pancreatic tissues. Mean±SEM.n=5.*P<0.05vsNS group.
图4CAE及SB对离体小鼠胰腺组织中HSP60和HSP70蛋白表达水平的影响
5胰腺组织中p38和p-p38MAPK蛋白的表达
刺激后1 h,与NS组比较,CAE组中胰腺组织p38和p-p38 MAPK蛋白表达水平明显升高(P<0.05);而CAE+SB组中,p38和p-p38 MAPK蛋白表达水平与CAE组相比显著降低(P<0.05),与NS组相比基本相当(P>0.05);SB组与NS组比较无明显差异(P>0.05),见图5。刺激后4 h与刺激后1 h结果表现趋势一致。
讨 论
急性胰腺炎(acute pancreatitis, AP)是一种始发于胰腺,易于向远隔器官累及的急性炎症性疾病。其病理生理过程复杂,与多种因素相关,包括胰酶的激活、炎症介质、细胞因子等[10]。雨蛙肽是胆囊收缩素(cholecystokinin, CCK)的类似物,有研究表明它可引起胰酶分泌,大剂量可诱导AP发生[11],目前广泛被应用于AP实验研究。本课题组进行了大量的实验研究证实雨蛙肽可引起胰腺组织的损伤,用雨蛙肽进行在体实验时[9],胰腺病理切片可见组织重度水肿、中性粒细胞浸润等,此外血清淀粉酶、脂肪酶活性升高,促炎细胞因子水平也升高。本实验采用雨蛙肽刺激离体的胰腺组织,同样观测到胰腺组织的损伤,表现为胰腺组织活力下降,同时培养上清液中淀粉酶、脂肪酶、IL-6和CINC-1水平均明显升高。本实验的结果与前期在体实验[9]的结果相一致。
在AP的发生发展过程中,NF-κB的激活占有重要的地位,而p38 MAPK信号通路参与了这一调节[12]。p38 MAPK的下游蛋白激酶MK2磷酸化后可激活并触发NF-κB的激活和放大[13]。我们以前的研究证实,在小鼠急性胰腺炎模型中,MK2基因敲除鼠的局部和全身炎症反应的表现都较野生鼠减轻[14]。本实验发现,CAE刺激后的小鼠离体组织中p38和p-p38 MAPK蛋白表达增高,表明CAE可激活p38 MAPK,而p38 MAPK特定的抑制剂SB203580可抑制CAE诱导的p38 MAPK的激活,并减弱炎症反应和细胞因子的释放,这进一步证明了p38 MAPK信号通路参与了AP的炎症过程。这一结果与小鼠在体实验结果相一致(结果未发表)。
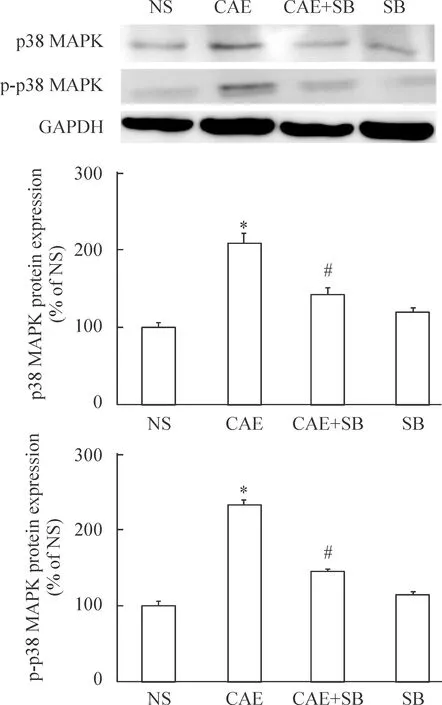
Figure 5. Effects of CAE and SB on p38 MAPK and p-p38 MAPK protein expression in the isolated mouse pancreatic tissues. Mean±SEM.n=5.*P<0.05vsNS or SB group;#P<0.05vsCAE group.
图5CAE及SB对离体小鼠胰腺组织中p38和p-p38MAPK蛋白表达水平的影响
热休克蛋白是在从细菌到哺乳动物中广泛存在的一类热应急蛋白质,多具有分子伴侣活性。按照蛋白的大小,热休克蛋白共分为5类,分别为HSP100、HSP90、HSP70和HSP60以及小分子热休克蛋白[15]。研究表明,热休克蛋白有抗凋亡、参与炎症反应等作用[16]。本课题组的前期研究发现,用RNA干扰技术(HSP60 RNAi)抑制胰腺组织HSP60的表达,胰腺组织对损伤因子的敏感性增加,促炎细胞因子水平明显高于非干扰组,表明HSP60对胰腺组织具有保护作用[17]。也有学者看到,p38 MAPK和HSP70在体内外都会相互影响,认为HSP70是核易位p38潜在的伴侣因子[18]。在本实验中,CAE刺激小鼠离体胰腺组织后,HSP60和HSP70的表达增加,而使用SB干预后,可使HSP60和HSP70的表达在一定程度上降低,提示p38 MAPK可能参与了热休克蛋白HSP60和HSP70合成的调节。而HSP60和HSP70的变化是因为炎症反应减轻而使细胞应激程度降低所致,还是失去了p38 MAPK的调控作用所致还有待进一步研究。
总之,本次实验的结果显示,在离体小鼠胰腺组织培养中,SB可减轻雨蛙肽造成的损伤,其机制可能与其对炎症介质和细胞因子的抑制有关。本实验进一步证实了p38 MAPK信号通路在炎症中的作用,为AP发生机制的阐明和AP的治疗提供了新的思路。
[1] Han J, Lee JD, Bibbs L, et al. AMAP kinase targeted by endotoxin and hyperosmolarity in mammalian cells [J]. Science, 1994, 265(5173):808-811.
[2] Brewster JL, de Valoir T, Dwyer ND, et al. An osmosensing signal transduction pathway in yeast [J]. Science, 1993, 259(5102):1760-1763.
[3] Zarubin T, Han J. Activation and signaling of the p38 MAP kinase pathway[J]. Cell Res, 2005, 15(1):11-18.
[4] Haddad EB, Birrell M, McCluskie K, et al. Role of p38 MAP kinase in LPS - induced airway inflammation in the rat[J]. Br J Pharmacol, 2001, 132(8):1715-1724.
[5] McGinn S, Ssad P, Pomnnik P, et al. High glucose-mediated effects on endothelial cell proliferation occur via p38 MAP kinase[J]. Am J Physicol Endocrinol Metab, 2003, 285(4):E708-E717.
[6] Samuel I, Zaheer A, Fisher RA.Invitroevidence for role of ERK, p38, and JNK in exocrine pancreatic cytokine production [J]. J Gastrointest Surg, 2006, 10(10):1376-1383.
[7] Jaffrey C, Eichenbaum D, Denham DW,et al. A novel pancreatic model: the snip method of pancreatic isolation forinvitrostudy [J]. Pancreas, 1999, 19(4):377-381.
[8] 吕 帅, 冯佳燕, 高志荣, 等. LPS和雨蛙肽诱导大鼠离体胰腺组织损伤并抑制HSP60蛋白的变化[J]. 中国病理生理杂志, 2010, 26(6):1146-1150.
[9] 冯佳燕, 李 琨, 林旭红, 等. 新型大麻制剂O-1602和CBD减轻小鼠实验性急性胰腺炎的机制研究[J]. 中国病理生理杂志, 2011, 27(3):539-544.
[10] Pandol SJ, Saluja AK, Imric CW, et al. Acute pancreatitis: bench to the bedside [J]. Gastroenterology, 2007, 132(3):1127-1151.
[11] Nakada S, Tsuneyama K, Kato I, et al. Identification of candidate genes involved in endogenous protection mechanisms against acute pancreatitis in mice [J]. Biochem Biophys Res Commun, 2010, 391(3):1342-1347.
[12] Papachristou GI, Abu-Elmagd KM, Bond G, et al. Pancreaticobiliary complications after composite visceral transplantation: incidence, risk, and management strategies[J]. Gastrointest Endosc, 2011, 73(6):1165-1173.
[13] Tudhope SJ, Finney-Hayward TK, Nicholson AG, et al. Different mitogen-activated protein kinase-dependent cytokine responses in cells of the monocyte lineage [J]. J Pharmacol Exp Ther, 2008, 324(1):306-312.
[14] Li YY, Ochs S, Gao ZR, et al. Regulation of HSP60 and the role of MK2 in a new model of severe experimental pancreatitis[J]. Am J Physiol Gastrointest Liver Physiol, 2009, 297(5):G981- G989.
[15] Multhoff G, Pockley AG, Streffer C, et al. Dual role of heat shock proteins (HSPs) in anti-tumor immunity[J]. Curr Mol Med, 2012, 12(9):1174-1182.
[16] Lunova M, Zizer E, Kucukoglu O, et al. Hsp72 overexpression accelerates the recovery from caerulein-induced pancreatitis [J]. PLoS One, 2012, 7(7):e39972.
[17] Li YY, Lu Y, Li K, et al. Down-regulation of HSP60 expression by RNAi increases lipopolysaccharide- and cerulein-induced damages on isolated rat pancreatic tissues[J]. Cell Stress Chaperones, 2010, 15(6):965-975.
[18] Gong X, Luo T, Deng P, et al. Stress-induced interaction between p38 MAPK and HSP70[J]. Biochem Biophys Res Commun, 2012 , 425(2):357-362.
Effectofp38MAPKinhibitorSB203580oncaerulein-inducedpancreatictissueinjuryinmice
XU Jing, CAO Ming-hua, FENG Ya-jing, LI Kun, ZHANG Yi-zhen, LI Yong-yu
(DepartmentofPathophysiology,InstituteofDigestiveDiseases,TongjiUniversitySchoolofMedicine,Shanghai200092,China.E-mail:liyongyu@tongji.edu.cn)
AIM: To investigate the effect of p38 MAPK inhibitor SB203580 (SB) on caerulein (CAE)-induced injury in isolated mouse pancreatic tissues.METHODSThe pancreatic tissues of the mice were isolated, cultured for 4 h, and stimulated with CAE (10-5mol/L) alone or combined with SB (10-5mol/L). Normal saline (NS) was used as control reagent. At the time points of 1 h and 4 h after stimulation, the pancreatic tissues and the culture supernatants were harvested. The following parameters for evaluating the degree of injury were observed: the viability of the pancreatic tissues, the activity of amylase and lipase, and the content of interleukin-6 (IL-6) and cytokine-induced neutrophil chemotactic factor 1 (CINC-1) in the cultured supernatant. The levels of heat-shock protein (HSP) 60 and 70, and p38 and p-p38 proteins in the pancreatic tissues were measured by ELISA or Western blotting.RESULTSAfter stimulation with CAE, the viability of the pancreatic tissues decreased at 1 h and was even lower at 4 h. The levels of amylase, lipase, IL-6, CINC-1, HSP60 and HSP70 as well as the expression of p38 and p-p38 were significantly increased at the time point of 1 h as compared with NS group. These changes were partly or totally prevented by SB treatment.CONCLUSIONCAE effectively damages the isolated pancreatic tissues. SB203580 reduces the injury, which may be related to the inhibition of the inflammatory responses.
Pancreas; p38 MAPK signaling pathway; Caerulein
R363.2
A
10.3969/j.issn.1000- 4718.2013.04.024
1000- 4718(2013)04- 0713- 05
2012- 12- 20
2013- 03- 05
国家自然科学基金资助项目(No. 81270477)
△通讯作者 Tel: 021-65981021; E-mail: liyongyu@tongji.edu.cn
