3β,5α,6β-三羟基胆甾烷诱导恶性胶质瘤细胞的凋亡*
2013-10-25谢珊珊朱文博张海鹏邱鹏新苏兴文颜光美胡海燕
谢珊珊, 朱文博, 颜 敏, 林 园, 张海鹏, 邱鹏新, 苏兴文, 颜光美, 胡海燕
(中山大学 1中山医学院药理教研室, 2药学院, 广东 广州 510006)
3β,5α,6β-三羟基胆甾烷诱导恶性胶质瘤细胞的凋亡*
谢珊珊1, 朱文博1, 颜 敏1, 林 园1, 张海鹏1, 邱鹏新1, 苏兴文1, 颜光美1, 胡海燕2△
(中山大学1中山医学院药理教研室,2药学院, 广东 广州 510006)
目的研究3β,5α,6β-三羟基胆甾烷(Triol)诱导恶性胶质瘤细胞凋亡的作用及其机制。方法以不同浓度的Triol作用于C6细胞和A172细胞不同时间。采用MTT法检测细胞存活率,Hoechst 33342染色和TUNEL法检测细胞凋亡,试剂盒检测caspase活性变化,蛋白免疫印记方法检测凋亡相关蛋白Bcl-2家族蛋白的变化。结果Triol可呈剂量和时间依赖性降低C6细胞和A172细胞的存活率;Triol处理细胞48 h,C6细胞和A172细胞的IC50值分别为(17.8±0.6)μmol/L和(20.6±0.2)μmol/L。Hoechst 33342染色、TUNEL检测和凋亡执行酶caspase-3活性检测结果显示,给药组中2种细胞都出现明显凋亡核象、TUNEL阳性细胞数增多和caspase-3的激活。Triol作用于C6细胞12 h、24 h和48 h后,在凋亡外通路中激活的caspase-8和在凋亡内通路中激活的caspase-9活性均随时间升高,抗凋亡蛋白Bcl-2和Bcl-xL的表达量随时间降低,而促凋亡蛋白Bak的表达量随时间升高。结论Triol通过激活内、外凋亡通路引起恶性胶质瘤细胞的凋亡,且 Bcl-2家族蛋白在此过程中起重要的调控作用。
3β,5α,6β-三羟基胆甾烷; 神经胶质瘤; 细胞凋亡; Bcl-2家族蛋白
恶性胶质瘤(malignant glioma)是中枢神经系统内常见的原发性恶性肿瘤,约占原发性脑肿瘤的60%[1]。其恶性程度高,治疗效果差,手术治疗联合化疗、放疗后患者的中位生存期仍不足1年[2]。化学疗法是恶性胶质瘤手术后主要治疗手段之一,但药物的耐药性和血脑屏障问题使药物疗效欠佳[3],亟待研究新型抗恶性胶质瘤药物。
3β,5α,6β-三羟基胆甾烷(cholestane-3β,5α,6β-triol,Triol)是一种氧化型胆固醇分子,具有很强的脂溶性。有研究报道,Triol对多种肿瘤细胞具有生长抑制作用,包括肝癌细胞、肺癌细胞和乳腺癌细胞等[4]。然而,它对恶性胶质瘤是否也具有抑制作用以及其抗肿瘤的作用机制还未研究。本实验主要研究Triol对恶性胶质瘤细胞的作用,并进一步探索其机制,为后续Triol抗胶质瘤的研究提供先导实验依据。
材 料 和 方 法
1材料
1.1药物与试剂 Triol、MTT、Hoechst 33342 和DMSO均购于Sigma。DMEM培养基和胎牛血清购于Gibco。Caspase-3、caspase-8和caspase-9 活性检测试剂盒购于Promega。TUNEL试剂盒购于Roche。DAPI试剂盒购于Life Technologies。抗Bcl-2(I抗)购于Cell Signaling Technology,抗Bcl-xL、抗Bak和抗Bax购于Santa Cruz;鼠II抗和兔II抗购于Cell Signaling Technology。
1.2细胞株及细胞培养 大鼠胶质瘤细胞株C6(购于ATCC)和人胶质母细胞瘤细胞株A172(购于中国科学院典型培养物保藏委员会细胞库)培养在含10%胎牛血清、1×105U/L青霉素及0.1 g/L链霉素的DMEM完全培养基中,置5% CO2、37 ℃恒温密闭孵箱内培养。
1.3仪器 荧光显微镜(Olympus);自动酶联免疫检测仪Model12550(Bio-Rad);化学发光成像仪(Bio-Rad);多标记分析仪Infimite F500(Tecan)。
2方法
2.1MTT法检测细胞存活率 取对数生长期的细胞,以2×107/L密度(每孔100 μL)种于96孔板中。待细胞完全贴壁后,加入不同浓度Triol,每组设3个复孔。培养48 h,每孔避光加入5 g/L MTT 20 μL,继续避光37 ℃孵育4 h。吸弃上清液,每孔加入100 μL DMSO,振荡5 min,在酶联免疫检测仪上570 nm 波长处测定各孔的吸光度(A),以表示相对细胞数。根据公式:细胞存活率(%)=给药组A值/对照组A值×100%,计算出各组的细胞存活率。
2.2Hoechst 33342染色检测细胞凋亡 取对数生长期的细胞,以5×107/L密度(每孔2 mL)种于6孔板培养。待细胞完全贴壁,加入Triol继续培养48 h。同时设对照组。使用5 mg/L Hoechst 33342避光染色20 min,在荧光显微镜下以340 nm的激发光波长观察染色情况。
2.3TUNEL法检测细胞凋亡 同方法2.2,设Triol处理组和对照组,培养48 h。染色步骤严格按照TUNEL检测试剂盒说明书操作。简述如下:细胞经PBS洗涤1次,再用4%多聚甲醛室温固定60 min。用PBS洗涤1次,加入含0.1% Triton X-100的PBS,冰上孵育2 min。用PBS洗涤2次,样品上加入50 μL TUNEL混合检测液(TdT + 荧光素标记的dUTP),37 ℃湿盒避光孵育60 min。PBS洗涤3次,再用DAPI复染,封片。在荧光显微镜下观察染色情况。每组取5个不重复视野,每个视野连续数约300个细胞,计每个视野凋亡细胞数(TUNEL阳性细胞数)和细胞总数(DAPI阳性细胞数),并计算凋亡指数(apoptotic index,AI;%)=凋亡细胞数/细胞总数×100%,取平均值。
2.4半胱氨酸天冬氨酸蛋白酶(caspase)活性的测定 取对数生长期的细胞,以2×107/L密度(每孔100 μL)种于96孔板中。待细胞完全贴壁后,分别加入Triol培养12 h、24 h和48 h,每种处理均设对照组,避光加入等体积的caspase-3检测剂,混匀后,37 ℃避光孵育0.5 h。多标记分析仪上以498 nm的激发波长、521 nm的发射波长测定各孔的荧光强度。为使caspase-3的相对活性不受各组存活细胞数目影响,故用每组的相对细胞数(A值)进行校正,得出公式:caspase-3相对活性(%)=(给药组荧光度/给药组相对细胞数)/(对照组荧光度/对照组相对细胞数)×100%。Caspase-8和caspase-9的活性测定方法同上。
2.5蛋白免疫印迹分析(Western blotting) 取对数生长期C6细胞,贴壁培养12 h,加20 μmol/L Triol,分别处理12 h、24 h和48 h后收集细胞。PBS洗涤2遍,加入蛋白提取液抽提总蛋白。蛋白采用BCA法定量,加入5×SDS样品缓冲液,100 ℃沸水中加热5 min。经12% SDS-PAGE电泳分离,转移到PVDF膜,5% 脱脂奶粉37 ℃封闭2 h,Ⅰ抗4 ℃孵育过夜,以tubulin作为内参照,1∶2 000稀释的HRP标记的Ⅱ抗室温孵育1 h,化学发光法分析蛋白表达。
3统计学处理
每个组别设置3个平行对照组,每次实验重复进行3次。数据以均数±标准差(mean±SD)表示。数据输入SPSS 11.0软件中,用方差分析方法(ANOVA)及Dunnett法比较组间差异。以P<0.05为差异有统计学意义。
结 果
1Triol对C6细胞存活率的影响
10、15、20和25 μmol/L Triol处理C6细胞48 h后,细胞存活率分别为(86.0±4.6)%、(79.4±7.4)%、(33.4±4.3)% 和(7.8±1.1)%。IC50= (17.8±0.6) μmol/L。20 μmol/L Triol分别处理细胞12 h、24 h和48 h后,细胞存活率分别为(84.4±6.0)%、(73.0±5.9)%和 (37.4±3.1) %。各实验组与对照组相比,差异均有统计学意义。上述结果表明,C6细胞经Triol处理后,细胞的存活率呈剂量和时间依赖性降低,见图1。
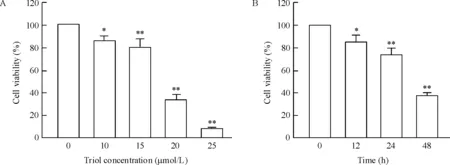
Figure 1. Triol decreased the viability of C6 cells in a concentration- and time-dependent manner. A: C6 cells were incubated with 10, 15, 20, and 25 μmol/L Triol for 48 h; B: C6 cells were incubated with 20 μmol/L Triol for 12, 24, and 48 h. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol(0 μmol/L or 0 h).
图1Triol对C6细胞存活率的影响
2Triol对C6细胞凋亡的影响
如图2A所示,20 μmol/L Triol处理C6细胞48 h后,细胞突起消失、胞体变圆。为研究Triol是否可诱导C6细胞的凋亡,我们采用Hoechst 33342进行细胞核染色。与对照组相比,给药组中的细胞出现明显的核形态改变:核凝结和核固缩,符合凋亡细胞的核形态特征。同时,我们采用TUNEL法检测细胞凋亡情况,并采用DAPI复染定位细胞核。如图2B所示,Triol组中可见数量较多的红色荧光,被染红色的凋亡细胞核呈圆形浓缩状,细胞数量明显减少,凋亡现象明显。通过数细胞对TUNEL染色定量,计算出Triol组和对照组的AI分别为:(52.30±4.11)%和(5.11±1.97)%(P<0.01),见图2C。20 μmol/L Triol处理C6细胞12 h、24 h和48 h后,caspase-3活性显著升高,且呈现时间依赖性,见图2D。上述结果表明Triol能够诱导C6细胞凋亡。
3Triol对C6细胞caspase-8和caspase-9活性影响
如图3所示,20 μmol/L Triol处理C6细胞12 h、24 h和48 h后, caspase-8和caspase-9活性均显著升高,且呈现时间依赖性。这表明Triol通过caspase级联反应介导C6细胞的凋亡。
4Bcl-2家族蛋白在Triol诱导C6细胞凋亡中的作用
如图4所示,20 μmol/L Triol作用C6细胞12 h、24 h和48 h后,促凋亡蛋白Bak表达水平随时间显著升高(P<0.01),而Bax表达水平不变。抗凋亡蛋白Bcl-2和Bcl-xL表达水平均随时间不同程度地下调。上述结果表明,Triol作用C6细胞0~48 h,促凋亡蛋白Bak、Bax相对抗凋亡蛋白 Bcl-2、Bcl-xL的比例升高,提示Triol很可能通过调整Bcl-2家族蛋白的比例来影响线粒体膜的稳定性,从而诱发线粒体依赖的凋亡。
5Triol对人胶质母细胞瘤A172细胞凋亡的影响
如图5A、B所示,采用MTT法检测不同浓度Triol对A172细胞作用不同时间的细胞存活率。Triol处理细胞48 h,计算得 IC50=(20.6±0.2) μmol/L。Triol可呈剂量和时间依赖性降低A172细胞的存活率。Hoechst 33342染色结果显示,与对照组相比,给药组中的细胞出现了明显的凋亡细胞核象,见图5C。TUNEL检测结果显示,Triol组中可见致密浓染的红色荧光,出现红色集聚碎片,凋亡现象明显。Triol组和对照组的AI分别为(35.71±6.03)% 和(4.70±1.54)%(P< 0.01),见图5D、E。凋亡执行酶caspase-3的活性随时间显著升高,48 h后达到对照组的10倍,见图5F。以上结果说明Triol也可通过caspase介导的通路诱导人胶质母细胞瘤细胞A172的凋亡。
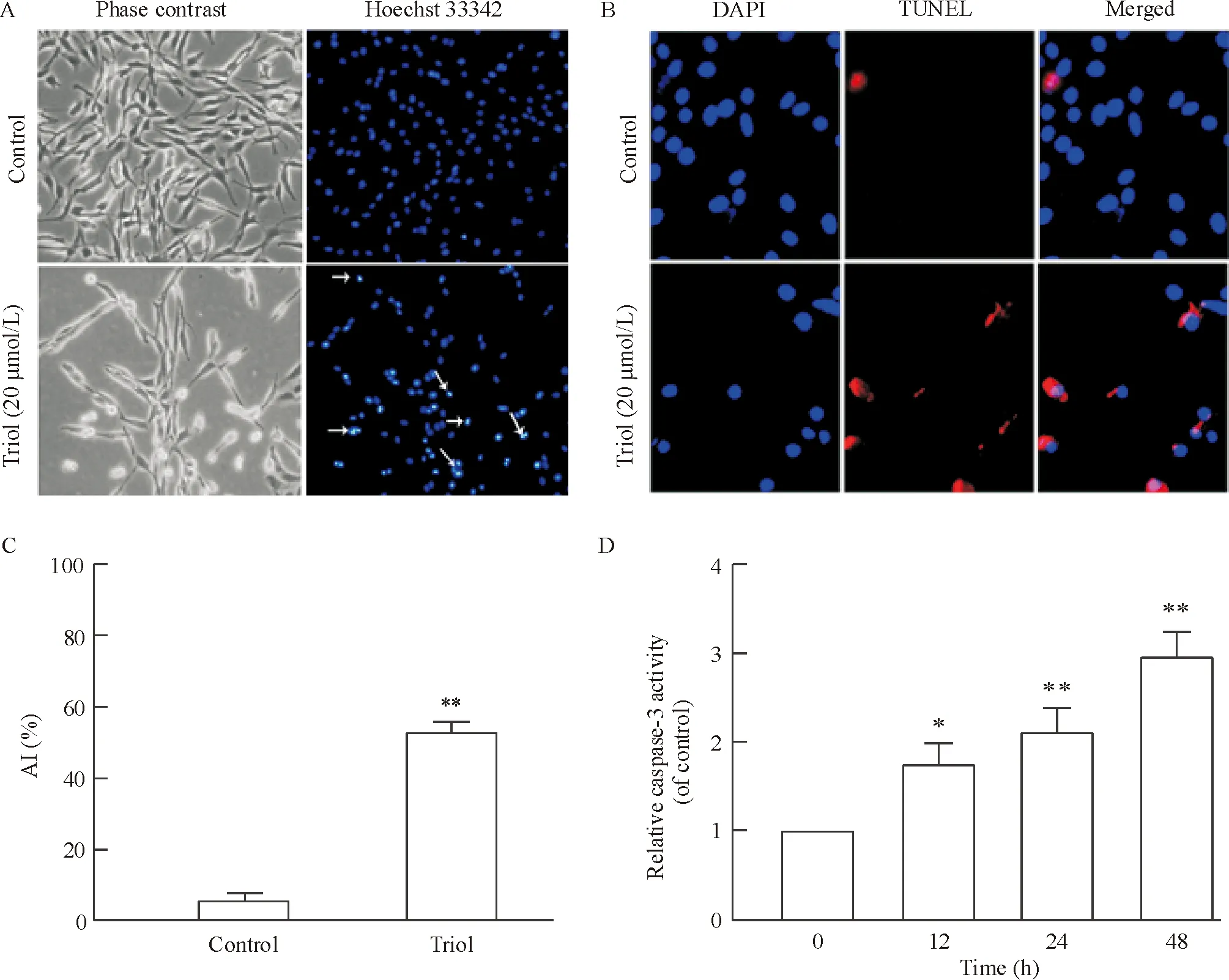
Figure 2. Triol induced the apoptosis of C6 cells. A: Hoechst 33342 staining of C6 cells (×100). B: TUNEL staining of C6 cells (×400). C6 cells were incubated with 20 μmol/L Triol for 48 h. C: statistical analysis of apoptotic index (AI) based on TUNEL staining. D: effect of Triol on caspase-3 activity in C6 cells. C6 cells were incubated with 20 μmol/L for indicated time. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol or 0 h.
图2Triol对C6细胞凋亡的影响
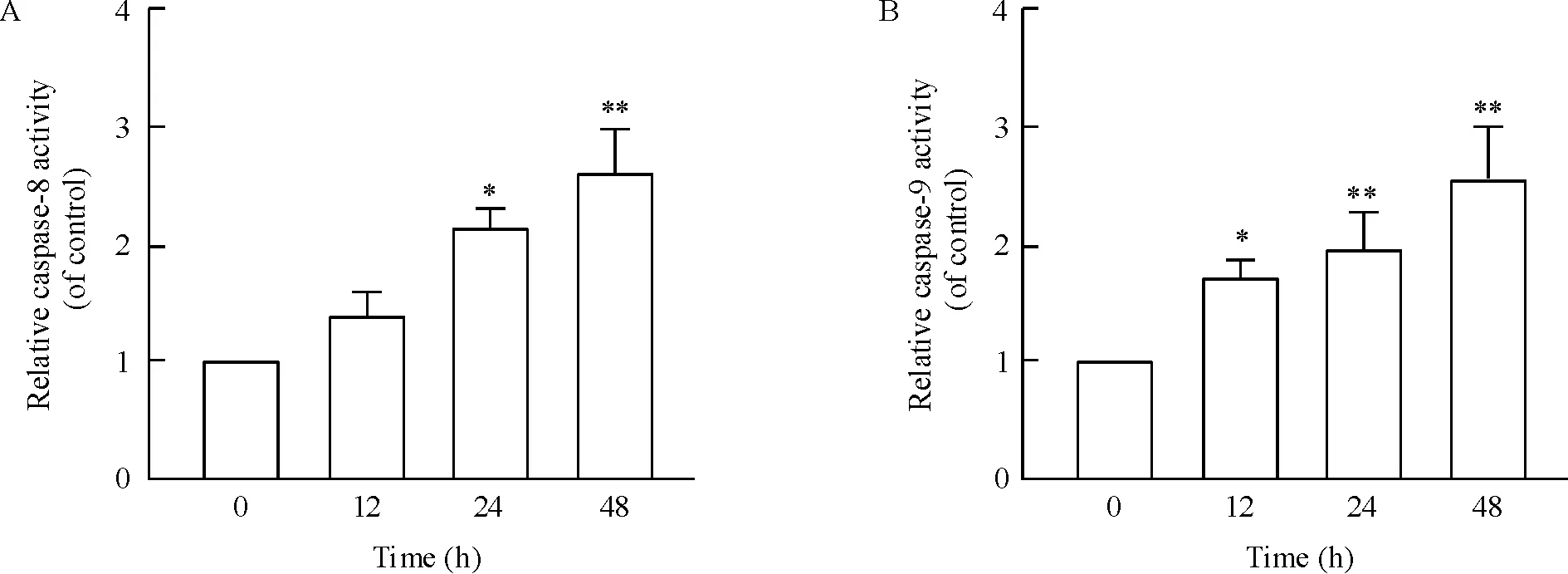
Figure 3. Triol activated caspase-8 (A) and caspase-9 (B) in C6 cells. C6 cells were incubated with 20 μmol/L for 12, 24, and 48 h.Mean±SD.n=3.*P<0.05,**P<0.01vs0 h.
图3Triol对C6细胞caspase-8和caspase-9活性的影响
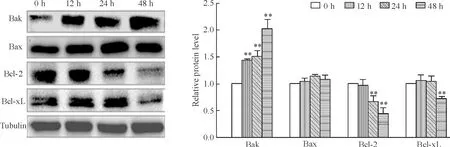
Figure 4. Triol altered the expression of Bcl-2 family proteins. C6 cells were treated with 20 μmol/L Triol for 12, 24, and 48 h, and then protein levels of Bak, Bax, Bcl-2, and Bcl-xL were determined by Western blotting.Mean±SD.n=3.**P<0.01vs0 h.
图4Triol对C6细胞Bcl-2家族蛋白表达的影响
讨 论
恶性胶质瘤是颅内最常见的中枢神经系统肿瘤,占原发性脑肿瘤的60%,它恶性程度高,生长迅速,患者常常在确诊后不超过12个月即死亡。目前临床对恶性胶质瘤患者,采用手术后联合放化疗的综合疗法[5]。然而外科手术常常不能将其完全切除,患者不久后即复发。而化学疗法作为恶性胶质瘤主要治疗手段之一,存在多数化疗药物血脑屏障穿透性差和易诱发耐药性等问题,治疗效果不理想。目前临床上治疗恶性程度最高的胶质母细胞瘤的一线药物有且只有烷化剂替莫唑胺,它可通过血脑屏障,但是仅对25%~40%的病人有效[6]。因此,开发更多具有血脑屏障穿透性潜能的新型化疗药物,成为恶性胶质瘤治疗的重点和热点。
Triol是一种内源性的氧化型胆固醇(oxysterols,Ch-Ox),之前的研究证明Triol可以诱导血管平滑肌细胞、血管内皮细胞凋亡和大鼠骨髓基质细胞等凋亡,其作用可能与细胞内活性氧(ROS)大量产生或细胞内Ca2+超载有关[7-9]。有研究显示,多种内源性Ch-Ox及对其结构改造的类似物均有对抗多种肿瘤的作用,例如肝癌、肺癌和乳腺癌等,但对恶性胶质瘤尚未有相关研究[4]。在本研究中,我们发现Triol能呈时间和剂量依赖性地抑制恶性胶质瘤细胞的生长,且这种作用是通过诱导凋亡引起的。我们的结果提示,内源性Ch-Ox除了能抗肝癌、肺癌、乳腺癌等肿瘤,对恶性胶质瘤也具有抑制作用。
细胞凋亡的途径主要有线粒体通路(内通路)和死亡受体通路(外通路),天冬氨酸半胱氨酸蛋白酶caspase家族在2条通路中都起着非常重要的作用[10]。内通路的激活是由凋亡诱导物引发细胞色素C从线粒体释放到胞浆。细胞色素C在dATP存在下,与信号接头分子Apaf-1结合,募集并激活caspase-9。外通路是死亡受体通过与“死亡配体”特异性结合后,进而活化caspase-8。另外活化的caspase-8也可通过活化Bcl-2家族蛋白Bid间接导致细胞色素C的释放。因此Bid将凋亡信号从死亡受体通路传递到线粒体通路,把2条凋亡通路联系起来[11]。Caspase-3是caspase级联反应的最终执行分子[12]。本研究结果显示,Triol作用于C6细胞12 h~48 h,caspase-3、caspase-8和caspase-9活性均显著性升高。因此,Triol诱导C6细胞凋亡的作用,既通过线粒体通路,又通过死亡受体通路。同样我们发现人胶质瘤A172细胞也有相似的结果,caspase-3活性在Triol处理A172细胞12 h~48 h也呈时间依赖性显著升高。与本实验结果相似,Yang等[13]观察到与Triol结构相似的25-羟基胆甾烷能诱导纤维细胞系CHO-K1凋亡,同样发现caspase-8和caspase-9的激活。另外,Lee等[14]研究发现,25-羟基胆甾烷和7β-羟基胆甾烷作用血管平滑肌细胞,能引起Fas和Fas配体水平的升高,从而激活caspase-8介导的死亡受体通路。
Bcl-2家族蛋白的促凋亡和抗凋亡成员对细胞凋亡起重要的调控作用。正常情况下,细胞内的Bcl-2家族促凋亡和抗凋亡蛋白的表达量处于相对的稳态。当细胞受到凋亡刺激后,通过上游凋亡信号转导通路,促凋亡成员活化,然后转位线粒体,一方面激活Bax等促凋亡蛋白,另一方面与线粒体膜上的Bcl-2等抗凋亡成员相互作用,从而引起线粒体通透性转变、线粒体膜电位丢失以及线粒体内含物(如细胞色素C)释放[15]。本研究中,Bak表达水平上调,而Bax表达水平不变,Bcl-2和Bcl-xL表达水平下调,促凋亡蛋白/抗凋亡蛋白的比值升高。促凋亡 / 抗凋亡蛋白比例升高,可引起促凋亡和抗凋亡的异源二聚体减少,促凋亡蛋白同源二聚体增多,这种变化可以促进线粒体膜通透性提高,并最终引起细胞发生线粒体依赖性凋亡[16]。因此,在Triol诱导的C6细胞凋亡的过程中,Bcl-2促凋亡/ 凋亡蛋白的比例失调起着重要的调控作用。从表达水平的动态变化时程,我们观察到Bak在12 h即明显上调,与caspase-3的激活时间匹配,而Bcl-2和Bcl-xL的下调发生在24 h甚至48 h,说明Bak表达上调可能为介导线粒体依赖性凋亡的早期调控事件,而Bcl-2和Bcl-xL的表达下调则可能为一种后续变化,进一步加强Triol破坏线粒体膜稳定性的作用。与本实验结果相似的是,有研究报道25-羟基胆甾烷和7β-羟基胆甾烷诱导单核细胞 THP-1凋亡后,Bcl-2 表达水平随时间降低,而 Bax 无变化[17]。Rusinol等[18]发现,25-羟基胆甾烷、7-酮基胆甾烷作用小鼠淋巴样瘤细胞 P388D1 后,Bim 和 Bad 活化,同时Bcl-xL表达水平下调。尽管这些Ch-Ox作用于不同的Bcl-2家族蛋白,但对细胞凋亡的调控作用均与促凋亡/抗凋亡蛋白的比例升高有关。
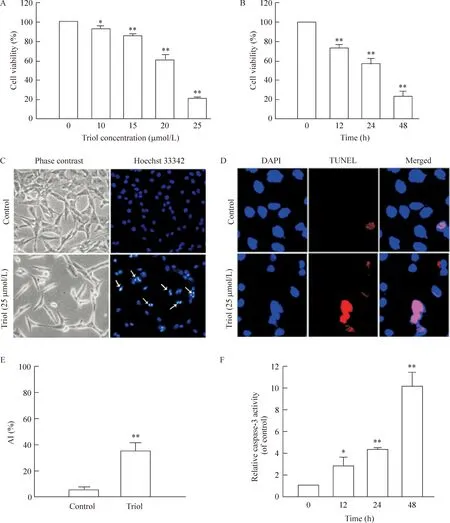
Figure 5. Triol also triggered the apoptosis of human glioblastoma A172 cells. A: concentration-dependent effect of Triol on the cell viability. A172 cells were incubated with 10, 15, 20, and 25 μmol/L Triol for 48 h. B: time-dependent effect of Triol on the cell viability. A172 cells were incubated with 25 μmol/L Triol for 12, 24, and 48 h. C: Hoechst 33342 staining of A172 cells (×100). D: TUNEL staining of A172 cells (×400). A172 cells were incubated with 25 μmol/L Triol for 48 h. E: statistical analysis of apoptotic index (AI) based on TUNEL staining. F: effect of Triol on caspase-3 activity in A172 cells. A172 cells were incubated with 25 μmol/L Triol for 12, 24, and 48 h. Mean±SD.n=3.*P<0.05,**P<0.01vscontrol(0 μmol/L or 0 h).
图5Triol对人胶质母细胞瘤A172细胞诱导凋亡的作用
综上所述,Triol可诱导恶性胶质瘤细胞的凋亡。Caspase-3、caspase-8和caspase-9活性的升高提示,Triol通过激活死亡受体通路和线粒体通路促使凋亡的发生,且Bcl-2家族促凋亡与抗凋亡蛋白的比例失衡参于凋亡进程的调节。本实验首次研究了内源性氧化型胆固醇Triol抗恶性胶质瘤细胞的作用,并对其机制进行探索,为Triol后续抗胶质瘤方面的研究提供先导实验依据。另外,后续实验可进一步通过对Triol结构进行改造,增加血脑屏障透过率和药物效应,从而研发出新的高效抗胶质瘤药物。
[1] DeAngelis LM. Brain tumors[J]. N Engl J Med, 2001, 344(2):114-123.
[2] Prados MD, Levin V. Biology and treatment of malignant glioma[J]. Semin Oncol, 2000, 27(3 Suppl 6):1-10.
[3] Kortmann RD, Jeremic B, Weller M, et al. Radiochemotherapy of malignant glioma in adults[J]. Strahlenther Onkol, 2003, 179(4):219-232.
[4] Carvalho JF, Silva MM, Moreira JN, et al. Sterols as anticancer agents: synthesis of ring-B oxygenated steroids, cytotoxic profile, and comprehensive SAR analysis[J]. J Med Chem, 2010, 53(21):7632-7638.
[5] 胡 婷,钟雪云. MicroRNA在脑胶质瘤中的作用[J]. 中国病理生理杂志, 2011, 27(7): 1431-1437,1444.
[6] Chamberlain MC. Temozolomide: therapeutic limitations in the treatment of adult high-grade gliomas[J]. Expert Rev Neurother, 2010, 10(10):1537-1544.
[7] Liu H, Yuan L, Xu S, et al. Cholestane-3β,5α,6β-triol inhibits osteoblastic differentiation and promotes apoptosis of rat bone marrow stromal cells[J]. J Cell Biochem, 2005, 96(1):198-208.
[8] Liu H, Wang T, Huang K. Cholestane-3β,5α,6β-triol-induced reactive oxygen species production promotes mitochondrial dysfunction in isolated mice liver mitochondria[J]. Chem Biol Interact, 2009, 179(2-3): 81-87.
[9] 崔 鸣, 陈凤荣, 宋清华, 等. 氨氯地平抑制氧化型胆固醇诱导的血管内皮细胞凋亡[J]. 中国病理生理杂志, 2001, 17(2):104-107.
[10] Elmore S. Apoptosis: a review of programmed cell death[J]. Toxicol Pathol, 2007, 35(4):495-516.
[11] Fiandalo MV, Kyprianou N. Caspase control: protagonists of cancer cell apoptosis[J]. Exp Oncol, 2012, 34(3):165-175.
[12] Kroemer G, Reed JC. Mitochondrial control of cell death[J]. Nat Med, 2000, 6(5):513-519.
[13] Yang L, Sinensky MS. 25-Hydroxycholesterol activates a cytochromecrelease-mediated caspase cascade[J]. Biochem Biophys Res Commun, 2000, 278(3):557-563.
[14] Lee T, Chau L. Fas/Fas ligand-mediated death pathway is involved in oxLDL-induced apoptosis in vascular smooth muscle cells[J]. Am J Physiol Cell Physiol, 2001, 280(3):C709-C718.
[15] Ghibelli L, Diederich M. Multistep and multitask Bax activation[J]. Mitochondrion, 2010, 10(6):604-613.
[16] Skommer J, Wlidkowic D, Deptala A. Larger than life: mitochondria and the Bcl-2 family[J]. Leuk Res, 2007, 31(3):277-286.
[17] Lima HK, Kangb HK, Yoob ES, et al. Oxysterols induce apoptosis and accumulation of cell cycle at G2/M phase in the human monocytic THP-1 cell line[J]. Life Sci, 2003, 72(12):1389-1399.
Cholestane-3β,5α,6β-triolinducesapoptosisofmalignantgliomacells
XIE Shan-shan1, ZHU Wen-bo1, YAN Min1, LIN Yuan1, ZHANG Hai-peng1, QIU Peng-xin1, SU Xing-wen1, YAN Guang-mei1, HU Hai-yan2
(1DepartmentofPharmacology,ZhongshanSchoolofMedicine,2SchoolofPharmaceuticalSciences,SunYat-senUniversity,Guangzhou510006,China.E-mail:lsshhy@mail.sysu.edu.cn)
AIM: To investigate the effect of cholestane-3β, 5α, 6β-triol (Triol) on apoptosis of malignant glioma cells.METHODSC6 cells and A172 cells were incubated with Triol at different concentrations for different time durations. MTT assay was used to detect the cell viability. Hoechst 3f3342 staining and TUNEL assay were used to analyze the cell apoptosis. The caspase activity was measured. The expression of apoptosis-related proteins, Bcl-2 family members, was determined by Western blotting.RESULTSTriol decreased the cell viability of C6 and A172 cells in a dose- and time-dependent manner and the IC50values were (17.8±0.6)μmol/L and (20.6±0.2) μmol/L, respectively. Visible nuclei with apoptotic characteristics, significant increase in TUNEL-positive cells, and the activation of apoptotic execution enzyme caspase-3 indicated that cell apoptosis was induced by Triol in both cell lines. After C6 cells were exposed to Triol for 12 h, 24 h and 48 h, the activity of caspase-8 in extrinsic apoptotic pathway and caspase-9 in intrinsic apoptotic pathway was increased time-dependently. Meanwhile, the levels of anti-apoptotic proteins, Bcl-2 and Bcl-xL, was down-regulated, while pro-apoptotic protein Bak was up-regulated in a time-dependent manner.CONCLUSIONTriol induces apoptosis of malignant glioma cells by activating intrinsic and extrinsic apoptotic pathways, and Bcl-2 family members are involved in Triol-induced apoptosis.
Cholestane-3β, 5α, 6β-triol; Glioma; Apoptosis; Bcl-2 family
R363
A
10.3969/j.issn.1000- 4718.2013.04.013
1000- 4718(2013)04- 0647- 07
2012- 12- 18
2013- 02- 20
国家自然科学基金资助项目(No. 81173045);广东华南新药创制中心神经与肿瘤药理学合作平台项目(No. 2009ZX09301-015);广东省自然科学基金资助项目(No. 10451008901004893)
△通讯作者 Tel: 020-39943118; E-mail: lsshhy@mail.sysu.edu.cn
