胃泌素促进胃癌细胞的迁移和侵袭*
2013-10-25周建奖
刘 骏, 周建奖,2△, 赵 艳, 谢 渊
(贵阳医学院 1分子生物学重点实验室, 2附属医院检验科, 贵州 贵阳550004)
·短篇论著·
胃泌素促进胃癌细胞的迁移和侵袭*
刘 骏1, 周建奖1,2△, 赵 艳1, 谢 渊1
(贵阳医学院1分子生物学重点实验室,2附属医院检验科, 贵州 贵阳550004)
目的研究胃泌素在胃癌细胞迁移和侵袭中的作用。方法用细胞划痕实验、Transwell小室迁移和侵袭实验检测10 nmol/L和100 nmol/L胃泌素处理后胃癌细胞AGS和SGC-7901迁移和侵袭能力的变化, MTT法检测细胞增殖能力, ELISA法检测细胞上清液中基质金属蛋白酶2(MMP- 2)的含量。结果10 nmol/L和100 nmol/L胃泌素处理胃癌细胞后,细胞迁移和侵袭能力增强。对照组、10 nmol/L和100 nmol/L胃泌素组AGS细胞平均迁移数分别为56.0、88.1和106.4 /view,SGC-7901细胞平均迁移数分别为52.8、91.0和113.3 /view, AGS细胞平均侵袭数分别为78.4、118.7和141.6 /view,SGC-7901细胞平均侵袭数分别为87.3、124.6和147.4/view(均P<0.01);100 nmol/L胃泌素组细胞迁移和侵袭能力均高于10 nmol/L组(P<0.05);胃泌素处理后细胞的增殖率及MMP- 2的分泌量也显著增加(P<0.05)。结论胃泌素通过促进MMP- 2的分泌以剂量依赖的方式增强胃癌细胞的迁移和侵袭能力,可能是体内胃癌细胞增殖、侵袭和转移的重要机制之一。
胃泌素; 胃肿瘤; 基质金属蛋白酶2
胃癌是严重威胁人类健康的主要恶性肿瘤之一,其致死率居全球所有恶性肿瘤死亡的第2位[1]。迄今为止,胃癌的发病机制尚不清楚,近年的研究表明,胃癌的发生与胃肠道激素的表达异常有关,胃泌素(gastrin)即为其中重要的一种。胃泌素是一种胃肠肽激素,具有促进胃酸分泌等生理功能。但是近年的研究发现,病理情况下胃泌素能促进胃肠癌、胰腺癌及肝癌等胃肠道恶性肿瘤细胞的增殖[2- 4],从而提出胃肠道肿瘤与胃泌素自分泌环假说密切相关,即胃肠道肿瘤细胞既能分泌胃泌素,又能表达胃泌素受体(又称为胆囊收缩素B受体,cholecystokinin B receptor,CCKB受体),胃泌素与细胞膜上的CCKB受体结合后,促进胃肠道肿瘤的发生发展[5]。但是目前胃泌素与胃癌的研究主要集中在细胞的增殖方面,与胃癌细胞侵袭转移的关系尚未见报道。本研究用不同浓度的胃泌素处理胃癌细胞,研究胃泌素对胃癌细胞增殖、迁移和侵袭能力的影响,为胃癌转移的基础研究提供理论依据。
材 料 和 方 法
1材料
人胃癌细胞株AGS(ATCC: CRL-1739TM)和SGC-7901由本实验室保存;人胃泌素(human gastrin-17,G-17)和MTT(Sigma);基质金属蛋白酶2(matrix metalloproteinase 2,MMP-2)ELISA试剂盒和基质胶(R&D);Transwell小室(Corning);胎牛血清(Gibco);改良型RPMI-1640培养基和双抗(HyClone);DMSO(Ruitaibio);RT-PCR试剂盒(天根生物);其余试剂为国产分析纯。
2方法
2.1细胞培养及胃泌素处理 人胃癌细胞株AGS和SGC-7901分别培养于含10%胎牛血清的RPMI-1640培养液中,于37 ℃、5% CO2条件下培养。分别用终浓度为10 nmol/L和100 nmol/L胃泌素处理细胞,培养6~8 d后备用,所有实验均以未经胃泌素处理的细胞为对照组。
2.2细胞划痕实验 于12 孔培养板中接种上述细胞,细胞数为5×105cells/well,过夜培养。细胞铺满后,用细胞刮通过孔中心划一条宽度相等的横行细胞刮除带,吸掉含有刮除细胞的培养液,分别加入含终浓度为10 nmol/L和100 nmol/L胃泌素的培养液400 μL/well,37 ℃、5% CO2培养,于0 h和培养24 h后倒置显微镜下拍照,实验重复3次。
2.3Transwell小室细胞侵袭实验 预冷的无血清RPMI-1640培养液以1∶6体积稀释液态基质胶,于24孔培养板中Transwell小室的上室加稀释后基质胶40 μL,37 ℃孵育6 h。吸尽基质胶表面的液体,加入70 μL无血清RPMI-1640培养液,37 ℃孵育30 min。用含0.1%胎牛血清的RPMI-1640培养液稀释细胞到108~109cells/L。上室中加入200 μL稀释后的细胞,下室加含30%胎牛血清的RPMI-1640培养液600 μL,并于上、下室内加胃泌素,使之终浓度分别为10 nmol/L和100 nmol/L。37 ℃、5% CO2培养箱培养24 h后,擦掉上室中基质胶上的细胞,用1%PBS洗涤3遍,将小室置于4%多聚甲醛中固定20 min,0.1%结晶紫染色20 min,洗涤3遍,显微镜下随机选取10个视野,在400倍下计数侵袭到下室的细胞数,计算每个视野的平均侵袭细胞数,实验重复3次。
2.4Transwel小室细胞迁移实验 Transwell小室迁移实验除上室中不加基质胶、细胞悬液的密度为107~108cells/L、下室中加含10%胎牛血清的RPMI-1640培养液外,其余方法同Transwell小室侵袭实验,最后计算平均迁移细胞数,实验重复3次。
2.5MTT实验 96孔培养板中接种细胞5 000 cells/well,加入胃泌素,使之终浓度为10 nmol/L和100 nmol/L,设8个复孔,于37 ℃、5% CO2培养箱中培养3 d,每孔加入MTT溶液(5 g/L)20 μL,37 ℃继续培养4 h,弃上清,每孔加入150 μL DMSO,振荡10 min,酶标仪测A570,计算细胞的相对增殖率,相对增殖率(%)=A570实验组/A570对照组×100%。
2.6ELISA实验 用10 nmol/L和100 nmol/L胃泌素处理细胞,于收集上清液前12 h换成仅含胃泌素而不含血清的RPMI-1640培养液,上清液离心后用Bradford定量蛋白浓度, ELISA试剂盒检测MMP- 2含量,按说明书操作。
3统计学处理
数据以均数±标准差(mean±SD)表示,采用SPSS 13.0统计软件进行单因素方差分析, 以P<0.05为差异有统计学意义。
结 果
1胃泌素对胃癌细胞增殖能力的影响
如图1所示, 10 nmol/L和100 nmol/L胃泌素处理AGS和SGC-7901细胞后,细胞的增殖能力显著增强,差异有统计学意义(P<0.01)。
2胃泌素对胃癌细胞迁移能力的影响
用10 nmol/L和100 nmol/L胃泌素处理AGS和SGC-7901细胞后,细胞的迁移速度快于对照组,见图2。迁移到Transwell下室的细胞数也多于对照组,结晶紫染色计数结果显示10 nmol/L和100 nmol/L胃泌素处理组的平均迁移细胞数高于对照组 (P<0.01), 100 nmol/L处理组也高于10 nmol/L处理组,差异有统计学意义(P<0.05),见图3。
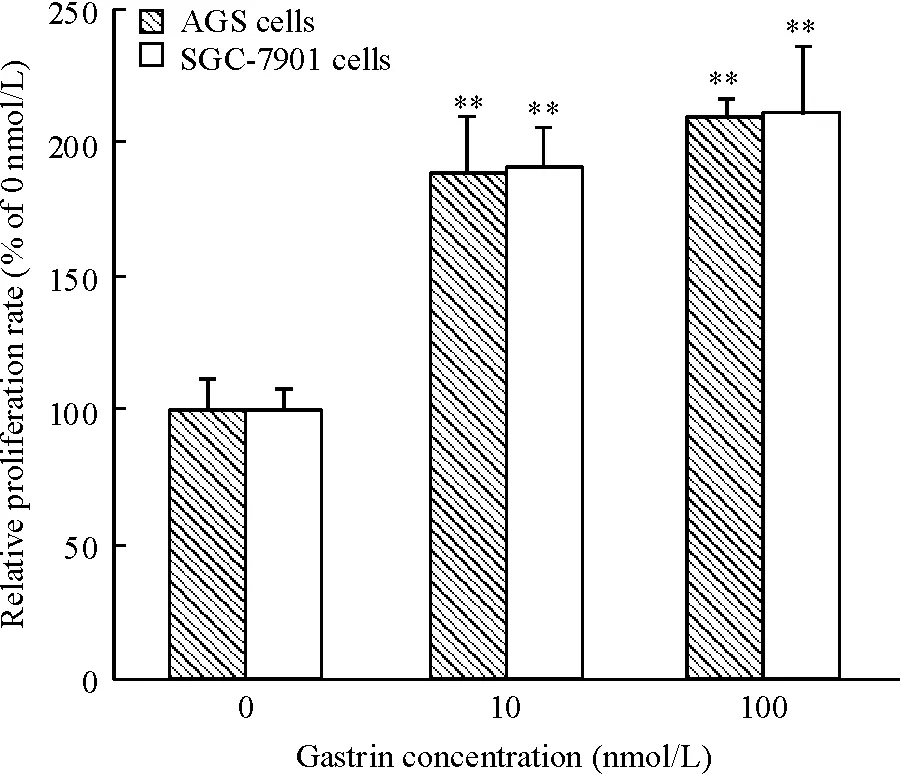
Figure 1. The proliferation rates of AGS and SGC-7901 cells determined by MTT assay. Mean±SD.n=8.**P<0.01vs0 nmol/L.
图1MTT法检测AGS和SGC-7901细胞的增殖率
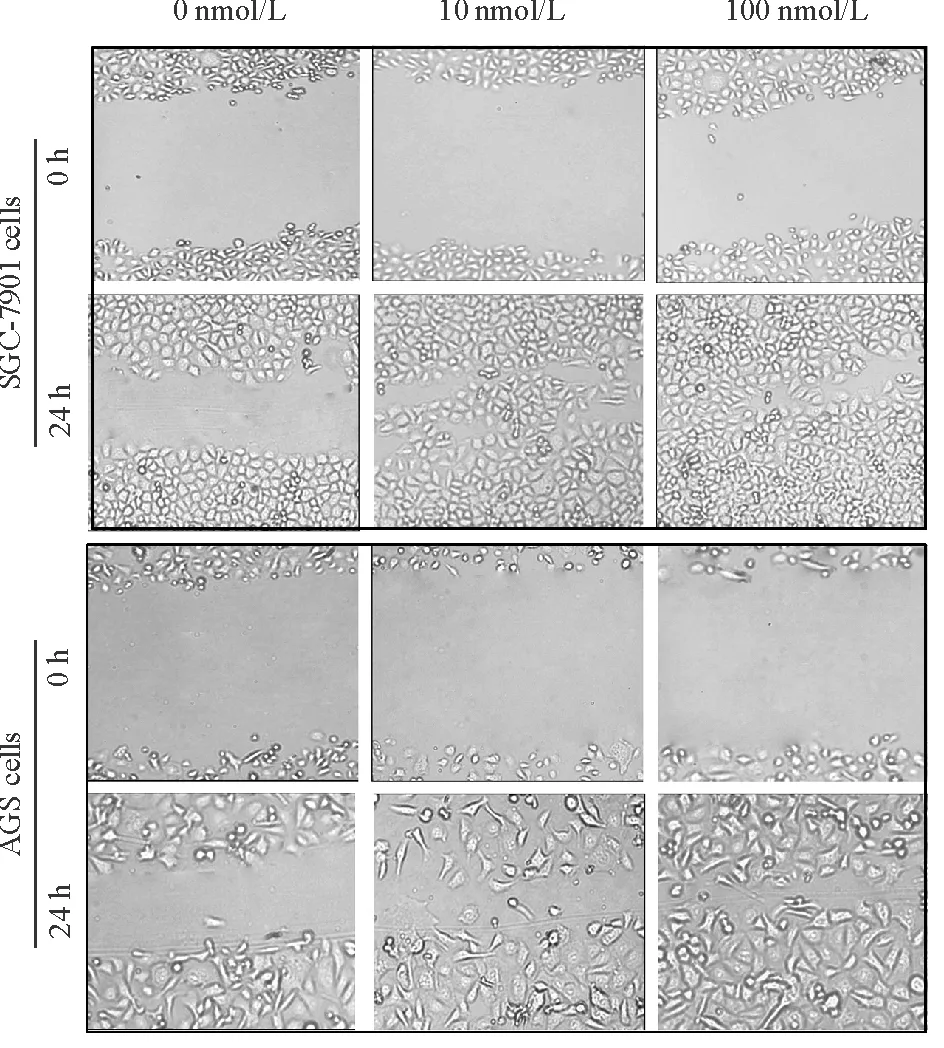
Figure 2. The migration of SGC-7901 and AGS cells after gastrin treatment determined by wound-healing assay (×100).
图2细胞划痕实验检测胃泌素处理后SGC-7901和AGS细胞的迁移
3胃泌素对胃癌细胞侵袭能力的影响
用10 nmol/L和100 nmol/L胃泌素处理AGS和SGC-7901细胞后,穿透Transwell上室基质胶及聚碳酸酯膜,侵袭到下室的细胞数显著高于对照组细胞(P<0.01),且随胃泌素浓度的增加,侵袭细胞数也增加 (P<0.05),见图4。
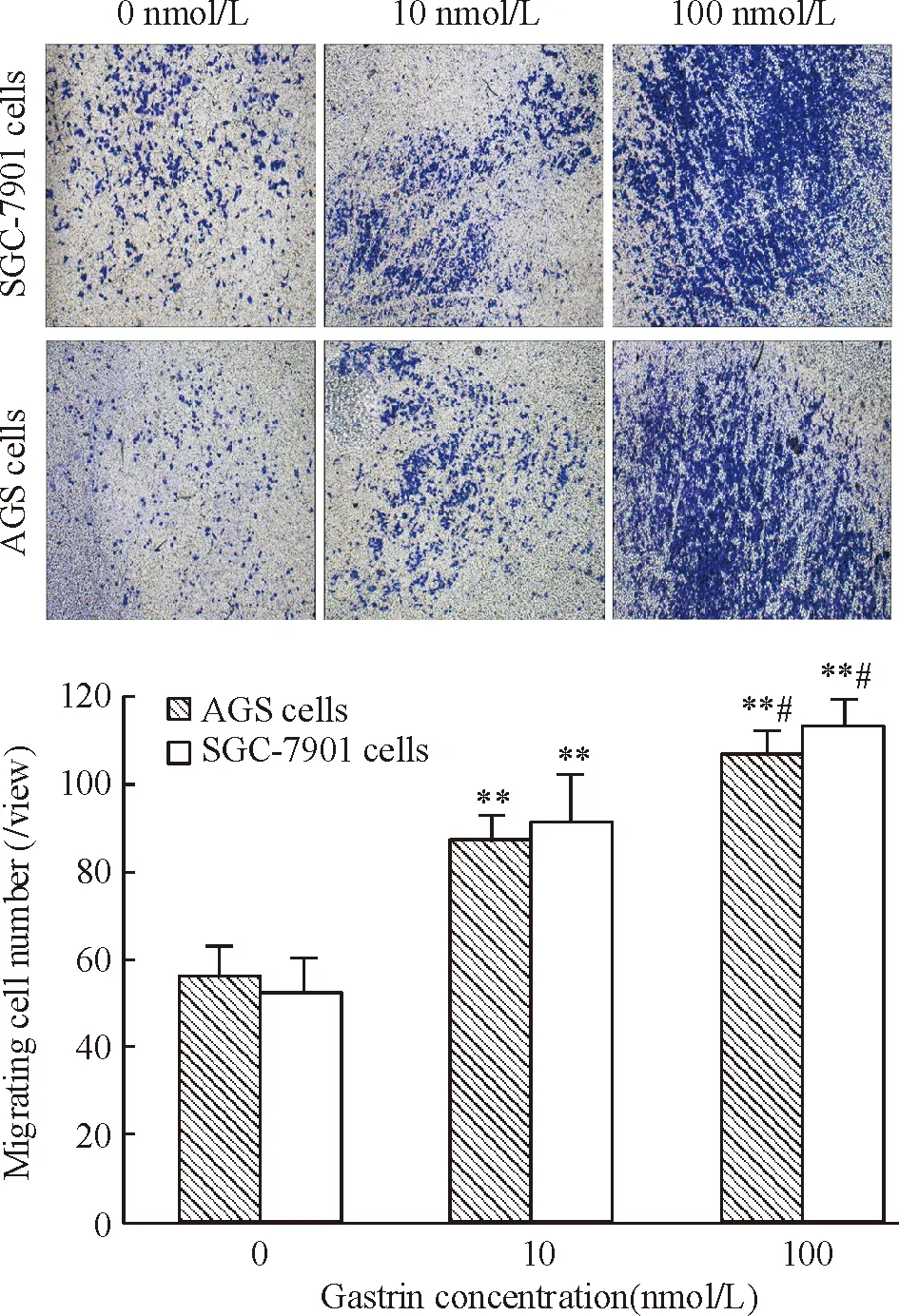
Figure 3. The migration of SGC-7901 and AGS cells after gastrin treatment determined by Transwell assay (crystal violet staining,×100). Mean±SD.n=3.**P<0.01vs0 nmol/L;##P<0.05vs10 nmol/L.
图3Transwell小室实验检测胃泌素处理后SGC-7901和AGS细胞的迁移及其细胞计数结果
4胃泌素增加胃癌细胞MMP-2分泌
10 nmol/L和100 nmol/L胃泌素处理AGS和SGC-7901细胞后,培养上清液中MMP- 2浓度高于对照组,差异有统计学意义(P<0.05),见表1。
讨 论
胃癌转移是影响患者疗效和预后的关键因素,亦是导致胃癌患者死亡的主要原因,而胃泌素与胃癌发生密切相关。有研究证实胃泌素的表达随着肿瘤分化程度的降低而显著增多,从而促进肿瘤细胞的生长,并与肿瘤的淋巴结转移有相关性[2-5]。胃癌转移是一个复杂的生物学过程,主要通过直接蔓延、淋巴道转移、血行转移和种植转移方式发生,其中胃癌细胞穿越基底膜在胃癌转移的过程中至关重要。Burkitt等[6]研究表明,胃泌素可通过MAPK 依赖性信号途径使MMP表达水平升高,而MMP对细胞外基质及基底膜的降解效应促进了胃癌细胞侵袭及转移。Takaishi等[7]在研究幽门螺杆菌感染、胃泌素及胃癌的关系指出,幽门螺杆菌感染相关性胃癌的发生发展中,胃泌素是其辅助因子。本课题组前期研究也发现:经幽门螺杆菌毒素相关蛋白CagA干预后的胃癌细胞株AGS、SGC-7901中,CagA上调胃泌素基因的表达,进一步研究发现胃癌标本中淋巴结转移组胃泌素基因的表达水平是原发肿瘤的42倍,由此推测上调的胃泌素表达可能与胃癌转移密切相关[8-9]。
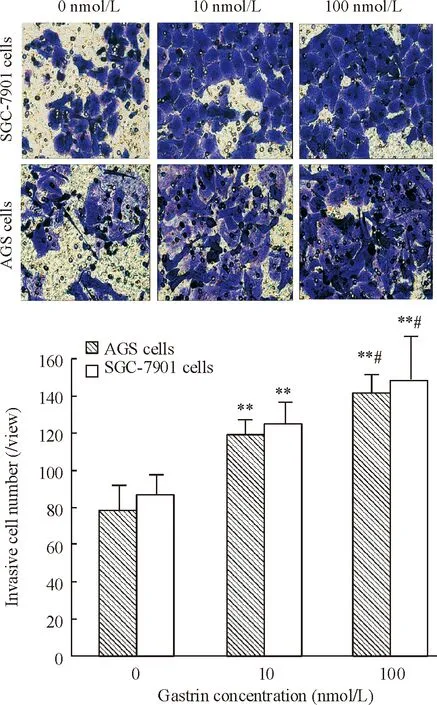
Figure 4. The invasion of SGC-7901 and AGS cells after gastrin treatment determined by Transwell assay (crystal violet staining,×400).Mean±SD.n=3.**P<0.01vs0 nmol/L;##P<0.05vs10 nmol/L.
图4Transwell小室实验检测胃泌素处理后SGC-7901和AGS细胞的侵袭及其细胞计数结果
表1胃泌素对胃癌细胞分泌MMP-2的影响
Table 1. Effects of gastrin on the secretion of MMP- 2 in gastric cancer cells [mg/(g protein).Mean±SD.n=6]
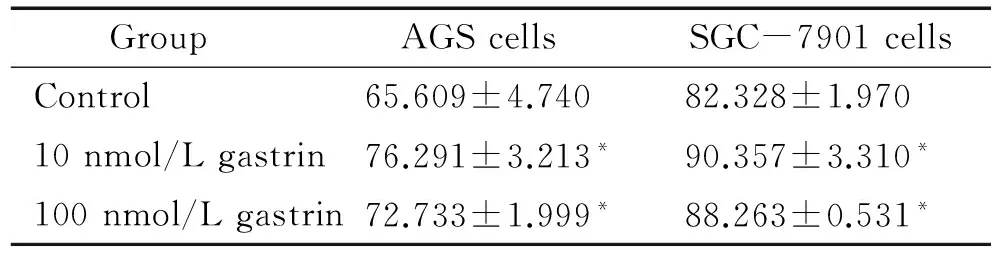
GroupAGScellsSGC-7901cellsControl65.609±4.74082.328±1.97010nmol/Lgastrin76.291±3.213*90.357±3.310*100nmol/Lgastrin72.733±1.999*88.263±0.531*
*P<0.05vscontrol group.
Transwell 小室实验和细胞划痕实验已被国内外众多学者用于肿瘤细胞迁移和侵袭的研究[10]。本研究首先通过细胞划痕和Transwell小室迁移实验发现经胃泌素处理后,细胞迁移能力显著增强,Transwell下室中迁移细胞数显著高于对照组的细胞数,且随着胃泌素浓度的增高,细胞迁移数相应增加,说明胃泌素以剂量依赖的方式增强胃癌细胞的迁移能力。随后本研究又通过Transwell小室侵袭实验证实,经10 nmol/L与100 nmol/L胃泌素处理胃癌细胞后,Transwell下室中侵袭细胞数显著高于未经胃泌素处理的细胞,且随胃泌素浓度的增加侵袭细胞数也增加,说明胃泌素能增强胃癌细胞的侵袭能力。本研究还发现胃泌素以剂量依赖的方式增强胃癌细胞的增殖能力,为细胞的迁移和侵袭提供细胞来源。
胃癌细胞发生转移的首要条件是穿越细胞外基质和基底膜,而MMPs等多个因子参与了该过程。MMPs属于锌依赖性蛋白酶超家族,它们能降解内皮细胞外基质及血管基底膜,促进肿瘤的侵袭及转移。其中MMP- 2可降解细胞外基质和血管基膜的主要成分Ⅳ型胶原,使肿瘤细胞易于脱离癌细胞巢,进出血管从而促进肿瘤的侵袭、转移。有学者的研究发现,MMP- 2的表达与淋巴结的转移和肿瘤的分期呈正相关[11]。本研究显示胃泌素以剂量依赖的方式增强胃癌细胞分泌MMP- 2能力,可能是胃泌素促进胃癌细胞在体外迁移和侵袭的重要机制。也有学者发现随着胃泌素作用时间的延长和剂量的增加,细胞中MMP-7的基因表达量也随之上调,进而推测胃泌素可利用该机制促进胃癌细胞转移[12]。
[1] Hotta K,Oyama T, Akamatsu T, et al. A comparison of outcomes of endoscopic submucosal dissection (ESD) for early gastric neoplasms between high-volume and low-volume centers: multi-center retrospective questionnaire study conducted by the Nagano ESD Study Group[J]. Intern Med, 2010, 49(4): 253- 259.
[2] 孙为豪,曹大中,俞 谦,等. 胃泌素对大鼠胃粘膜环氧合酶及生长因子表达的影响[J]. 中国病理生理杂志, 2005, 21(2): 271- 275.
[3] Iwasa K, Evers BM, Hellmich MR, et al. Regulation of growth of human gastric cancer by gastrin and glycine-extended progastrin[J]. Gastroenterology, 1997, 113(3): 782-790.
[4] Soh UJ, Dores MR, Chen B, et al. Signal transduction by protease-activated receptors[J]. Br J Pharmacol, 2010, 160(2): 191-203.
[5] 张淑杰,王瑞芬. 胃肠道类癌组织中胃泌素、生长抑素等表达与淋巴结转移相关性的研究[J]. 哈尔滨医科大学学报, 2007, 41(4): 356-358.
[6] Burkitt MD, Varro A, Pritchard DM. Importance of gastrin in the pathogenesis and treatment of gastric tumors[J]. World J Gastroenterol, 2009, 15(1): 1-16.
[7] Takaishi S, Tu S, Dubeykovskaya ZA, et al. Gastrin is an essential cofactor for helicobacter-associated gastric corpus carcinogenesis in C57BL/6 mice[J]. Am J Pathol,2009, 175(1): 365-375.
[8] 汪 苏,周建奖,单可人,等. 幽门螺杆菌毒素相关蛋白CagA上调胃泌素基因表达[J]. 中华微生物学和免疫学杂志, 2009, 29(11): 976-980.
[9] Zhou JJ, Xie Y, Zhao Y, et al. Human gastrin mRNA expression up-regulated byHelicobacterpyloriCagA through MEK/ERK and JAK2-signaling pathways in gastric cancer cells[J]. Gastric Cancer, 2011, 14(4): 322-331.
[10] 施小宇, 陶思丰, 陈 力,等. 小干扰RNA 抑制CD97 的表达及其对胃癌细胞迁移和侵袭能力的影响[J]. 中国病理生理杂志, 2011, 27(7): 1285-1289.
[11] Zheng H, Takahashi H, Murai Y, et al. Expressions of MMP- 2, MMP-9 and VEGF are closely linked to growth, invasion, metastasis and angiogenesis of gastric carcinoma[J]. Anticancer Res, 2006, 26(5A): 3579-3583.
[12] Mishra P, Senthivinayaqam S, Rangasamy V, et al. Mixed lineage kinase-3/JNK1 axis promotes migration of human gastric cancer cells following gastrin stimulation[J]. Mol Endocrinol, 2010, 24(3): 598- 607.
Gastrinpromotesthemigrationandinvasionofgastriccancercells
LIU Jun1, ZHOU Jian-jiang1, 2, ZHAO Yan1, XIE Yuan1
(1KeyLaboratoryofMolecularBiology,2ClinicalLaboratoryofAffiliatedHospital,GuiyangMedicalCollege,Guiyang550004,China.E-mail:jianjiangzhou@sina.cn)
AIM: To study the effects of gastrin on the migration and invasion of gastric cancer cellsinvitro.METHODSThe migration and invasion of gastric cancer AGS and SGC-7901 cells after treated with gastrin at concentrations of 10 nmol/L and 100 nmol/L were studied by wound-healing assay and Transwell migration and invasion assay. The cell proliferation was analyzed by MTT colorimetric method. The concentration of matrix metalloproteinase 2 (MMP- 2) in the culture medium was detected by ELISA. The AGS and SGC-7901 cells without treating with gastrin served as control cells.RESULTSCompared with the control cells, the migration and invasion of AGS cells and SGC-7901 cells were significantly increased after treated with gastrin at concentrations of 10 nmol/L and 100 nmol/L. In control, 10 nmol/L gastrin and 100 nmol/L gastrin groups, the mean numbers of the migrating cells were 56.0, 88.1 and 106.4/view in AGS cells and 52.8, 91.0 and 113.3/view in SGC-7901 cells, and the mean numbers of the invasive cells were 78.4, 118.7 and 141.6/view in AGS cells and 87.3, 124.6 and 147.4/view in SGC-7901 cells, respectively. The numbers of the migrating cells and invasive cells in 100 nmol/L gastrin group were higher than those in 10 nmol/L gastrin group. The cell proliferation rate and the concentration of MMP- 2 in the culture medium in gastrin treatment groups were higher than those in control group.CONCLUSIONGastrin promotes the migration and invasion of gastric cancer cells in a dose-dependent manner by increasing the MMP- 2 secretion, which may be the key mechanism in the proliferation, invasion and metastasis of the cancer cellsinvivo.
Gastrin; Stomach neoplasms; Matrix metalloproteinase 2
R363
A
10.3969/j.issn.1000- 4718.2013.04.027
1000- 4718(2013)04- 0730- 05
2012- 10- 27
2013- 03- 18
国家自然科学基金资助项目(No. 31060122);贵州省科技攻关计划基金资助项目(No. 黔科合SY字[2011]3067号);贵州省科学技术基金资助项目(No. 黔科合J字[2012]2039号)
△通讯作者 Tel: 0851- 6752814; E-mail: jianjiangzhou@sina.cn
