CD151对人脐带来源间充质干细胞生物学特性的影响*
2013-10-25罗伟峰韩之波杨舟鑫李丽娜及月茹王有为李扬秋韩忠朝
罗伟峰, 韩之波, 杨舟鑫, 李丽娜, 及月茹, 王有为, 李 萡, 李扬秋, 韩忠朝, △
(1暨南大学血液病研究所,广东 广州 510632; 2中国医学科学院血液学研究所泰达生命科学技术研究中心,天津 300457;3中国医学科学院北京协和医学院血液学研究所实验血液学国家重点实验室,天津 300020)
CD151对人脐带来源间充质干细胞生物学特性的影响*
罗伟峰1, 韩之波2,3, 杨舟鑫3, 李丽娜1, 及月茹3, 王有为3, 李 萡1, 李扬秋1, 韩忠朝1,2,3 △
(1暨南大学血液病研究所,广东 广州 510632;2中国医学科学院血液学研究所泰达生命科学技术研究中心,天津 300457;3中国医学科学院北京协和医学院血液学研究所实验血液学国家重点实验室,天津 300020)
目的探讨CD151对人脐带来源间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)生物学性状的影响。方法使用siRNA干扰hUC-MSCs 表面CD151,实验分为实验组(siRNA-CD151组)和对照组(siRNA-NC组);流式细胞术检测干扰72 h后hUC-MSCs CD151及其它细胞表型,von Kossa和油红O染色检测体外成骨、成脂诱导分化情况;流式细胞术分析细胞周期变化;real-time PCR检测hUC-MSCs CD151、肝细胞生长因子(hepatocyte growth factor,HGF)、转化生长因子β1(transforming growth factor β1,TGF-β1)、环氧合酶2(cyclooxygenase 2,COX-2)和吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)mRNA的表达量;ELISA检测hUC-MSCs HGF分泌量。结果(1) 流式细胞术检测发现干扰72 h hUC-MSCs实验组CD151(11.97±2.63vs95.66±1.56;P<0.01)和CD105(93.66±0.21vs83.37±0.71;P<0.05)较对照组显著降低;real-time PCR 检测hUC-MSCs CD151 mRNA变化和流式结果一致。(2)给予siRNA-CD151后能够减缓细胞周期进展,表现为细胞G1期增多,S期减少。(3)实验组hUC-MSCs HGF和TGF-β1表达量低于对照组(P<0.01),而COX-2表达量升高(P<0.05),IDO无明显改变;ELISA检测显示实验组hUC-MSCs HGF分泌量较对照组下降(P<0.01)。结论体外干扰CD151后hUC-MSCs 仍保持干细胞表型,体外成脂诱导分化能力无明显变化,但成骨诱导分化能力、增殖能力和相关免疫调节因子表达发生改变。
CD151; 间充质干细胞; RNA干扰; 免疫调节
与骨髓和脂肪相比,人脐带来源的间充质干细胞(human umbilical cord mesenchymal stem cells,hUC-MSCs)具有来源广泛、安全无风险和增殖能力强等特点[1],因此具有广泛的应用前景并逐渐成为细胞治疗的首选。MSCs具有多向分化能力,能在体外特定条件下分化成为脂肪细胞、骨细胞、软骨细胞等[2]。研究发现MSCs通过细胞间接触和分泌可溶性因子抑制CD4+T细胞和CD8+T细胞、B细胞和NK细胞的增殖发挥免疫调节特性[3]。本实验室前期发现在hUC-MSCs表面99%表达CD151,有实验发现在免疫调节中敲除CD151小鼠的T细胞对于有丝分裂刺激有更强的反应,表明CD151可能与T细胞活化和增殖有密切关系[4]。树突细胞敲除CD151也有更强刺激T细胞能力[5]。CD151为4跨膜蛋白超家族(transmembrane 4 superfamily,TM4SF)中的一员,首次于血小板内皮细胞四跨膜抗原中发现[6]。研究证实CD151与肿瘤细胞关系密切,细胞表达CD151意味着肿瘤转移风险更大,CD151通过与整合素α3β1、α6β1和α6β4作用,调控细胞生长、迁移、形态和增强黏附能力,CD151参与肿瘤细胞转移也与其促进肿瘤细胞迁移及运动有关[7]。但还没有报道hUC-MSCs和CD151有何联系。所以深入了解CD151与hUC-MSCs关系和作用显得尤为重要,本实验旨在通过下调hUC-MSCs表面CD151探讨CD151在hUC-MSCs中生物学特性变化,为进一步将hUC-MSCs用于免疫性疾病治疗提供相关理论基础和实验依据。
材 料 和 方 法
1主要试剂及仪器
DMEM/F12培养基(Thermo);RPMI-1640干粉培养基和胰酶(Gibco);胎牛血清(fetal bovine serum,FBS;HyClone);人淋巴细胞分离液(天津灏洋生物制品科技有限公司);LipofectamineTMRNAiMAX、CD151 StealthTMRNAi和Negative Control StealthTMRNAi(Invitrogen);Opti-MEM®I无血清培养基(Gibco);CD151-PE、CD34-FITC、CD45-FITC、CD73-PE、CD90-PE、CD105-PE、HLA-ABC-FITC和碘化丙啶(BD Biosciences);RNaseA(北京博大泰克公司);Total RNA Kit(Omega);M-MLV Kit(Invitrogen); Human HGF Instant ELISA(eBioscience);倒置相差显微镜 (Olympus);流式细胞仪(Becton Dickinson)。
2主要方法
2.1hUC-MSCs分离培养扩增和鉴定 脐带来源于产妇的捐献,均经本人及家属同意。母血检测乙型肝炎病毒(hepatitis B virus,HBV)、丙型肝炎病毒(hepatitis C virus,HCV)、人类免疫缺陷病毒(human immunodeficiency virus,HIV)、巨细胞病毒(cytomegalovirus,CMV)、梅毒等病原学均为阴性,实验过程符合医学伦理学标准。MSCs体外分离、培养、扩增及鉴定方法均和本实验室以前一致[8]。
2.2siRNA-CD151干扰hUC-MSCs 复苏第3代hUC-MSCs,72 h后观察待细胞融合度达90%左右时,胰酶消化细胞,细胞计数,取2×105cells,用含10%FBS的DMEM/F12培养基重悬,终体积为2 mL接种于6孔板中,置于37 ℃、5% CO2、饱和湿度的恒温箱中,培养4 h后弃去培养基再加入2 mL/well的Opti-MEM®I无血清培养基开始实验,实验分为2组:实验组(转染特异性siRNA-CD151序列)和对照组(转染阴性对照siRNA-NC序列)。siRNA购自Invitrogen,方法按照说明书提供的转染方法进行。
2.3流式细胞术检测干扰效率及各组MSCs免疫表型 分别收集各组细胞干扰72 h后上清备用,胰酶消化各组细胞用PBS洗3次后,标记抗CD151-PE、CD34-FITC、CD45-FITC、CD73-PE、CD90-PE、CD105-PE、HLA-ABC-FITC,以FITC-IgG和PE-IgG作为同型对照抗体,流式细胞仪检测。
2.4hUC-MSCs向成骨细胞、成脂细胞诱导分化 计数干扰后的hUC-MSCs,按2×104cells/well接种于6孔板,待细胞长至70%左右融合时更换成骨或成脂诱导培养基(成骨诱导培养基:IMBM培养基、10%FBS、100U青/链霉素、2 mmol/L左旋谷氨酰胺、0.1 μmol/L地塞米松、0.2 μmol/L 维生素C和10 μmol/L β-磷酸甘油;成脂诱导培养基:IMBM培养基、10%FBS、100U青/链霉素、2 mmol/L左旋谷氨酰胺、1 μmol/L地塞米松、0.5 μmol/L 3-异丁基-1甲基黄嘌呤、10 μmol/L胰岛素和100 μmol/L吲哚美辛),分对照组和实验组。在诱导培养21 d后,进行成脂油红O染色或成骨von Kossa染色,观察拍照。
2.5流式细胞术检测细胞周期 干扰72 h后胰酶消化细胞,1 000 r/min离心5 min,4 ℃预冷PBS洗1次,去PBS,1 mL 4 ℃预冷的PBS重悬细胞,固定于预冷的80%乙醇中,1 000 r/min 离心5 min,加RNaseA 至终浓度为50 mg/L,37 ℃孵育30 min,加碘化丙啶50 mg/L,4 ℃避光孵育30 min,流式细胞仪检测,评价细胞增殖速率。
2.6Real-time PCR检测CD151、肝细胞生长因子(hepatocyte growth factor,HGF)、转化生长因子 β1(transforming growth factor β1,TGF-β1)、环氧合酶(cyclooxygenase 2,COX-2和吲哚胺2,3-双加氧酶(indoleamine 2,3-dioxygenase,IDO)mRNA表达量 干扰72 h后hUC-MSCs用Omega试剂盒抽提细胞总RNA,并按照M-MLV的逆转录体系合成cDNA。实时定量PCR反应体系:2×SYBR Green PCR Master Mix 5 μL、上下游引物各0.25 μL、逆转录产物0.5 μL以及ddH2O 4 μL。使用Applied Biosystems 7300 Real-Time PCR System扩增仪进行 PCR扩增,反应条件为:94 ℃ 10 min,94 ℃ 15 s,60 ℃ 1 min,共 40个循环。以次黄嘌呤磷酸核糖转移酶(hypoxanthine phosphoribosyltransferase,HPRT)为内参照,分析目的基因的相对表达量。扩增产物的特异性通过绘制熔解曲线来进行验证,引物序列见表1。
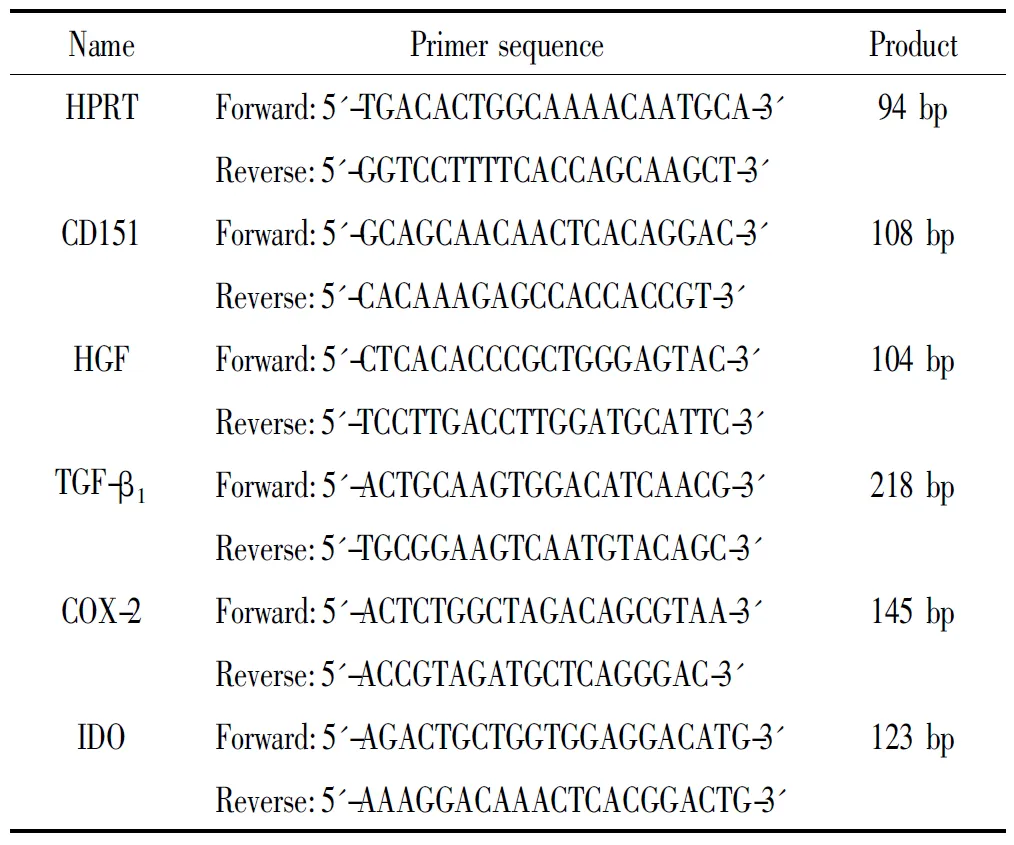
表1 引物序列
2.7ELISA测定HGF分泌量 收集干扰72 h后细胞上清,ELISA测其上清中细胞分泌HGF的量,按照eBioscience公司Human HGF Instant ELISA试剂盒推荐的方法测定。
3统计学处理
采用Graphpad Prism 5 Demo软件进行统计学分析,数据以均数±标准差(mean±SD)表示,样本之间的比较采用t检验,以P<0.05为差异有统计学意义。
结 果
1hUC-MSCs的形态与表型
细胞复苏24 h后倒置显微镜下观察,细胞呈梭形,贴壁生长;流式细胞术检测其表型,表达CD73、CD90、CD105、CD151术HLA-ABC,不表达CD14、CD19、CD34、CD45术HLA-DR。
2干扰效率检测及对hUC-MSCs相关表型的影响
细胞干扰72 h后流式细胞术检测结果显示,与对照组相比,实验组细胞CD151表达明显下降(P<0.01),见图1。Real-time PCR检测实验组CD151表达,与对照组相比明显下降(P<0.05),见图2。CD105表达下降(P<0.05),而其它相关表型未有明显改变,见表2。这说明用siRNA干扰成功,不改变干细胞表型。

Figure 1. Expression of CD151 on hUC-MSCs with siRNA-CD151 or negative control after 72 h assayed by flow cytometry.
图1流式细胞术检测干扰效率结果
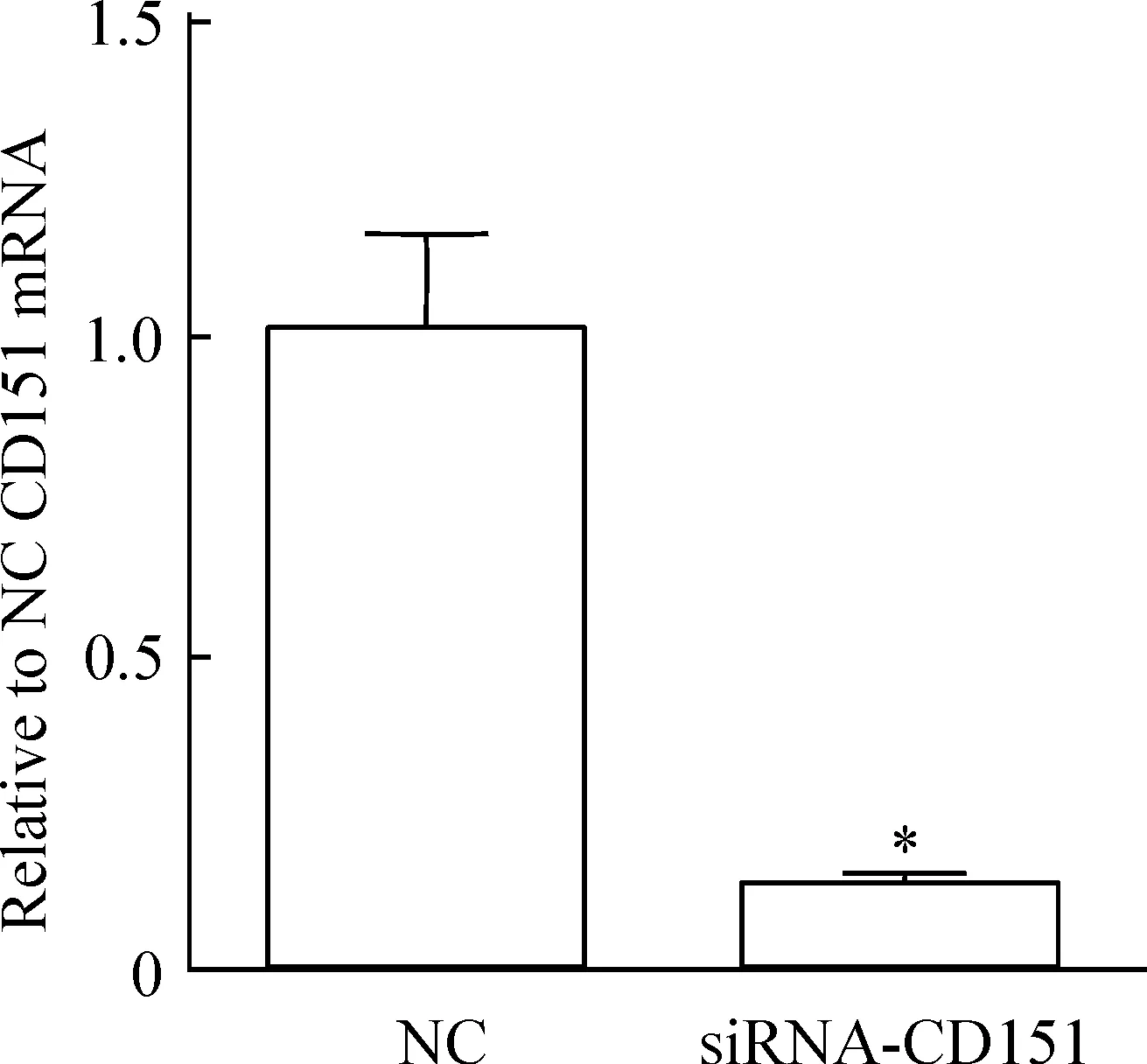
Figure 2. Quantitative analysis of CD151 mRNA expression in hUC-MSCs with siRNA-CD151 or negative control after 72 h. Mean±SD.n=3.*P<0.05vsnegative control (NC).
图2Real-timePCR检测2组细胞CD151mRNA表达量

表2 2组细胞干细胞表型结果
*P<0.05,**P<0.01vsnegative control.
3干扰后对hUC-MSCs分化潜能的影响
干扰后,hUC-MSCs向脂肪细胞分化过程中,油红O染色,细胞内红色脂滴形成无明显改变;向成骨细胞分化过程中,von Kossa染色后镜下发现2组细胞钙沉积有差异,实验组hUC-MSCs钙沉积体积减小,数量增加,说明实验组hUC-MSCs诱导成骨潜能可能降低,见图3。

Figure 3. Adipogenic (A, B; oil red O staining, ×100) and osteogenic (C, D; von Kossa staining, ×40) differentiation of hUC-MSCs in siRNA-CD151 (A, C) and negative control (B, D) groups after induction for 21 d.
图32组细胞成脂、成骨诱导分化结果
4流式细胞术检测细胞周期
对照组hUC-MSCs G1期比例82.13%,S期比例15.47%,见图4A。而实验组hUC-MSCs与对照组相比,G1期比例增高为88.24%,S期比例降低为10.31%,见图4B。干扰CD151后细胞增殖速率降低,周期延迟。
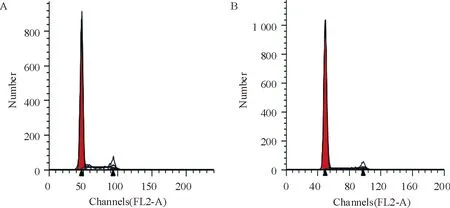
Figure 4. Cell cycle detected by flow cytometry. A: negative control group (G1: 82.13%, G2: 2.40%, S: 15.47%); B: siRNA-CD151 group (G1: 88.24%,G2: 1.45%, S: 10.31%).
图42组细胞周期结果
5Real-timePCR结果
实验组CD151、HGF和TGF-β1相对表达量与对照组相比明显下降(P<0.05或P<0.01),而COX-2的相对表达量则相反,表达增高(P<0.05),见图5A。干扰素 γ(interferon γ,IFN-γ)刺激24 h后,2组IDO表达无明显差异,见图5B。
6ELISA检测HGF结果
siRNA干扰CD151后,hUC-MSCs分泌HGF较对照组明显降低(P<0.01),见图6。

Figure 5. Quantitative analysis of HGF,TGF-β1,COX-2 (A) and IDO (B) mRNA expression in hUC-MSCs.Mean±SD.n=3.*P<0.05,**P<0.01vsnegative control (NC).
图52组细胞HGF、TGF-β1、COX-2和IDOmRNA的表达量
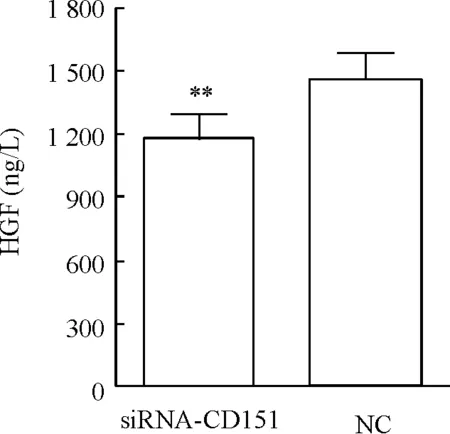
Figure 6. Determination of HGF concentration in cell culture supernatants by ELISA.Mean±SD.n=6.**P<0.01vsnegative control (NC).
图62组细胞上清HGF分泌量
讨 论
CD151第1次在血小板表面发现,是一个穿越细胞膜的蛋白,属于4跨膜蛋白家族的一员,在多种细胞表面表达,在本实验室前期研究中发现脐带来源的MSCs表面高表达CD151的基础上,本研究中,我们重点检测了下调MSCs表面CD151表达对hUC-MSCs的表型、分化、细胞周期等基本生物学特性,探究了干扰后MSCs分泌可溶性免疫调节因子的变化情况。
通过利用siRNA干扰hUC-MSCs表面的CD151 72 h后,流式细胞术检测干扰效率,CD151表达量从95.55%下降至14.03%(图1),且mRNA水平得出一致结果(图2),说明此方法能如预期成功下调CD151表达。观察形态,发现干扰后hUC-MSCs形态无改变,呈梭形贴壁生长,流式细胞仪检测干扰后发现除CD105表达下降外hUC-MSCs表面其它标志无明显变化(表2),表明干扰CD151后不改变hUC-MSCs表型。hUC-MSCs具有多向分化潜能,能在特定条件下分化成为多种细胞,我们比较了干扰后hUC-MSCs成脂、成骨情况,发现与对照组相比干扰CD151后其脂滴形成能力未降低,镜下观察钙沉积体积减小,数量增加(图3),但有文献指出,在成软骨分化过程中,TGF-β3存在时,其MSCs表面CD151会下降,CD151可能是MSCs成软骨分化过程中的阴性表面标记[9]。雷奈酸锶可通过上调TGF-β1表达促进大鼠骨髓间充质干细胞向成骨细胞分化[10]。关于干扰CD151对hUC-MSCs的干细胞特性及分化潜能的确切影响,需进一步检测hUC-MSCs的相关基因。文献报道指出转染CD151质粒的HeLa细胞,其增殖能力增加,细胞周期改变表现为S+G2/M的细胞比例增高,表明CD151参与肿瘤细胞增殖。我们干扰hUC-MSCs表面CD151后得出同样结论,细胞周期改变表现为G1期比例增多,而S期比例减少(图4),提示CD151与细胞增殖密切相关。
文献指出hUC-MSCs可通过分泌可溶性细胞因子对T淋巴细胞抑制作用是MSCs发挥免疫调节作用机制之一,MSCs通过分泌HGF、TGF-β1、PGE2、IDO参与免疫调节,而COX-2是PGE2合成的关键酶,COX-2升高可以使PGE2升高[11]。Wright等[4]发现CD151-null的小鼠T淋巴细胞对于有丝分裂原刺激有更强的反应,表现为CD4+T淋巴细胞和CD8+T淋巴细胞与对照组相比增殖能力明显增强,但是免疫球蛋白G1的分泌量没有明显差别。MSCs促进Th1型T细胞向Th2型T细胞转化,实验证实炎症因子IFN-γ分泌下降[2],表明CD151可能参与T细胞免疫调节功能,我们对于hUC-MSCs可溶性的免疫调节因子进行研究发现干扰CD151后HGF和TGF-β1表达明显下降,COX-2表达量增高(图5A),认为HGF和TGF-β1这2种细胞因子表达量降低使得干扰CD151后MSCs免疫调节能力下降,PCR检测COX-2是一种瞬时过程,需进一步检测上清中分泌PGE2含量。而IDO表达量没有明显变化(图5B),可能不参与此免疫调节过程。进一步用ELISA检测HGF含量也得到一致结果(图6)。HGF与其受体c-Met结合发挥生物学效应,通过阻断调控NF-κB表达蛋白来干扰NK-κB信号通路实现抗炎作用,文献报道CD151与c-Met和整合素α3/α6形成一个功能性的复合物,通过过度活化HGF/c-Met信号通路发挥促肿瘤迁移作用[12],我们推测干扰CD151后其HGF分泌下降且破坏了功能性复合物,从而影响HGF/c-met信号通路参与hUC-MSCs免疫调节作用。关于干扰CD151后MSCs其免疫调节功能的变化我们还需要进一步检测相关炎症因子,如IFN-γ、肿瘤坏死因子 α(tumor necrosis factor α,TNF-α)等。Sheng等[5]研究发现缺乏CD151的树突状细胞不影响其发育和成熟的能力,但对T细胞有更强刺激作用,CD151通过共刺激调控作用介导树突状细胞促进T细胞活化。
综上所述,利用siRNA干扰CD151后MSCs形态、细胞表型及成脂诱导分化能力不变,但钙沉积体积减小,数量增加说明成骨诱导能力可能下降。细胞周期G1期比例增加,S期比例减少。免疫调节因子表达改变,HGF和TGF-β1表达下调,COX-2表达上调。还需进一步检测相关炎症因子确定干扰CD151后MSCs活化T细胞的能力,且免疫调节详细作用机制还需进一步深入研究。
[1] Kern S, Eichler H, Stoeve J, et al. Comparative analysis of mesenchymal stem cells from bone marrow, umbilical cord blood, or adipose tissue[J]. Stem Cells, 2006, 24(5): 1294-1301.
[2] Aggarwal S, Pittenger MF. Human mesenchymal stem cells modulate allogeneic immune cell responses[J]. Blood, 2005, 105(4): 1815-1822.
[3] Luz-Crawford P, Noel D, Fernandez X, et al. Mesenchymal stem cells repress Th17 molecular program through the PD-1 pathway[J]. PLoS One, 2012, 7(9): e45272.
[4] Wright MD, Geary SM, Fitter S, et al. Characterization of mice lacking the tetraspanin superfamily member CD151[J]. Mol Cell Biol, 2004, 24(13): 5978-5988.
[5] Sheng KC, van Spriel AB, Gartlan KH, et al. Tetraspanins CD37 and CD151 differentially regulate Ag presentation and T-cell co-stimulation by DC[J]. Eur J Immunol, 2009, 39(1): 50-55.
[6] Fitter S, Tetaz TJ, Berndt MC, et al. Molecular cloning of cDNA encoding a novel platelet-endothelial cell tetra-span antigen, PETA-3[J]. Blood, 1995, 86(4): 1348-1355.
[7] Takeda Y, Li Q, Kazarov AR, et al. Diminished metastasis in tetraspanin CD151-knockout mice[J]. Blood, 2011, 118(2): 464-472.
[8] Lu LL, Liu YJ, Yang SG, et al. Isolation and characterization of human umbilical cord mesenchymal stem cells with hematopoiesis-supportive function and other potentials[J]. Haematologica, 2006, 91(8): 1017-1026.
[9] Lee HJ, Choi BH, Min BH, et al. Changes in surface markers of human mesenchymal stem cells during the chondrogenic differentiation and dedifferentiation processesinvitro[J]. Arthritis Rheum, 2009, 60(8): 2325-2332.
[10] 王小娜, 李 正, 吴 文, 等. TGF-β1在雷奈酸锶促进大鼠骨髓间充质干细胞向成骨细胞分化中的作用[J]. 中国病理生理杂志, 2011, 27(12):2357-2361.
[11] Di Nicola M, Carlo-Stella C, Magni M, et al. Human bone marrow stromal cells suppress T-lymphocyte proliferation induced by cellular or nonspecific mitogenic stimuli[J]. Blood, 2002, 99(10): 3838-3843.
[12] Klosek SK, Nakashiro K, Hara S, et al. CD151 regulates HGF-stimulated morphogenesis of human breast cancer cells[J].Biochem Biophys Res Commun, 2009, 379(4): 1097-1100.
EffectofCD151onbiologicalcharacteristicsofhumanumbilicalcordmesenchymalstemcells
LUO Wei-feng1, HAN Zhi-bo2,3, YANG Zhou-xin3, LI Li-na1, JI Yue-ru3, WANG You-wei3, LI Bo1, LI Yang-qiu1, HAN Zhong-chao1,2,3
(1InstituteofHematology,JinanUniversity,Guangzhou510632,China;2TEDALifeScienceandTechnologyResearchCenter,InstituteofHematology,ChineseAcademyofMedicalSciences,Tianjin300457,China;3StateKeyLaboratoryofExpe-rimentalHematology,InstituteofHematology,ChineseAcademyofMedicalSciencesandPekingUnionMedicalCollege,Tianjin300020,China.E-mail:hanzhongchao@hotmail.com)
AIM: To study the effect of CD151 on the biological characteristics of human umbilical cord mesenchymal stem cells (hUC-MSCs).METHODSCD151 expression on hUC-MSCs was interfered by siRNA. The cells were divided into siRNA-CD151 group and negative control group (treated with siRNA-NC). The efficiency of interference after 72 h and the changes of other surface markers were detected by flow cytometry. The ability of differentiation was assessed by oil red O and von Kossa staining. The cell cycle was analyzed by flow cytometry. The mRNA expression of CD151, hepatocyte growth factor (HGF), transforming growth factor β1(TGF-β1), cyclooxygenase 2 (COX-2) and indoleamine 2, 3-dioxygenase (IDO) in hUC-MSCs was detected by real-time PCR. The secretion of HGF by hUC-MSCs was measured by ELISA.RESULTSThe results of flow cytometry showed that the expression of CD151 (11.97±2.63vs95.66±1.56,P<0.01) and CD105 (93.66±0.21vs83.37±0.71,P<0.05) on hUC-MSCs in siRNA-CD151 group was lower than that in negative control group. The consistent results were also achieved by using the method of real-time PCR. Treatment with siRNA-CD151 down-regulated the progress of the cell cycle as the G1phase increased and the S phase decreased. The mRNA expression levels of HGF and TGF-β1in hUC-MSCs in siRNA-CD151 group were lower than those in negative control group, and opposite result of COX-2 mRNA expression was observed. The IDO mRNA in hUC-MSCs was unchanged with IFN-γ stimulation for 24 h. HGF concentration in siRNA-CD151 group was decreased as compared with negative control group.CONCLUSIONInterfering CD151 expression on hUC-MSCs doesn’t change other surface markers except CD105, and maintains the capacity of adipogenic differentiation. However, it changes the osteogenic differentiation, proliferation and the expression of immunomodulatory cytokines.
CD151; Mesenchymal stem cells; RNA interference; Immunomodulation
R363
A
10.3969/j.issn.1000- 4718.2013.04.022
1000- 4718(2013)04- 0701- 06
2012- 12- 13
2013- 03- 05
国家重大科学计划“973计划”(No. 2011CB964800)
△通讯作者 Tel: 022-23909172; E-mail: hanzhongchao@hotmail.com
