西洋参茎叶总皂苷通过抑制内质网应激相关细胞凋亡减轻大鼠急性心肌梗死后心室重构*
2013-10-24王晓礽宋丹丹刘秀华史大卓
刘 蜜, 王 琛, 王晓礽, 宋丹丹, 刘秀华△, 史大卓△
(1中国中医科学院西苑医院,北京 100091; 2解放军总医院病理生理研究室,北京 100853)
西洋参茎叶总皂苷通过抑制内质网应激相关细胞凋亡减轻大鼠急性心肌梗死后心室重构*
刘 蜜1, 王 琛1, 王晓礽2, 宋丹丹2, 刘秀华2△, 史大卓1△
(1中国中医科学院西苑医院,北京 100091;2解放军总医院病理生理研究室,北京 100853)
目的研究西洋参茎叶总皂苷 (Panaxquinquefoliumsaponin, PQS)对大鼠急性心肌梗死(AMI)后心室重构的作用及其机制。方法健康雄性SD大鼠90只,随机分为假手术 (sham) 组、AMI组、牛磺酸 (300 mg·kg-1·d-1) 组及PQS (50、100和200 mg·kg-1·d-1) 组 (n=15)。结扎大鼠左冠状动脉前降支复制AMI模型。术后第2天开始,各用药组用饮用水10 mL·kg-1·d-1溶解药物灌胃,sham组及AMI组予等量饮用水灌胃。术后4周,超声心动图检测左室结构及功能变化;TTC染色法测定心肌梗死范围;比色法测定非梗死区心肌组织羟脯氨酸含量;TUNEL法检测非梗死区心肌细胞凋亡率,Western blotting检测内质网应激分子葡萄糖调节蛋白78 (GRP78)、钙网蛋白 (CRT)、C/EBP同源蛋白 (CHOP) 及凋亡相关蛋白Bcl-2、Bax的表达。结果与AMI组比较,PQS低、中、高剂量组左室收缩末期内径分别降低17.2%、20.3%和38.8%,左室舒张末期内径分别降低8.9%、9.0%和17.2%,左室收缩末期容积分别降低31.4%、38.5%和66.9%左室舒张末期容积分别降低18.2%、18.8%和34.2%,射血分数分别升高44.9%、60.1%和118.0%,左室短轴缩短率分别升高55.4%、71.0%和148.0%,梗死范围分别降低4.6%、39.5%和55.8% (均P<0.05);非梗死区心肌组织羟脯氨酸含量分别降低34.5%、35.9%和48.7% (P<0.01)。与AMI组比较,PQS 200 mg·kg-1·d-1组心肌细胞凋亡率降低27.3% (P<0.05),GRP78和CRT蛋白表达分别降低79.9%和80.8% (P<0.01),CHOP和Bax分别降低42.5%和53.1% (P<0.01),Bcl-2表达升高1.1倍 (P<0.01);上述保护作用的程度与内质网应激抑制剂牛磺酸相近 (P>0.05)。Spearman相关分析发现CHOP蛋白表达与心肌细胞凋亡率显著正相关 (r=0.797,P<0.01)。结论PQS剂量依赖性减轻大鼠心肌梗死后心室重构,其机制与抑制CHOP介导的内质网应激凋亡通路有关。
西洋参茎叶总皂苷; 心肌梗死; 心室重构; 内质网应激; 细胞凋亡
如何改善急性心肌梗死 (acute myocardial infarction, AMI) 后心室重构、预防心力衰竭发生,是心肌梗死二级预防面临的重大问题。心肌梗死后心室重构包括梗死区扩展、心室扩张和非梗死区代偿性肥厚[1-3],其机制涉及心肌细胞凋亡、肥大、延长、侧向滑移及心肌间质纤维化等[2,4]。非梗死区心肌细胞凋亡在急性心肌梗死后心室重构病理过程中具有十分重要的作用[5-8]。 心肌缺血可触发内质网应激 (endoplasmic reticulum stress, ERS)[9]。持续而严重的ERS可通过钙超载、影响线粒体功能等诱发细胞凋亡[10-11],表现为 ERS标志分子葡萄糖调节蛋白78 (glucose-regulated protein 78, GRP78)、钙网蛋白 (calreticulin, CRT)的过表达及ERS相关细胞凋亡途径C/EBP同源蛋白 (C/EBP homologous protein, CHOP)等的激活。我们前期研究证实,CHOP介导的ERS相关凋亡途径参与了腹主动脉狭窄所致的心肌肥厚过程[12]。
西洋参茎叶总皂苷 (Panaxquinquefoliumsaponin,PQS) 具有抗心肌缺血及心肌缺血再灌注后损伤的作用[13-14],但PQS对心肌梗死后心室重构是否有治疗作用的报道较少。我们前期研究发现,PQS可通过抑制过度ERS,减轻离体大鼠心肌细胞缺氧/复氧损伤[15]。CHOP介导的ERS相关凋亡是否参与了AMI后心室重构的病理过程?PQS改善心肌梗死后心室重构是否与抑制CHOP介导的ERS相关凋亡有关?目前尚缺少研究。 因此,本研究采用结扎大鼠左冠状动脉前降支建立心肌梗死模型,观察PQS改善AMI后心室重构的作用;利用ERS抑制剂牛磺酸(taurine,Tau)作为阳性对照药物,从CHOP介导的ERS相关凋亡方面探讨PQS改善心肌梗死后心室重构的分子机制。
材 料 和 方 法
1动物、试剂和仪器
清洁级8周龄健康雄性SD大鼠,体质量(250±20) g,购自军事医学科学院实验动物中心。PQS粉 (纯度为99.0%)由吉林省集安益盛药业股份有限公司提供;牛磺酸购自Sigma;羟脯氨酸测试盒购自南京建成生物工程研究所;丙烯酰胺 (acrylamide) 和末端脱氧核苷酸转移酶介导的dUTP缺口末端标记 (TdT-mediated dUTP nick end labeling, TUNEL) 试剂盒购自Promega;兔抗人CRT和GRP78多克隆抗体购自Stressgen;兔抗人GAPDH单克隆抗体、小鼠抗人CHOP单克隆抗体和兔抗人Bax、Bcl-2多克隆抗体购自Cell Signal;增强化学发光 (enhanced chemiluminescence, ECL) 试剂盒购自Millipore;辣根过氧化酶标记山羊抗兔和山羊抗小鼠IgG购自Santa Cruz;其余化学试剂,均购自北京化工厂;小动物呼吸机 (DW-2000型) (上海嘉鹏科技有限公司生产);RM6240 BD多道生理信号采集处理系统 (成都仪器厂生产);Vevo-770 小动物超声仪 (Visual Sonics生产)。
2实验分组与急性心肌梗死模型复制
SD大鼠90只,适应性饲养1周后,随机分为假手术 (sham)组、AMI组、Tau (300 mg·kg-1·d-1) 组及PQS (50、100和200 mg·kg-1·d-1) 组 (n= 15)。参考文献[5]方法,结扎左冠状动脉前降支复制心肌梗死模型。以2%戊巴比妥钠溶液腹腔注射麻醉大鼠 (按100 g体质量0.23 mL) 后,仰卧位固定大鼠,呼吸机辅助呼吸。左胸部纵切口,逐层分离,沿第4肋间开胸,分离心包,暴露心脏,于左心耳下缘1 mm处以7-0线结扎左冠状动脉。根据肢体导联心电图出现J点抬高 (≥ 0.2 mV),判断心肌梗死模型成功;sham组仅在相应部位穿线,不结扎冠状动脉。排除胸腔内气体,逐层关胸。自主呼吸恢复后拔除气管插管,缝合颈部皮肤。术后24 h,各用药组用饮用水10 mL·kg-1·d-1溶解药物灌胃4周,sham组及AMI组予等量饮用水灌胃4周。
3心脏超声心动图检测
术后4 周时,将大鼠用 2% 异氟烷吸入麻醉后仰卧固定,通过 Vevo-770 小动物超声仪获取乳头肌水平短轴切面,探头频率为17.5 MHz,每一数据均测量3次取均值。参考文献[16]方法,检测左室舒张末期内径 (left ventricular end-diastolic dimension, LVEDD)、左室收缩末期内径 (left ventricular end-systolic dimension, LVESD)、左室前壁舒张末期厚度 (left ventricular end-diastolic anterior wall, LVDAW)、左室前壁收缩末期厚度 (left ventricular end-systolic anterior wall, LVSAW)、左室后壁舒张末期厚度 (left ventricular end-diastolic posterior wall, LVDPW)、左室后壁收缩末期厚度 (left ventricular end-systolic posterior wall, LVSPW)、射血分数 (ejection factor, EF)和短轴缩短率 (fractional shortening, FS)。
4心肌梗死面积
以2%戊巴比妥钠溶液腹腔注射麻醉大鼠后,仰卧位固定大鼠,开胸取出心脏,冰生理盐水冲净血液后将心脏垂直长轴横切为厚度均匀的5片,用丝线按顺序将心脏切片串起置于37 ℃、2% 2,3,5-氯化三苯基四氮唑(2,3,5-triphenyltetrazolium chloride,TTC)中孵育30 min。然后置于10%甲醛中过夜,封片。Image-Pro Plus 软件测量面积。按照文献[17]方法计算梗死面积,用梗死区面积 / (左室总表面积-左室腔面积) × 100%表示梗死范围。
5心肌羟脯氨酸含量
取非梗死区心肌组织 (本研究中为左室后壁心肌组织),严格按照试剂盒说明操作,用比色法检测心肌组织中羟脯氨酸的含量。
6心肌细胞凋亡
左心室结扎线以下垂直于心脏长轴横切厚约1 cm的心肌组织,置于10%甲醛溶液中固定, 经石蜡包埋、切片 (2 μm),HE染色和TUNEL法进行心肌细胞凋亡的原位检测[18]。荧光显微镜下正常心肌细胞核呈蓝色,凋亡细胞核呈绿色。每张切片于非梗死区随机取10个高倍视野 (× 40),计数每个视野中每100个心肌细胞中阳性细胞数的比例,以百分数 (%) 表示凋亡指数 (apoptotic index, AI)。
7Westernblotting分析
取左室后壁心肌组织,按Liu等[19]介绍方法提取心肌细胞总蛋白,Bradford法蛋白定量后分装,-80 ℃保存。取细胞蛋白提取液上清 (含蛋白100 μg) 进行聚丙烯酰胺凝胶电泳 (SDS-PAGE, 10%分离胶)。电泳分离后的蛋白质电转移至硝酸纤维素膜上,5% BSA封闭40 min后,分别加入CRT、GRP78、Bcl-2、Bax多克隆抗体和CHOP、GAPDH单克隆抗体 (均为1∶500)。4 ℃过夜孵育,用1×TBS-T洗膜后,相应Ⅱ抗孵育1.5 h。化学发光ECL显示,采用Image-Pro Plus 4.1软件分析蛋白条带的吸光度[integrated absorbance,IA=平均吸光度(A)× 面积],以靶蛋白IA与GAPDHIA的比值反映靶蛋白水平。
8统计学处理
数据用均数±标准差 (mean±SD) 表示,采用 SPSS 17.0 统计软件进行分析。单因素方差分析 (One-way ANOVA) 进行多组间比较,S-N-K法进行多组间两两比较;CHOP蛋白表达与细胞凋亡率的相关性采用 Spearman 相关分析。以P<0.05为差异有统计学意义。
结 果
1一般情况
造模过程中由于麻醉意外、气胸及术后24 h内急性心力衰竭等原因死亡30只,术后24 h存活率为62.5%。Sham组大鼠,术后无感染和死亡。AMI组于术后第11天死亡1只,PQS低剂量组于第15天时死亡1只,死亡原因均为心衰 (解剖示心室腔扩大、梗死区心室壁变薄、肺组织充血)。术后4周,sham组大鼠15只,PQS高、中剂量组及牛磺酸组大鼠各10只,AMI组和PQS低剂量组大鼠各9只。
2西洋参茎叶总皂苷对心肌梗死大鼠心脏结构和功能的影响
2.1梗死范围 TTC染色后存活心肌为红色,梗死面积为白色。AMI组梗死范围为 (32.0±5.9)%。与AMI组比较,PQS低、中、高剂量组梗死范围分别降低4.6%、39.5%和55.8% (P<0.05)。PQS高剂量组与牛磺酸组比较无显著差异 (P>0.05),见图1。

Figure 1. The effect of PQS on infarction size in transverse LV sections examined with TTC staining. Mean±SD.n= 3.#P<0.05vsAMI group;*P<0.05vsPQS 200 group.
图1PQS对心肌梗死面积的影响
2.2超声心动图 术后4周,各组间左室后壁厚度及左室质量无显著差异 (P>0.05)。与sham组比较,AMI组及PQS低、中、高剂量治疗组均有左室内径及容积增加,左室前壁明显变薄 (P<0.05);与AMI组比较,PQS低、中、高剂量治疗组左室前壁厚度无明显差异 (P>0.05),LVESD分别降低38.8%、20.3%和17.20% (P<0.05),LVEDD分别降低17.2%、8.95%和8.91% (P<0.05), EF分别升高1.2倍、60.1%和44.9% (P<0.05),FS分别升高1.5倍、71.0%和55.4% (P<0.05);PQS高剂量组与牛磺酸组比较,各项指标无显著差异 (P>0.05),见图2、表1。
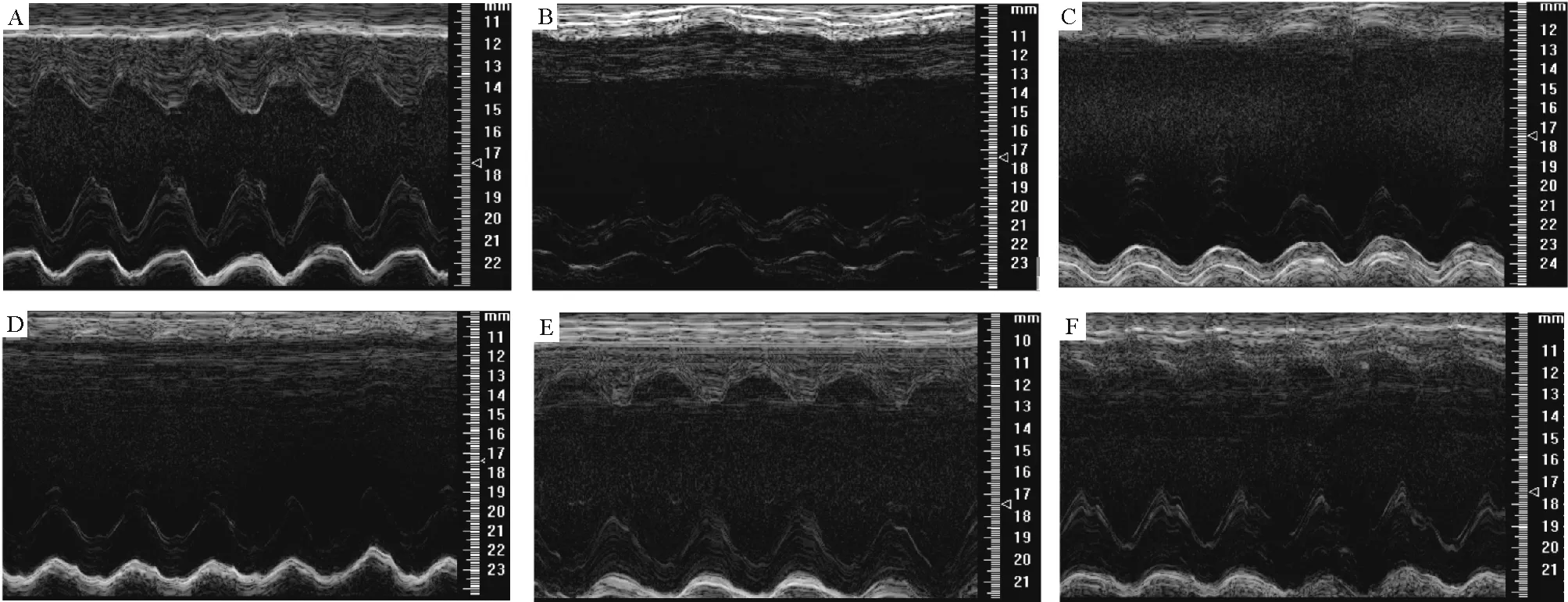
Figure 2. Examples of M-mode echocardiograms obtained with two-dimensional guidance from a short-axis midventricular view from the sham-operated rat and the rats with 4-week-old anterior infarction. A: sham group; B: AMI group; C: PQS 50 mg·kg-1·d-1group; D: PQS 100 mg·kg-1·d-1group; E:PQS 200 mg·kg-1·d-1; F: the taurine group.
图2各组大鼠M型超声图
表1PQS对心肌梗死后大鼠心脏结构及功能的影响
Table 1. Effects of PQS on the cardiac structure and functions of the rats after acute myocardial infarction (mean ±SD.n=4)

GroupLVDAW(mm)LVSAW(mm)LVESD(mm)LVEDD(mm)LVDPW(mm)LVSPW(mm)EF(%)FS(%)Sham1.6±0.12.5±0.33.5±0.37.5±0.41.7±0.23.0±0.483.3±1.353.9±1.4AMI0.2±0.1#0.2±0.1#9.1±0.6#10.7±0.8#1.7±0.22.4±0.329.9±6.7#15.0±3.7#Tau1.0±0.21.7±0.45.7±0.8#∗9.0±0.5#∗1.6±0.22.4±0.564.6±8.5#∗37.3±6.4#∗PQS500.6±0.40.8±0.67.5±1.7#∗△9.7±0.9#∗1.7±0.32.4±0.643.3±15.4#△23.3±10.2#PQS1000.6±0.50.9±0.77.2±1.1#∗△9.7±0.5#∗1.6±0.22.2±0.547.9±12.3#∗△25.8±8.3#∗PQS2000.9±0.31.5±0.55.5±0.3#∗8.8±0.3#∗1.7±0.22.7±0.365.1±2.7#∗37.3±2.0#∗
LVDAW: LV end-diastolic anterior wall; LVSAW: LV end-systolic anterior wall; LVEDD: LV end-diastolic diameter; LVESD: LV end-systolic diameter; LVDPW: LV end-diastolic posterior wall; LVSPW: LV end-systolic posterior wall; EF: ejection fraction; FS: fractional shortening.#P<0.05vssham group;*P<0.05vsAMI group;△P<0.05vsPQS 200 group.
2.3心肌组织羟脯氨酸含量 用比色法检测各组大鼠非梗死区心肌组织中羟脯氨酸的含量。与sham组比较,AMI组羟脯氨酸含量升高2.0倍 (P<0.01);与AMI组比较,PQS低、中、高剂量组分别降低34.5%、35.9%和48.7% (P<0.01)。PQS组与牛磺酸组比较,心肌组织羟脯氨酸含量无显著差异 (P>0.05),见图3。
3西洋参茎叶总皂苷(200mg·kg-1·d-1)减轻心肌梗死后心室重构作用机制的研究
3.1心肌组织细胞凋亡 与sham组比较,AMI组非梗死区心肌TUNEL阳性率升高13.9倍 (P<0.01)。与AMI组比较,PQS组TUNEL阳性率降低27.3% (P<0.01),牛磺酸组降低27.9% (P<0.01)。PQS组与牛磺酸组之间无显著差异 (P>0.05),见图4。
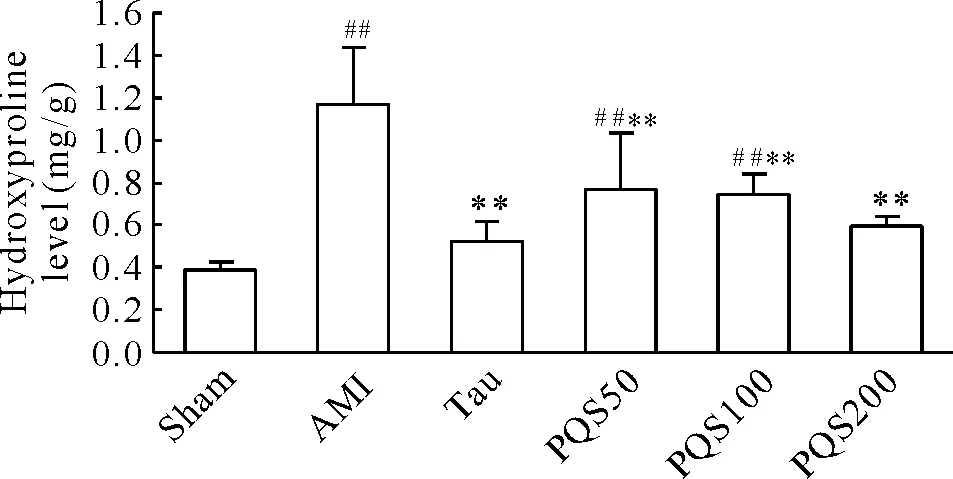
Figure 3. The effect of PQS (200 mg·kg-1·d-1) on hydroxyproline level of noninfarcted myocardium in SD rats.Mean±SD.n=4.##P<0.01vssham group;**P<0.01vsAMI group.
图3PQS对心肌梗死后大鼠心肌羟脯氨酸含量影响
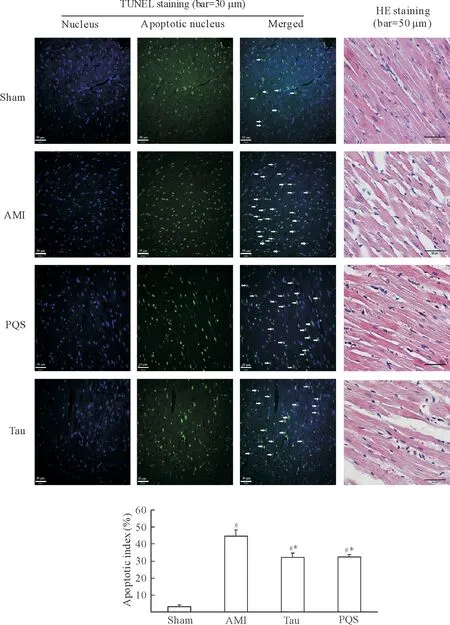
Figure 4. The effect of PQS (200 mg·kg-1·d-1) on the myocardial tissue morphology (HE staining) and the apoptosis of noninfarcted myocardium (TUNEL staining) after myocardial infarction of SD rats.Mean±SD.n=4.#P<0.05vssham group;*P<0.05vsAMI group.
图4PQS对心肌梗死后大鼠非梗死区心肌细胞凋亡率及心肌组织形态的影响
3.2内质网应激分子GRP78和CRT蛋白表达 与sham组比较,AMI组GRP78和CRT蛋白表达分别升高10.56倍和5.57倍 (P<0.01)。与AMI组比较,PQS组GRP78和CRT蛋白表达分别降低79.9%和80.8% (P<0.01),Tau组GRP78和CRT蛋白表达分别降低81.0%和83.0% (P<0.01)。GRP78及CRT蛋白表达在PQS组和Tau组之间均无显著差异 (P>0.05),见图5。
3.3CHOP蛋白表达 与sham组比较,AMI组CHOP蛋白表达升高2.5倍 (P<0.01)。与AMI组比较,PQS组及Tau组CHOP蛋白表达分别降低42.5%和55.5% (P<0.01)。PQS组和Tau组的CHOP蛋白表达无显著差异 (P>0.05),见图6。
3.4Bax和Bcl-2表达 与sham组比较,AMI组非梗死区心肌中促凋亡蛋白Bax表达升高6.2倍,抗凋亡蛋白Bcl-2表达降低75.5% (P<0.01)。与AMI组比较,PQS组促凋亡蛋白Bax表达降低53.1% (P<0.01),抗凋亡蛋白Bcl-2表达升高1.1倍 (P<0.01)。与AMI组比较,Tau组促凋亡蛋白Bax表达降低67.4%,抗凋亡蛋白Bcl-2表达升高1.6倍 (P<0.01)。Bax及Bcl-2蛋白表达在PQS组和Tau组之间均无显著差异 (P>0.05),见图7。

Figure 5. The effects of PQS (200 mg·kg-1·d-1) on the protein expression of CRT and GRP78 of the noninfarcted myocardium in SD rats. Mean±SD.n= 4.##P<0.01vssham group;**P<0.01vsAMI group.
图5PQS对心肌梗死后大鼠非梗死区心肌GRP78和CRT蛋白表达水平的影响

Figure 6. The effect of PQS (200 mg·kg-1·d-1) on the protein expression of CHOP of the noninfarcted myocardium in SD rats. Mean±SD.n= 4.##P<0.01vssham group;**P<0.01vsAMI Fgroup.
图6PQS对心肌梗死后大鼠非梗死区心肌CHOP表达的影响

Figure 7. The effects of PQS (200 mg·kg-1·d-1) on the protein expression of Bcl-2 and Bax of the noninfarcted myocardium in SD rats.Mean±SD.n=4.##P<0.01vssham group;**P<0.01vsAMI group.
图7PQS对心肌梗死后大鼠非梗死区心肌Bcl-2和Bax蛋白表达水平的影响
4CHOP蛋白表达与非梗死区心肌细胞凋亡率的相关性
对心肌组织CHOP蛋白表达与心肌细胞凋亡率进行Spearman相关性分析,结果显示,ERS 凋亡分子 CHOP 蛋白表达与细胞凋亡率呈正相关 (r=0.797,P<0.01,n=4)。
讨 论
急性心肌梗死可导致梗死区和非梗死区心肌结构发生改变,继而发生心室扩张和心功能不全。心肌梗死后心室重构在细胞水平的病理变化包括:(1) 病理性心肌细胞肥大伴随胚胎性基因再表达;(2) 心肌细胞凋亡和坏死;(3) 细胞外基质过度沉积或降解增加[20]。本研究通过结扎大鼠左冠状动脉前降支造成心肌梗死,术后24 h开始给予PQS (50、100和200 mg·kg-1·d-1)或牛磺酸 (300 mg·kg-1·d-1)。术后4 周超声心动图检测发现,与sham组比较,AMI组大鼠出现明显左室前壁变薄、心室扩张和心功能下降,证明模型复制成功。本研究中AMI组及用药组大鼠均未表现出心肌梗死后存活心室壁代偿性肥厚,可能与梗死后仅观察4周,梗死后损伤修复时间较短有关。与AMI组比较,PQS可呈剂量依赖性显著抑制心肌梗死后心室扩张,改善心功能。本研究心肌组织TTC染色表明,PQS可显著降低大鼠心肌梗死术后4周时心肌梗死面积。羟脯氨酸是心肌胶原特有的氨基酸,它可代表组织的胶原含量。本研究通过比色法检测非梗死区羟脯氨酸含量发现,与sham组比较,AMI组非梗死区的胶原含量明显增加。与AMI组比较,PQS低、中、高剂量组均有羟脯氨酸含量降低,且呈剂量依赖性。这提示PQS可明显降低心肌梗死后心肌组织胶原含量,改善心室重构。总之,PQS低、中、高剂量组均明显减轻心肌梗死后大鼠心脏结构变化、功能损伤和纤维化程度。
Palojoki等[5]通过结扎Wistar大鼠左冠状动脉前降支,发现大鼠心肌梗死后4周时非梗死区的心肌细胞凋亡明显增加,且心肌细胞凋亡数量与心室舒张末期内压呈正相关。本研究发现,术后4周,与sham组比较,AMI组非梗死区TUNEL阳性的心肌细胞显著增多。本研究选取降低心肌梗死面积、改善心室重构作用最明显的PQS 200 mg·kg-1·d-1治疗组为药物治疗组,进一步研究PQS对心肌梗死后心室重构的保护机制。与AMI组比较,PQS (200 mg·kg-1·d-1) 可显著降低非梗死区心肌细胞凋亡率。提示200 mg·kg-1·d-1的PQS治疗能够减少非梗死区心肌细胞凋亡。
ERS相关凋亡途径可参与不同诱因所致心室重构的病理过程:在主动脉收缩环导致心肌肥大心力衰竭小鼠模型中,GRP78和CHOP表达显著增加[21];Xin等[22]在小型猪左冠状动脉前降支根部放置收缩环,诱导慢性心肌缺血心力衰竭,发现ERS相关凋亡的CHOP、JNK (c-Jun N-terminal kinase)和caspase-12三条途径均可参与慢性心肌缺血导致心衰;陈鹏等[23]发现内质网应激反应的CHOP、JNK和caspase-12三条通路均参与了心梗后心衰中心肌细胞的凋亡;我们前期利用腹主动脉狭窄,诱导大鼠高血压心肌肥厚,发现腹主动脉狭窄可诱导ERS相关CHOP途径,导致心肌细胞凋亡[12]。CHOP介导的凋亡信号通路与线粒体凋亡途径有密切联系,CHOP 可通过下调抗凋亡蛋白Bcl-2表达而促进细胞凋亡,并导致促凋亡蛋白Bax从胞浆向线粒体内易位[24]。本研究发现,与sham组比较,AMI组非梗死区心肌中GRP78、CRT、CHOP和Bax蛋白表达明显增加,Bcl-2蛋白表达明显降低。这提示CHOP介导的ERS相关凋亡参与了心肌梗死后心室重构。外源性牛磺酸可以抑制不同原因诱导的多种细胞的ERS反应[25-26],本研究发现,与AMI组比较,ERS抑制剂牛磺酸可显著降低非梗死区心肌细胞的凋亡率及非梗死区心肌组织GRP78、CRT、CHOP及Bax蛋白表达,升高Bcl-2蛋白表达,进一步提示ERS参与了心肌梗死后非梗死区心肌细胞凋亡的过程。PQS (200 mg·kg-1·d-1) 灌胃4周,可显著降低GRP78、CRT、CHOP及Bax蛋白表达,升高Bcl-2蛋白表达。这提示PQS可通过抑制CHOP介导的ERS相关凋亡,减轻心肌梗死后心室重构。
Qin等[7]结扎兔冠状动脉诱导心肌梗死,发现细胞凋亡涉及到线粒体相关凋亡蛋白细胞色素C等的改变。本研究采用Spearman相关性分析,AMI组非梗死区心肌组织CHOP蛋白表达与心肌细胞凋亡率的相关系数0.797 (P<0.01),提示在CHOP蛋白表达与细胞凋亡率密切相关,CHOP介导的ERS相关凋亡参与了心肌梗死后心室重构过程。但是,CHOP介导相关凋亡仅是细胞凋亡途径的一部分,是否有线粒体凋亡途径及ERS的其它相关凋亡途径参与心肌梗死后心室重构的病理过程,仍需进一步研究。
综上所述,PQS可改善心肌梗死后心室扩张和心功能,降低非梗死区心肌细胞凋亡率,其作用机理与抑制CHOP介导的ERS相关凋亡途径有关,表现为降低心肌梗死诱导的GRP78、CRT和CHOP蛋白表达,增加抗凋亡蛋白Bcl-2表达,降低促凋亡蛋白Bax表达。
[1] Pfeffer MA, Braunwald E. Ventricular remodelling after myocardial infarction: experimental observations and clinical implications [J]. Circulation, 1990, 81(4):1161-1172.
[2] Olivetti G, Capasso JM, Meggs LG, et al. Cellular basis of chronic ventricular remodeling after myocardial infarction in rats [J]. Circ Res, 1991, 68(3): 856-869.
[3] Weisman HF, Bush DE, Mannisi JA, et al. Cellular mechanisms of myocardial infarct expansion[J]. Circulation, 1988, 78(1): 186-201.
[4] Tang XL, Sanganalmath SK, Sato H, et al. Atorvastatin therapy during the peri-infarct period attenuates left ventricular dysfunction and remodeling after myocardial infarction [J]. PLoS One, 2011, 6(9): e25320.
[5] Palojoki E, Saraste A, Eriksson A, et al. Cardiomyocyte apoptosis and ventricular remodeling after myocardial infarction in rats [J]. Am J Physiol Heart Circ Physiol, 2001, 280(6):H2726-H2731.
[6] Sam F,Sawyer DB,Chang DL,et al. Progressive left ventricular remodeling and apoptosis late after myocardial infarction on mouse heart [J].Am J Physiol Heart Circ Physiol, 2000, 279(1): H422-H428.
[7] Qin F, Liang MC,Liang CS. Progressive left ventricular remodeling, myocyte apoptosis, and protein signaling cascades after myocardial infarction in rabbits [J]. Biochim Biophys Acta, 2005, 1740(3): 499-513.
[8] Ren J, Zhang S, Kovacs A, et al. Role of p38α MAPK in cardiac apoptosis and remodeling after myocardial infarction [J]. J Mol Cell Cardiol, 2005, 38(4): 617-623.
[9] Thuerauf DJ, Marcinko M, Gude N, et al. Activation of the unfolded protein response in infarcted mouse heart and hypoxic cultured cardiac myocytes [J]. Circ Res, 2006, 99(8): 275-282.
[10] Boya P, Cohen I, Zamzami N, et al. Endoplasmic reticulum stress induced cell death requires mitochondrial membrane permeabilization[J]. Cell Death Differ, 2002, 9(4): 465-467.
[11] Breckenridge DG, Germain M, Mathai JP, et al. Regulation of apoptosis by endoplasmic reticulum pathways [J]. Oncogene, 2003, 22(53): 8608-8618.
[12] Zhang ZY, Liu XH, Ye YJ, et al. C/EBP homologous protein-mediated endoplasmic reticulum stress-related apoptosis pathway is involved in abdominal aortic constriction-induced myocardium hypertrophy in rats [J]. Acta Physiol Sin, 2009, 61(2): 161-168.
[13] 王承龙, 史大卓, 殷惠军, 等. 西洋参茎叶总皂苷对急性心肌梗死大鼠心肌VEGF、bFGF表达及血管新生的影响 [J]. 中国中西医结合杂志, 2007, 27(4): 331-334.
[14] 殷惠军, 张 颖, 蒋跃绒, 等. 西洋参叶总皂苷对急性心肌梗死大鼠心肌细胞凋亡及凋亡相关基因表达的影响 [J]. 中国中西医结合杂志, 2005, 25(3): 232-235.
[15] Wang C, Li YZ, Wang XR, et al.Panaxquinquefoliumsaponins reduce myocardial hypoxia-reoxygenation injury by inhibiting excessive endoplasmic reticulum stress [J]. Shock, 2012, 37(2):228-233.
[16] Litwin SE, Katz SE, Morgan JP, et al. Serial echocardiographic assessment of left ventricular geometry and function after large myocardial infarction in the rat [J]. Circulation, 1994, 89(1):345-354.
[17] Vandervelde S, van Amerongen MJ, Tio RA, et al. Increased inflammatory response and neovascularization in reperfused vs. nonreperfused murine myocardial infarction [J]. Cardiovasc Pathol, 2006, 15(2): 83-90.
[18] Gavrieli Y, Sherman Y, Ben-Sasson SA. Identification of programmed cell death in situ via specific labelling of nuclear DNA fragmentation [J]. J Cell Biol, 1992, 119(3): 493-501.
[19] Liu XH, Wu XD, Han Y, et al. Signal pathway of cardioprotection induced by monophosphoryl lipid A in rabbit myocardium [J]. Pathophysiology, 2002, 8(3): 193-196.
[20] Zornoff LA, Paiva SA, Duarte DR, et al. Ventricular remodeling after myocardial infarction: concepts and clinical implications [J]. Arq Bras Cardiol, 2009, 92(2): 150-164.
[21] Okada K, Minamino T, Tsukamoto Y, et al. Prolonged endoplasmic reticulum stress in hypertrophic and failing heart after aortic constriction: possible contribution of endoplasmic reticulum stress to cardiac myocyte apoptosis [J]. Circulation, 2004, 110(6): 705-712.
[22] Xin W, Li X, Lu X, et al. Involvement of endoplasmic reticulum stress-associated apoptosis in a heart failure model induced by chronic myocardial ischemia [J]. Int J Mol Med, 2011, 27(4): 503-509.
[23] 陈 鹏, 杨成明, 曾春雨, 等. 心肌梗死后心力衰竭小鼠心肌组织内质网应激相关凋亡途径的研究[J]. 中国病理生理杂志, 2010, 26(6): 1069-1074.
[24] McCullough KD, Martindale JL, Klotz LO, et al. Gadd153 sensitizes cells to endoplasmic reticulum stress by down regulating Bcl-2 and perturbing the cellular redox state [J]. Mol Cell Biol, 2001, 21(4): 1249-1259.
[25] Song H, Kim H, Park T, et al. Characterization of myogenic differentiation under endoplasmic reticulum stress and taurine treatment [J]. Adv Exp Med Biol, 2009, 643:253-261.
[26] Pan C, Giraldo GS, Prentice H, et al. Taurine protection of PC12 cells against endoplasmic reticulum stress induced by oxidative stress [J]. J Biomed Sci, 2010, 17(Suppl 1):S17.
Panaxquinquefoliumsaponinattenuatesventricularremodelingafteracutemyocardialinfarctioninratsbyinhibitingendoplasmicreticulumstress-relatedapoptosis
LIU Mi1, WANG Chen1, WANG Xiao-reng2, SONG Dan-dan2, LIU Xiu-hua2, SHI Da-zhuo1
(1XiyuanHospital,ChinaAcademyofChineseMedicalSciences,Beijing100091,China;2DepartmentofPathophysiology,ChinesePLAGeneralHospital,Beijing100853,China.E-mail:xiuhualiu98@yahoo.com.cn;heartmail@263.net)
AIM: To investigate the effect ofPanaxquinquefoliumsaponin (PQS) on ventricular remodeling after acute myocardial infarction (AMI) in rats and its mechanism.METHODSNinety healthy male SD rats were randomly divided into sham group, AMI group, taurine 300 mg·kg-1·d-1group, PQS 50 mg·kg-1·d-1group, PQS 100 mg·kg-1·d-1group and PQS 200 mg·kg-1·d-1group. AMI models were produced by ligating the left coronary arteries in SD rats. The rats in each treatment group were gavaged with drugs dissolved in water (10 mL·kg-1·d-1), and the rats in sham group and AMI group
equal volume of water. Four weeks after MI, the left ventricle fractional shortening, ejection fraction and structure were evaluated by echocardiography. Myocardial infarct size was measured by 2,3,5-triphenyltetrazolium chloride staining. The hydroxyproline level was measured by colorimetric method. Apoptosis of the cardiomyocytes was detected by TUNEL. In addition, the expression of endoplasmic reticulum stress-related molecules in the noninfarcted myocardium was determined by Western blotting.RESULTSCompared with AMI group, the left ventricular end-systolic dimension in PQS 50 mg·kg-1·d-1group, PQS 100 mg·kg-1·d-1group and PQS 200 mg·kg-1·d-1group decreased by 17.2%, 20.3% and 38.8% respectively,and the left ventricular end-diastolic dimension decreased by 8.91%, 8.95% and 17.20%, respectively.The left ventricular end-systolic volume decreased by 31.4%, 38.5% and 67.0%, respectively, and the left ventricular end-diastolic volume decreased by 18.2%, 18.8% and 34.2%, respectively.The left ventricular ejection fraction increased by 44.9%, 60.1% and 118.0%, respectively,and the fractional shortening increased by 55.4%, 71.0% and 148.0%, respectively.The infarction size decreased by 4.6%, 39.5% and 55.8%, respectively,and the hydroxyproline level in noninfarcted myocardium decreased by 34.5%, 35.9% and 48.7%, respectively. Compared with AMI group, the myocardial apoptotic index in PQS 200 mg·kg-1·d-1group decreased by 27.3%, the protein expression of Bcl-2 increased by 114.0%, and that of Bax, GRP78, CRT and CHOP decreased by 53.1%, 79.9%, 80.8% and 42.5%, respectively. The above mentioned protective effects in PQS 200 mg·kg-1·d-1group and taurine group were similar. The Spearman correlation analysis revealed that CHOP expression had significant positive correlation with apoptotic index (r=0.797,P<0.01).CONCLUSIONPQS attenuates ventricular remodeling in rats. The underlying mechanism may be associated with the inhibition of CHOP-mediated endoplasmic reticulum stress-related cardiomyocyte apoptosis.
Panaxquinquefoliumsaponin; Myocardial infarction; Ventricular remodeling; Endoplasmic reticulum stress; Apoptosis
R361.1
A
10.3969/j.issn.1000- 4718.2013.05.005
1000- 4718(2013)05- 0796- 08
2012- 10- 16
2013- 03- 18
国际科技合作项目 (No. 2010DFA31690); 国家自然科学基金资助项目 (No. 81070130)
△通讯作者 刘秀华 Tel: 010-66939774; E-mail: xiuhualiu98@yahoo.com.cn; 史大卓 Tel: 010-62860499; E-mail: heartmail@263.net
