EphA2及其配体在子宫内膜样腺癌中的表达及其与血管生成的关系*
2013-10-24蒋学风唐琼兰何欣欣姜静茹徐建平王晓玉
蒋学风, 唐琼兰, 何欣欣, 姜静茹, 徐建平, 王晓玉, 罗 新
(1暨南大学附属第一医院妇产科,广东 广州 510632; 2中山大学孙逸仙纪念医院病理科,广东 广州 510120)
EphA2及其配体在子宫内膜样腺癌中的表达及其与血管生成的关系*
蒋学风1△, 唐琼兰2, 何欣欣2, 姜静茹1, 徐建平1, 王晓玉1, 罗 新1
(1暨南大学附属第一医院妇产科,广东 广州 510632;2中山大学孙逸仙纪念医院病理科,广东 广州 510120)
目的探讨生促红素肝细胞受体A2 (EphA2)及其配体ephrin-A1在子宫内膜样腺癌组织中的表达及其与肿瘤血管生成的关系。方法利用免疫组织化学法检测56例子宫内膜样腺癌、20例子宫内膜增生过长、30例正常子宫内膜增殖期和30例分泌期组织中EphA2、ephrin-A1、雌激素受体(ER)和孕激素受体(PR)的表达,并采用CD34抗体标记微血管内皮细胞,计算微血管密度(MVD)。分析EphA2和ephrin-A1的表达与MVD之间的相关性及其与子宫内膜样腺癌临床病理特征的关系。结果子宫内膜样腺癌组织中EphA2和ephrin-A1的表达显著高于子宫内膜样增生过长及正常子宫内膜(P<0.05);EphA2和ephrin-A1表达水平及MVD值与子宫内膜样腺癌FIGO分期、肿瘤分化程度、肌层浸润深度、淋巴微血管浸润和孕激素受体表达有关(P<0.05);Spearman等级相关分析表明EphA2和ephrin-A1表达分别与MVD呈显著正相关(r=0.476,P<0.05;r=0.501,P<0.05)。结论EphA2及其配体ephrin-A1在子宫内膜样腺癌中高表达,可能参与了肿瘤血管生成和孕激素抵抗。
子宫内膜样腺癌; 受体,EphA2; Ephrin-A1; 血管生成
受体酪氨酸激酶(receptor tyrosine kinases, RTKs)是外界刺激信息传递至细胞核,转化成细胞效应的信号转导通路中的关键分子组成。生促红素肝细胞受体A2 (erythropoietin-producing hepatocellular receptor A2,EphA2)是该家族中被发现具有酪氨酸激酶活性的第1个蛋白。研究表明,EphA2可在多种人体肿瘤组织中过表达, EphA2能促进血管内皮细胞的迁移,与其配体Ephrin-A1结合可促进组织和内皮细胞形成毛细血管样结构,在肿瘤新生血管形成及侵袭转移中发挥重要作用[1-2]。EphA2同样可能参与子宫内膜癌的发生[3-4],但有关EphA2及其配体ephrin-A1的表达以及二者与血管生成的关系研究尚少见报道。本实验采用免疫组织化学技术检测子宫内膜样腺癌组织、子宫内膜增生过长及正常内膜组织中EphA2和ephrin-A1的表达,用CD34标记血管内皮细胞,测定微血管密度(microvessel density, MVD),通过分析EphA2、ephrin-A1表达与MVD之间的相关性及其与临床病理特征的关系,探讨EphA2及其配体ephrin-A1对子宫内膜癌中血管生成的作用及临床意义。
材 料 和 方 法
1病例资料
收集2000年1月至2005年1月在我院妇产科因子宫内膜样腺癌行剖腹手术或腹腔镜手术的患者共56例。年龄30~70岁,中位年龄58岁,平均(54.12±10.38)岁,绝经妇女36例,占64.93%。术前均未经过放疗、化疗或其它抗肿瘤治疗。采用国际妇产科联盟(FIGO)2009手术-病理分期标准[5]。子宫内膜增生过长选自同期手术病理证实的石蜡包埋组织,共20例。对照组以同期因子宫肌瘤行子宫全切手术标本,正常增殖期30例,分泌期30例。
2试剂
链亲和素-生物素-过氧化物酶(streptavidin-biotin immunoperoxidase,SP)试剂盒及雌激素受体(estrogen receptor,ER;ZM-0104)、孕激素受体(progesterone receptor, PR;ZM-0215)、CD34(ZM-0046)鼠抗人单克隆抗体购于北京中杉金桥生物技术有限公司,EphA2(C-20)和ephrin-A1(V-18)兔抗人多克隆抗体购于Santa Cruz。
3方法
3.1免疫组织化学法 采用SP染色法,具体操作步骤按SP试剂盒说明书进行。EphA2 Ⅰ抗和ephrin-A1 Ⅰ抗工作浓度为1∶300,CD34 Ⅰ抗工作浓度均为1∶100,ER工作浓度为1∶50,PR工作浓度为1∶100,以乳腺浸润性导管癌为阳性对照,PBS代替Ⅰ抗作阴性对照。
3.2实验结果的判断
3.2.1EphA2和ephrin-A1结果判断 EphA2和ephrin-A1为细胞质呈棕黄色为阳性,根据显色强度分为0~3级[4]。0级:阴性(-),细胞无棕黄色染色;1级:弱阳性(+),细胞染色较淡; 2级:阳性(++),细胞中度染色;3级:强阳性(+++),细胞染色较深。
3.2.2CD34结果判断 每一个染成棕黄色的、可与周围血管、肿瘤细胞和其它结缔组织区分开来的内皮细胞或内皮细胞簇,不论管腔和红细胞出现与否,均作为1个单一的、可计数的微血管;管腔面积>8个红细胞直径,或带有较厚肌层的微血管不计数。
3.2.3MVD计数方法 先于低倍光镜(×40和×100)下确定3个血管着色最密集区域,然后在高倍视野(×400)内计数微血管的数目,取3个视野的均值作为MVD。双盲法判定结果,每张切片由2位病理医师分别判定、计数。2人计数相差10%以上重新计数[6]。
4统计学处理
采用SPSS 13.0软件进行统计学处理。数据以均数±标准差(mean±SD)表示,采用2检验、方差分析及Spearman等级相关分析。以P<0.05为差异有统计学意义。
结 果
1EphA2和ephrin-A1在子宫内膜样腺癌及内膜增生组织中的表达
EphA2和ephrin-A1蛋白阳性表达于细胞浆,呈棕黄色颗粒。在子宫内膜样腺癌组织中EphA2和ephrin-A1蛋白的表达以及阳性率明显高于子宫内膜不典型增生、增殖期和分泌期子宫内膜组织 (P<0.05或P<0.01),而不典型增生、正常增殖期子宫内膜和分泌期子宫内膜组织之间的差异无统计学意义(P>0.05),见图1、表1。

Figure 1. The expression of EphA2,ephrin-A1 and CD34 in endometrial endometrioid adenocarcinoma(EEA;immunohistochemical staining,×100).A: EphA2 expression in EEA grade 1; B: EphA2 expression in EEA grade 3; C:ephrin-A1 expression in EEA grade 1; D: ephrin-A1 expression in EEA grade 3; E: CD34 expression in EEA grade 1; F: CD34 expression in EEA grade 3.
图1EphA2、ephrin-A1和CD34在子宫内膜样腺癌中的表达

表1 EphA2和ephrin-A1蛋白在子宫内膜样腺癌组织中的表达
*P<0.05,**P<0.01vsendometrial endometrioid adenocarcinoma group.
2EphA2、ephrin-A1表达和MVD与子宫内膜样腺癌临床病理特征的关系
CD34主要表达于血管内皮细胞膜。微血管染色呈棕黄色,主要位于腺癌间质区域,见图1。子宫内膜样腺癌组织中MVD(33.19±5.87)显著高于子宫内膜增生过长组织(28.37±6.35;P<0.05)、增殖期(22.86±4.90;P<0.01)及分泌期子宫内膜组织(21.72±4.78;P<0.01)。
EphA2、ephrin-A1表达和MVD与年龄、淋巴结转移和ER阳性无关,而与FIGO分期、肿瘤分化、肌层浸润、淋巴微血管浸润和PR有关(P<0.05),见表2。
在子宫内膜样腺癌组织中,随着分化程度的降低, EphA2和ephrin-A1蛋白的表达显著升高(P<0.05);随肌层浸润深度的增加, 或肿瘤期别越晚,EphA2和ephrin-A1蛋白的表达显著升高(P<0.05);淋巴微血管浸润或孕激素受体阴性,EphA2和ephrin-A1蛋白的表达均显著升高(P<0.05),见表2。
表2EphA2、ephrin-A1表达和MVD与子宫内膜腺癌临床病理特征的关系
Table 2. The relation between the expression of EphA2 and ephrin-A1,MVD and clinicopathological characteristics of endometrial endometrioid adenocarcinoma
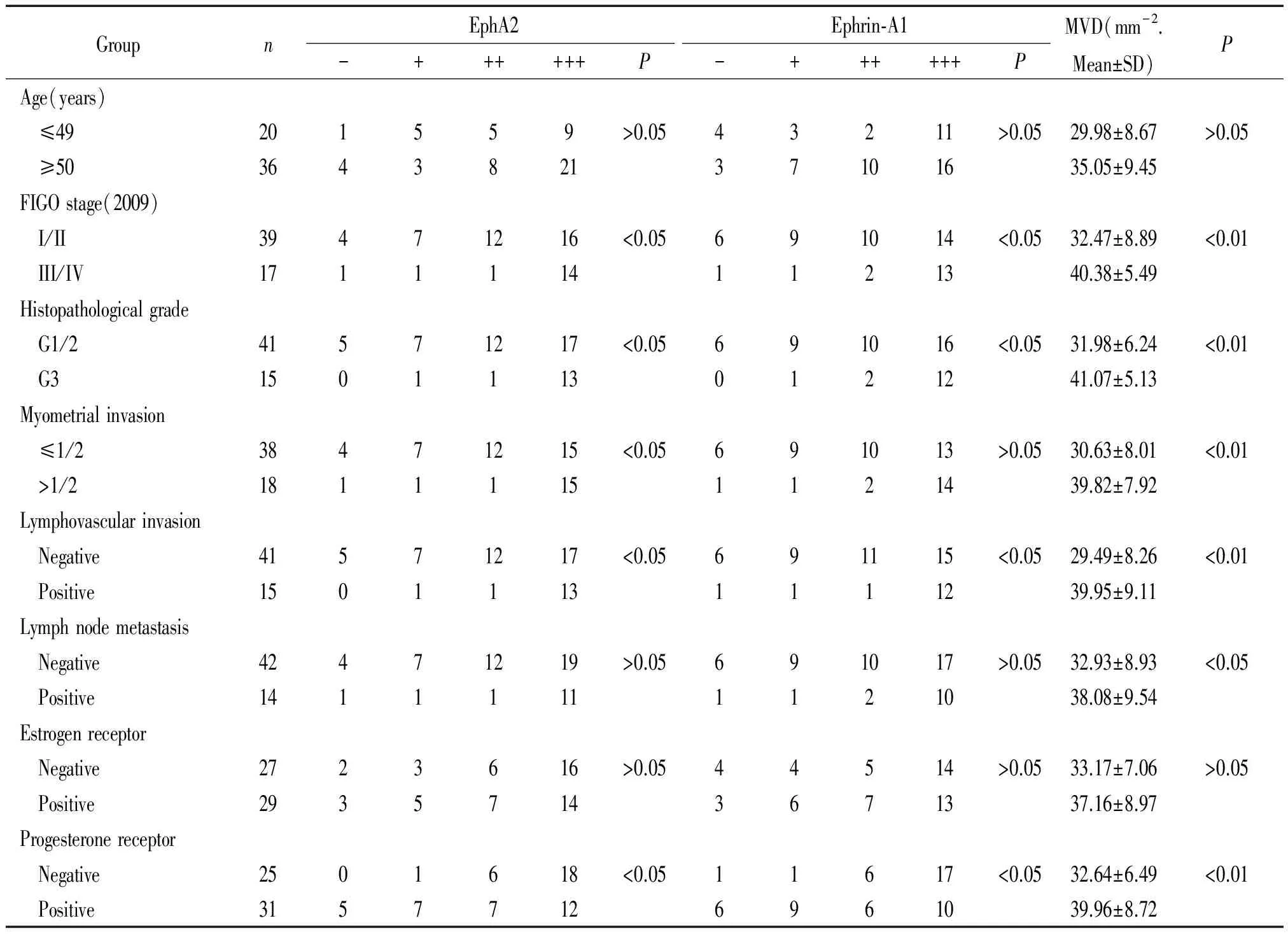
GroupnEphA2Ephrin⁃A1MVD(mm-2.Mean±SD)P-++++++P-++++++PAge(years) ≤49201559>0.0543211>0.0529.98±8.67>0.05 ≥50364382137101635.05±9.45FIGOstage(2009) I/II39471216<0.05691014<0.0532.47±8.89<0.01 III/IV17111141121340.38±5.49Histopathologicalgrade G1/241571217<0.05691016<0.0531.98±6.24<0.01 G315011130121241.07±5.13Myometrialinvasion ≤1/238471215<0.05691013>0.0530.63±8.01<0.01 >1/218111151121439.82±7.92Lymphovascularinvasion Negative41571217<0.05691115<0.0529.49±8.26<0.01 Positive15011131111239.95±9.11Lymphnodemetastasis Negative42471219>0.05691017>0.0532.93±8.93<0.05 Positive14111111121038.08±9.54Estrogenreceptor Negative2723616>0.0544514>0.0533.17±7.06>0.05 Positive29357143671337.16±8.97Progesteronereceptor Negative2501618<0.0511617<0.0532.64±6.49<0.01 Positive31577126961039.96±8.72
3EphA2和ephrin-A1表达与MVD的相关性
在56例子宫内膜腺癌组织中, EphA2表达阴性(-)、弱阳性(+)、阳性(++)及强阳性(+++)组织的MVD分别为(20.19±6.12)、(27.98±5.09)、(33.08±5.92)和(39.72±7.01),ephrin-A1各表达级子宫内膜样腺癌组织的MVD分别为(19.94±6.42)、(26.79±6.09)、(32.74±6.82)和(40.17±6.47)。经方差分析,EphA2和ephrin-A1表达各级别组间MVD均有显著差异(P<0.01);经Spearman等级相关分析, EphA2表达与MVD呈显著正相关(r=0.476,P<0.05),ephrin-A1表达与MVD呈显著正相关(r=0.501,P<0.05),见表3。

表3 EphA2和ephrin-A1表达与MVD的相关性
讨 论
子宫内膜癌(endometrial carcinoma,EC)是西方国家最常见的妇科恶性肿瘤,在我国发病率仅次于宫颈癌,近几年来,子宫内膜癌的发病率呈增高趋势。子宫内膜样腺癌是其最常见的病理类型,它的发生与无孕激素拮抗的雌激素长期刺激密切相关,但其发生机制仍不十分明确[7-8]。肿瘤血管生成(angiogenesis)与肌层浸润仍是子宫内膜样腺癌发生发展的重要特征。因此,针对血管生成的相关基因和蛋白的研究,可以为子宫内膜癌侵袭转移的早期诊断和靶向治疗提供依据。
EphA2是由Lindberg 等[9]于1990 年从人角化上皮细胞cDNA文库中筛选得到的Eph受体酪氨酸激酶(receptor tyrosine kinases, RTKs)之一,是该家族成员第1个被发现有酪氨酸激酶活性的基因。EphA2基因定位于人染色体1p36.1,编码1个含有976个氨基酸残基的多肽,为膜结合型糖蛋白,包括1个氨基末端胞外配体结合域、1个跨膜结构域和1个胞内酶结构域,其中胞内区包含具有酪氨酸激酶活性的结构域(TK)。EphA2受体与其细胞膜上的8种配体(ephrins)任何一种特异性结合,尤其是ephrin-A1,而后产生的信号转导能直接参与各种生理活动,包括细胞连接、迁移、增殖和分化、血管新生等,而EphA2异常时同样可通过信号转导促使肿瘤的发生、肿瘤血管的生成以及肿瘤的侵袭和转移,近年来已成为肿瘤发生发展及耐药机制研究领域的热点之一[10]。
本组资料显示,在正常子宫内膜分泌期、增殖期、内膜增生过长和子宫内膜样腺癌中,EphA2和ephrin-A1表达逐渐升高,而且与MVD相关,提示EphA2及其配体不仅可通过促进血管生成参与子宫内膜癌的发生和发展,而且与正常月经周期子宫内膜的生理性变化有关。EphA2和ephrin-A1在增殖期表达高于分泌期,提示EphA2可能促进细胞增殖和血管新生在子宫内膜增生修复过程中扮演重要角色,从而保证子宫内膜层在卵泡期(约2周)内能迅速增厚超过10 mm,为排卵后的妊娠做好准备。
血管生成是指从已有的毛细血管或毛细血管后静脉发展而成新生血管的过程。肿瘤组织的增殖依赖血液供应,血管生成在肿瘤的生长、侵袭和转移中发挥重要作用。研究表明,EphA2及其配体ephrin-A1在许多恶性肿瘤的血管内皮细胞中共表达[11],二者的结合可促进肿瘤血管内皮细胞的迁移,并通过影响细胞骨架、基质黏附和(或)细胞黏附而促进组织和内皮细胞形成毛细血管样结构,而抑制EphA2的活化可以削弱肿瘤的血管形成[3]。肿瘤血管的新生受多种因子的调节,是促血管因子和血管生成抑制因子间失衡的结果, EphA2促血管生成机制可能是通过与其配体结合,激活下游的一系列信号转导,从而刺激血管内皮生长因子等促血管因子的表达而实现的。本实验结果显示,子宫内膜癌组织中微血管密度显著高于子宫内膜不典型增生及正常子宫内膜,并随子宫内膜癌分化程度的降低、肌层浸润深度的增加、淋巴微血管浸润、肿瘤期别晚等升高,且与EphA2及其配体ephrin-A1的表达呈正相关,表明EphA2可能发挥了血管促进剂的作用,在子宫内膜腺癌血管生成过程中扮演了重要角色。因此,抑制EphA2的活化可削弱肿瘤的血管形成,从而抑制肿瘤的生长和转移。深入开发和应用选择性EphA2抑制剂有望为子宫内膜癌的预防和治疗开辟新的途径[12]。
本组资料也显示子宫内膜样腺癌中EphA2及其配体ephrin-A1的表达与FIGO分期、肿瘤分化、肌层浸润、淋巴微血管浸润和孕激素受体阴性有关。低分化子宫内样膜腺癌高表达的EphA2与配体ephrin-A1结合后,通过促进血管生成,从而有利于肿瘤细胞肌层浸润、转移,促进病情进展,肿瘤的恶性程度提高。近来Voss等[13]认为低分化子宫内膜样腺癌在免疫表型和生物学行为方面具有II型子宫内膜样癌的特征,临床处理上,更应按II型子宫内膜癌进行处理[14], EphA2与ephrin-A1是否是II型子宫内膜癌的免疫表型特征尚需进一步研究。
孕激素受体阴性的子宫内膜样腺癌中EphA2和ephrin-A1均高表达,且EphA2和ephrin-A1的表达与孕激素受体阴性呈正相关。EphA2和ephrin-A1可能与孕激素受体丢失有关[4],从而参与孕激素抵抗,这可能是子宫内膜癌孕激素治疗不敏感的原因之一。高表达EphA2、ephrin-A1的子宫内膜样腺癌可能不宜选择孕激素治疗。因此EphA2和ephrin-A1的表达有望作为早期子宫内膜癌保留生育能力治疗的筛选和疗效观察指标,针对EphA2和ephrin-A1的靶向治疗有望恢复子宫内膜癌孕激素治疗的敏感性,值得从细胞培养和动物模型实验上进一步证实。
[1] Fang WB, Brantley-Sieders DM,Parker MA,et al. A kinase-dependent role for EphA2 receptor in promoting tumor growth and metastasis[J]. Oncogene,2005,24(53):7859-7868.
[2] Brantley-Sieders DM, Fang WB, Hicks DJ, et al. Impaired tumor microenvironment in EphA2 deficientmice inhibits tumor angiogenesis and metastatic progression[J]. FASEB J,2005,19(13):1884-1886.
[3] Merritt WM, Kamat AA, Hwang JY, et al. Clinical and biological impact of EphA2 overexpression and angiogenesis in endometrial cancer[J].Cancer Biol Ther,2011,10(12):1306-1314.
[4] Kamat AA, Coffey D, Merritt WM, et al. EphA2 overexpression is associated with lack of hormone receptor expression and poor outcome in endometrial cancer[J]. Cancer,2009,115(12):2684-2692.
[5] Creasman W. Revised FIGO staging for carcinoma of the endometrium[J]. Int J Gynaecol Obstet,2009,105(2):109.
[6] Weidner N. Current pathologic methods of measuring intratumoral microvessel density within breast carcinoma and other solid tumors[J].Breast Cancer Res Treat,1995,36(2):169-180.
[7] 蒋学风,徐建平,唐琼兰,等.Cyr61蛋白在子宫内膜腺癌中的表达及意义[J].中国病理生理杂志,2009,25(5):1009-1011.
[8] 孙艳花,钟雪云. PTEN与信号转导及肿瘤[J].中国病理生理杂志,2002,18(3):326-329.
[9] Lindberg RA, Hunter T. cDNA cloning and characterization ofeck, an epithelial cell receptor protein-tyrosine kinase in theeph/elkfamily of protein kinases[J]. Mol Cell Biol,1990,10(12):6316-6324.
[10] Tandon M, Vemula SV, Mittal SK. Emerging strategies for EphA2 receptor targeting for cancer therapeutics[J]. Expert Opin Ther Targets,2011,15(1):31-51.
[11] Brantley-Sieders DM, Fang WB, Hwang Y, et al. Ephrin-A1 facilitates mammary tumor metastasis through an angiogenesis-dependent mechanism mediated by EphA receptor and vascular endothelial growth factor in mice[J].Cancer Res,2006,66(21):10315-10324.
[12] Lee JW, Stone RL, Lee SJ, et al. EphA2 targeted chemotherapy using an antibody drug conjugate in endometrial carcinoma[J]. Clin Cancer Res, 2010,16(9):2562-2570.
[13] Voss MA, Ganesan R, Ludeman L, et al. Should grade 3 endometrioid endometrial carcinoma be considered a type 2 cancer-a clinical and pathological evaluation[J]. Gynecol Oncol,2012,124(1):15-20.
[14] Alvarez T, Miller E, Duska L, et al. Molecular profile of grade 3 endometrioid endometrial carcinoma: is it a type I or type II endometrial carcinoma?[J]. Am J Surg Pathol,2012,36(5):753-761.
ExpressionofEphA2andephrin-A1inendometrialendometrioidadenocarcinomaandtheirrelationshipwithangiogenesis
JIANG Xue-feng1, TANG Qiong-lan2, HE Xin-xin2, JIANG Jing-ru1, XU Jian-ping1, WANG Xiao-yu1, LUO Xin1
(1DepartmentofObstetricsandGynecology,theFirstAffiliatedHospitalofJinanUniversity,Guangzhou510632,China;2DepartmentofPathology,SunYat-senMemorialHospital,SunYat-senUniversity,Guangzhou510120,China.E-mail:xuefengjiang@126.com)
AIM: To investigate the expression of erythropoietin-producing hepatocellular receptor A2 (EphA2) and its ligand ephrin-A1 in endometrial endometrioid adenocarcinoma (EEA), and to analyze their relationship with angiogenesis of the tumor.METHODSThe CD34-stained microvessel density (MVD) and the expression of ephA2 and ephrin-A1 were detected by immunohistochemical assay in 56 cases of EEA, 20 cases of endometrial hyperplasia, 30 cases of normal proliferative endometrium and 30 cases of normal secretory endometrium. The correlations among the expression of EphA2 and ephrin-A1, MVD and clinicopathological features were analyzed.RESULTSMVD and the expression of EphA2 and ephrin-A1 in EEA were significantly higher than those in the tissues from endometrial hyperplasia and normal endometrium (P<0.05). They were related to FIGO stage, histological differentiation, depth of myometrial invasion, lymphovascular invasion and progesterone receptor expression (P<0.05). A significant positive correlation between MVD and the expression of EphA2 and ephrin-A1 was observed by Spearman rank correlation test (r=0.476,P<0.05;r=0.501,P<0.05).CONCLUSIONOverexpression of EphA2 and its ligand ephrin-A1 in EEA may be involved in the angiogenesis and progesterone resistance.
Endometrioid adenocarcinoma; Receptors,EphA2; Ephrin-A1; Angiogenesis
R714.2
A
10.3969/j.issn.1000- 4718.2013.05.015
1000- 4718(2013)05- 0857- 05
2012- 12- 31
2013- 03- 25
暨南大学大学生创新创业训练计划(No.1055912068)
△通讯作者Tel: 020-38688769; E-mail: xuefengjiang@126.com
